
2024 年 6 月 11 日至 16 日,北京大學消化腫瘤論壇暨中國胃腸腫瘤臨床研究協作組(CGOG)第十四屆年會在北京盛大舉行,本次大會以「創新、共贏、卓越」為宗旨,立足消化系統腫瘤的精準診療和轉化研究,聚焦最新的研究進展和方向,匯集臨床實踐的難點與熱點,極大地推動了中國消化系統腫瘤的規範化診治。
大會上,來自北京大學腫瘤醫院的 周軍教授 對 胰臟癌新型免疫療法研究進展 做了詳細匯報,「丁香園腫瘤時間」將內容整理如下,以饗讀者。
Claudin18.2(CLDN18.2)
CLDN18.2 是一種泛癌靶點,主要參與腫瘤細胞的增殖分化和遷移。在正常組織中,CLDN18.2 僅在胃上皮細胞高表達,而在腫瘤中,CLDN18.2 在包括胃癌、胰臟癌、膽囊及膽道癌、食道癌以及肺癌等多種腫瘤中廣泛高表達,因此是一種理想的治療靶點。
目前,國內外多家藥企已經開發了針對 CLDN18.2 靶點的多項免疫治療策略,包括單複制抗體(mAB)、雙特異性抗體(BsAbs)、抗體偶聯藥物(ADCs)以及嵌合抗原受體 T 細胞(CAR-T)療法等。同時已有多種藥物處於臨床研究階段,如單複制抗體 Zolbetuximab,靶向 CLDN18.2 和 CD3 的雙特異性抗體 Gresonitamab、ASP2138、AZD5863、QLS31905,靶向 CLDN18.2 和 PD-L1 的雙特異性抗體 Q-1802,靶向 CLDN18.2 和 4-1BB 的雙特異性抗體 Givastomig,ADC 藥物 SYSA1801、CMG901,以及 CAR-T 細胞療法 CT041、LB1908 等等。
EMINYN18.2 研究
今年美國臨床腫瘤學會胃腸道腫瘤研討會(ASCO GI)上報道了一項靶向 CLDN18.2 的 CAR-T 產品 CT041(satri-cel)用於治療晚期胃癌和胰腺導管腺癌的 Ⅰb 期 EMINYN18.2 研究 [1] 。結果顯示,所有患者(7 例胃癌和 12 例胰臟癌)的客觀緩解率(ORR)為 26.3%,中位緩解持續時間(DOR)為 3.7 個月,臨床獲益率(CBR)為 42.1%。其中在胰臟癌中的 ORR 為 16.7%(2/12),中位 DOR 為 3.4 個月,CBR 為 33.3%。該研究初步證實了 CT041 在既往經過多線治療的 CLDN18.2 陽性晚期胃癌和胰臟癌中的有效性。CG4006 和 ST-01 研究的匯總分析
近日,北京大學腫瘤醫院沈琳教授團隊在 Journal of Clinical Oncology 雜誌上發表了一篇題為 Safety and Efficacy of CT041 in Patients With Refractory Metastatic Pancreatic Cancer: A Pooled Analysis of Two Early-Phase Trials 的文章 [2] 。該匯總分析納入兩項關於 CT041 的 Ⅰ 期研究(CG4006 和 ST-01 研究)共 24 例晚期胰臟癌患者,其中 5 例(20.8%)患者既往接受過一線治療,而 19 例(79.2%)患者接受過 ≥2 線治療,研究的主要終點為首次輸註 CT041 後 4 周的安全性和耐受性。結果顯示,24 例患者中 4 例獲得部份緩解(PR),總體 ORR 為 16.7%;13 例(54.2%)患者疾病穩定(SD),疾病控制率(DCR)為 70.8%。24 例患者中有 17 例(70.8%)患者的 CA19-9 水平下降了至少 30%,CA19-9 的中位下降雨平為 73.0%。CT041 回輸後的中位無進展生存期(PFS)為 3.3 個月,中位總生存期(OS)為 10.0 個月,中位 DOR 為 9.5 個月。與療效評估為疾病進展(PD)的患者相比,獲得 PR/CR 患者的中位 PFS(6.0 vs 1.0 個月)和 OS(17.6 個月 vs 4.0 個月)顯著延長。由此可見,靶向 CLDN18.2 的 CAR-T 細胞療法在晚期胰臟癌中展現出了顯著療效及良好的套用前景,目前已有多款產品布局晚期胰臟癌治療。
MSLN 是一種細胞表面腫瘤分化抗原,在正常組織中表達量很低,但在間皮瘤、肺癌、胰臟癌、乳癌、卵巢癌等多種腫瘤中高表達。超過 80% 的胰臟癌存在 MSLN 高表達,且其表達與患者預後呈負相關,是胰臟癌治療的潛在靶點之一。
一項 Ⅰ 期研究 [3] 使用 MLSN CAR-T 治療了 6 例胰臟癌患者,結果 3 例患者達到 SD,1 例患者腫瘤活性下降 69.2%,2 例患者 PFS 分別延長了 3.8 個月和 5.4 個月。同時,一項臨床前研究 [4] 發現,靶向 MSLN 的 CAR-T 細胞可以透過分泌抗 FAP 和 CD3 分子來調節腫瘤基質微環境,進一步產生更強的抗胰臟癌活性。癌胚抗原相關細胞黏附分子(CEACAMs)
CEACAMs 是一類細胞表面糖蛋白家族,存在於上皮組織、內皮細胞和血細胞中,在多種上皮性腫瘤中廣泛高表達,包括結直腸癌、胃癌、胰臟癌、卵巢癌和肺癌等。其中 CEA、CEACAM1、CEACAM5、CEACAM6、CEACAM7 亞家族與腫瘤發生發展最為密切,如 CEA 是臨床常用的腫瘤標誌物,也是治療的潛在靶點之一。
早期臨床前研究顯示,CEACAM7 在胰臟癌組織中高表達,並且在臨床前腫瘤模型中針對 CEACAM7 的 CAR-T 細胞顯示出良好的抗腫瘤活性 [5] 。也有研究正在探索靶向 CEACAM5/6 和 CD3 的雙特異性抗體並已觀察到其較強的抗腫瘤活性 [6] 。T 細胞受體工程 T 細胞治療(TCR-T)
除了 CAR-T 細胞療法外,T 細胞受體工程 T 細胞治療(TCR-T)是近年來抗腫瘤治療領域備受關註的新手段,它將外源性 TCR 引入患者的 T 細胞中,能夠顯著提高 T 細胞對腫瘤抗原的特異性辨識能力,精準辨識和殺傷腫瘤細胞。
早在 2022 年,NEJM 發表的一種新型免疫療法 TCR-T 在業界引起廣泛轟動。一例攜帶 KRAS G12D 突變的晚期轉移性胰臟癌患者單次輸註了 16.2×10 9 個 TCR-T 細胞,一個月後患者的內臟轉移逐漸消退,總體療效為 62%;隨後反應持續 6 個月,總體療效達 72% [7] 。可見 TCR-T 療法治療胰臟癌的療效非常顯著。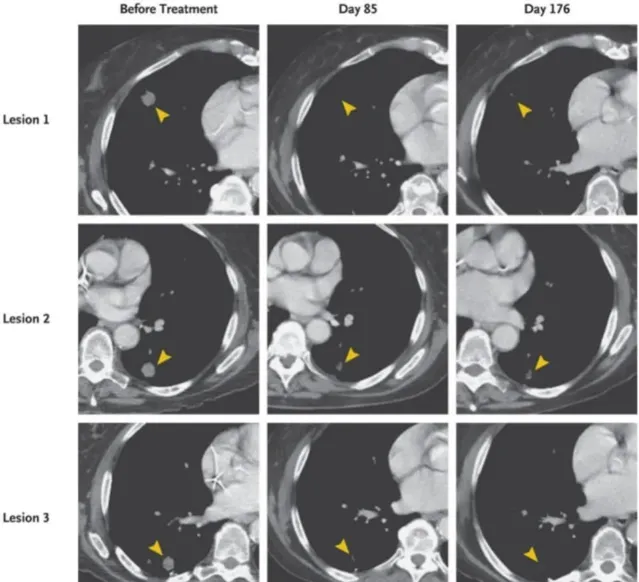
ELI-002 2P 疫苗
ELI-002 2P 是美國研發的一種新型的淋巴結靶向癌癥疫苗,可特異性辨識 KRAS G12D 和 G12R 雙突變,主要用於經局部治療後仍存在分子殘留病竈(MRD)的高復發風險胰臟癌和結直腸癌,以降低腫瘤復發的可能性。
其 I 期 AMPLIFY201 研究 [9] 共納入 20 例胰臟癌和 5 例結直腸癌患者,均為經過手術或化療後仍有 MRD 殘留的高復發風險者。結果顯示,使用 ELI-002 2P 疫苗 6 個月後,21 例(84%)患者觀察到 T 細胞應答,中位無復發生存期(RFS)為 16.33 個月。高於中位 T 細胞應答水平的患者顯示出更好的腫瘤生物標誌物反應和 RFS。特別是在腫瘤生物標誌物反應方面,84% 的患者(21/25)觀察到腫瘤生物標誌物下降,其中 44%(11/25)下降 ≥30%,32%(8/25)下降 ≥50%;更重要的是,24%(6/25,胰臟癌和結直腸癌各 3 例)患者透過 ctDNA 檢測觀察到腫瘤生物標誌物被完全清除。由於 AMPLIFY201 研究的驚人結果,目前相關 Ⅱ 期研究正在進行中。
mRNA 疫苗
mRNA 疫苗的作用機制是將 RNA 在體外進行相關修飾後傳遞至機體細胞內表達並產生蛋白抗原,從而啟用機體的免疫系統,辨識和攻擊腫瘤細胞。新冠疫苗正是典型的 mRNA 疫苗,促進了抗腫瘤 mRNA 疫苗的研發。
2023 年 5 月發表在 Nature 雜誌上的一篇題為 Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer [10] 的文章介紹了一種個人化的 mRNA 新抗原疫苗(autogene cevumeran)及其在胰臟癌中的療效。該疫苗透過 mRNA 表達從胰臟癌患者腫瘤中辨識出的至多 20 個獨特的新抗原,在本研究中透過與 mFOLFIRINOX 標準化療及阿替利珠單抗聯合使用治療經手術切除後的胰臟癌患者。在納入的 16 例患者中,8 例(50%)患者觀察到了明顯的 T 細胞反應。中位隨訪 18 個月後,與無應答者相比,應答者的中位 RFS 更長(未達到 vs 13.4 個月)。雙抗免疫治療
由於胰臟癌特殊的免疫抑制微環境,當前各類以 PD-1/PD-L1、CTLA-4 為靶點的免疫檢查點抑制劑單藥治療均在胰臟癌中響應不佳,而近年來免疫聯合治療表現出獨特的優勢。
卡度尼利單抗是全球第一個 PD-1/CTLA-4 雙特異性抗體,在多種腫瘤中療效顯著,目前已獲批適用於既往接受含鉑化療治療失敗的復發或轉移性宮頸癌患者的治療,同時也在全球範圍內開展了針對多個瘤種的多項研究,如卡度尼利單抗聯合化療一線治療不可手術切除的局部晚期或轉移性胰臟癌的Ⅱ期研究(CTR20230810)。
由於趨化因子受體 2 和趨化因子受體 5(CCR2 和 CCR5)是骨髓細胞遷移到非造血器官和組織中的重要介質。近年來,靶向 CCR2/CCR5 的雙重抑制劑可顯著抑制腫瘤相關巨噬細胞活性,在膠質瘤免疫治療中展現出巨大潛力。而胰臟癌由於獨特的免疫抑制微環境,存在大量的調節性 T 細胞(Tregs)、前腫瘤 M2 樣巨噬細胞和骨髓細胞等免疫抑制細胞。目前也有研究正在探索納武利尤單抗和 CCR2/CCR5 雙抗(BMS-813160)聯合或不聯合 GVAX 疫苗治療局部晚期胰臟癌的 I 期研究,初步顯示出抗腫瘤活性。
小結
盡管目前的免疫檢查點抑制劑在胰臟癌中的療效欠佳,但是基於腫瘤免疫治療的新策略,如新靶點、新型免疫檢查點抑制劑、mRNA 疫苗以及免疫聯合療法均顯示出巨大的潛力,有望為胰臟癌患者提供新的治療選擇。
專家簡介

周軍 教授
北京大學腫瘤醫院
● 北京大學腫瘤醫院消化內科 主任醫師
參考文獻
[1] Gregory P Botta, et al. CLDN18.2 chimeric antigen receptor T cell therapy for patients with advanced gastric and pancreatic adenocarcinoma: Results of ELIMYN18.2 phase 1b clinical trial. 2024, ASCO GI, Abstract 356.
[2] Qi C, Zhang P, Liu C, et al. Safety and Efficacy of CT041 in Patients With Refractory Metastatic Pancreatic Cancer: A Pooled Analysis of Two Early-Phase Trials. J Clin Oncol. 2024 May 24:JCO2302314.
[3] Beatty GL, O'Hara MH, Lacey SF, et al. Activity of Mesothelin-Specific Chimeric Antigen Receptor T Cells Against Pancreatic Carcinoma Metastases in a Phase 1 Trial. Gastroenterology. 2018 Jul;155(1):29-32.
[4] Wehrli M, Guinn S, Birocchi F, et al. Mesothelin CAR T Cells Secreting Anti-FAP/Anti-CD3 Molecules Efficiently Target Pancreatic Adenocarcinoma and its Stroma. Clin Cancer Res. 2024 May 1;30(9):1859-1877.
[5] Raj D, Nikolaidi M, Garces I, et al. CEACAM7 Is an Effective Target for CAR T-cell Therapy of Pancreatic Ductal Adenocarcinoma. Clin Cancer Res. 2021 Mar 1;27(5):1538-1552.
[6] Liand Chen, et al. A bispecific T cell engager targeting CEACAM-5/6 exhibits strong anti-tumor efficacy in pre-clinical studies. 2022, AACR, Abstract 5554.
[7] Leidner R, Sanjuan Silva N, Huang H, et al. Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer. N Engl J Med. 2022 Jun 2;386(22):2112-2119.
[8] Ivics Z, Hackett PB, Plasterk RH, et al. Molecular reconstruction of Sleeping Beauty, a Tc1-like transposon from fish, and its transposition in human cells. Cell. 1997 Nov 14;91(4):501-10.
[9] Pant S, Wainberg ZA, Weekes CD, et al. Lymph-node-targeted, mKRAS-specific amphiphile vaccine in pancreatic and colorectal cancer: the phase 1 AMPLIFY-201 trial. Nat Med. 2024 Feb;30(2):531-542.
[10] Rojas LA, Sethna Z, Soares KC, et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature. 2023 Jun;618(7963):144-150.
編輯:lsh;題圖:丁香園創意團隊











