腫瘤特異性T細胞在抗腫瘤免疫中起著至關重要的作用,是癌癥免疫治療的靶點。 然而,這些細胞在腫瘤微環境(TME)中數量稀少且功能耗竭,導致大多數癌癥患者的免疫治療無效。相比之下,新出現的證據表明腫瘤無關的旁觀者T細胞(TBYS)豐富,並在TME中保持功能記憶特性。
2024年4月12日,陸軍軍醫大學葉麗林、中國農業大學張國中、北京大學白凡及南京大學李顏共同通訊在 Nature Cancer 線上發表題為「 An oncolytic virus delivering tumor-irrelevant bystander T cell epitopes induces anti-tumor immunity and potentiates cancer immunotherapy 」的研究論文,該研究設計了編碼TBYS表位(OV- byte)的溶瘤病毒(OV),將腫瘤細胞的抗原特異性轉移到預先存在的TBYS細胞上,從而在多個臨床前模型中實作了有效的腫瘤抑制。
在機制上,OV-BYTE誘導腫瘤抗原的表位擴散,以引發更多樣化的腫瘤特異性T細胞反應。值得註意的是,針對人類嚴重急性呼吸症候群冠狀病毒2 (SARS-CoV-2)特異性T細胞記憶的OV-BYTE策略在人類腫瘤細胞來源的異種移植模型中有效抑制了腫瘤進展, 為改善具有SARS-CoV-2感染史或冠狀病毒病2019 (COVID-19)疫苗接種史的大量人群的癌癥免疫治療提供了重要見解。

在急性感染或接種疫苗後,記憶T (TMEM)細胞形成並提供長期保護以抵抗同源病原體。 相比之下,T細胞的功能衰竭在許多慢性感染和癌癥中已經得到了很好的表征。特異性辨識腫瘤抗原的腫瘤浸潤性CD8+T細胞表現出典型的衰竭相關表型,包括效應功能、增殖能力和記憶潛力的逐漸喪失, 同時具有一組抑制性免疫檢查點受體(例如PD-1、CTLA-4和TIM-3)的升高和持續表達。
針對這些抑制性免疫檢查點受體的阻斷抗體,稱為免疫檢查點阻斷(ICB) ,可以使TME中耗盡的CD8+T (TEX)細胞重新煥發活力,從而使TME中的CD8+T (TEX)細胞恢復活力,為ICB臨床療效奠定基礎。盡管針對PD-1程式性細胞死亡配體1 (PD-L1)交互作用的ICB療法在一部份癌癥患者中有持久的緩解,但在某些癌癥型別中,總體緩解率仍然適度,甚至是惰性的,這可能部份解釋為ICB療法並沒有從根本上改變TEX細胞中耗盡遺傳的表觀遺傳程式,也沒有重新編程這些細胞分化為TMEM細胞。
越來越多的證據表明,腫瘤衍生抗原的特異性辨識僅限於一小部份腫瘤浸潤T細胞,而絕大多數腫瘤浸潤T細胞辨識腫瘤無關抗原,特別是常見的病毒抗原,因此被定義為「TBYS細胞」。據報道,腫瘤浸潤的TBYS細胞表現出tmem相關表型;然而,它們的詳細分化狀態並沒有很好地表征。特別是,CD8+TBYS細胞和CD4+細胞在TME中是否具有相似的記憶特征尚不清楚。此外,由於TME中TBYS細胞的數量和功能遠遠超過腫瘤特異性的TEX細胞,如果原位TBYS細胞能夠被重新利用來消除腫瘤細胞,將具有很大的治療價值。
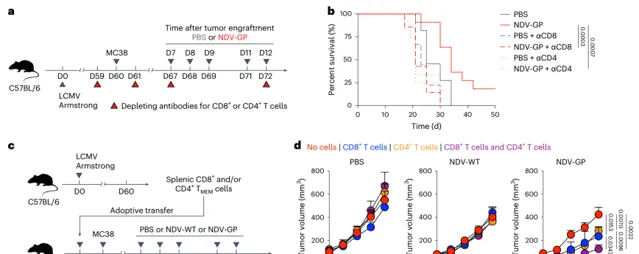
OV-BYTE治療的抗腫瘤作用歸因於病毒特異性CD8+和CD4+TBYS細胞(Credit:Nature Cancer)
OV是一種高度通用的平台,可以將各種有效載荷送入腫瘤細胞。 許多具有強致瘤性的DNA或RNA病毒已被提出作為OV免疫治療的載體,如單純皰疹病毒(HSV)、腺病毒和新城疫病毒(NDV)。到目前為止,OV免疫療法已經在大約100個臨床試驗中進行了研究,其中編碼顆粒球-巨噬細胞集落刺激因子(稱為T-VEC)的改良HSV已被FDA批準,另一種三突變HSV(稱為G47Δ)已被批準用於治療復發性膠質母細胞瘤。
目前尚不清楚OV是否可以被利用來驅動腫瘤細胞呈遞TBYS細胞特異性抗原,從而導致腫瘤細胞被TME中具有功能記憶特性的TBYS細胞根除。 總之,該研究發現OV-BYTE療法將功能性TBYS細胞的細胞毒性重新導向到腫瘤細胞,以改善腫瘤控制,並與PD-L1 ICB具有協同作用。 因此,OV-BYTE與PD-1和/或PD-L1 ICB的聯合可能會擴大癌癥免疫治療的工具包。











