
如果一切順利,患者最多長出5個「迷你肝臟」。
撰文丨淩駿
3月25日美國休士頓,臨床醫生在一台手術中將5000萬個肝細胞註入患者體內,如果進展順利,這名終末期肝衰患者將長出一個全新的肝臟。
這種治療方式被稱為「再生細胞移植療法」,由美國生物科技公司LyGenesis研發,目前已推進至2A期臨床試驗,並完成了全球首例患者給藥,近日患者順利出院。
在人體中培育出新的器官正在成為現實。「這是再生醫學領域的一個裏程碑。肝再生是組織再生中尤其困難的一個方向,幾十年來都沒有重大進展。」再生醫學專家、南京大學生命科學院副院長董磊教授告訴「醫學界」,他和團隊正致力於在動物脾臟中再生出有生理功能的肝臟。
作為終末期肝病(ESLD)的潛在治療方法,註射5000萬個肝細胞只是LyGenesis的第一步計劃。在接下去的臨床試驗中,其他患者最多將被註射2.5億個肝細胞,長出5個迷你肝臟,以替代壞死的原肝臟工作。
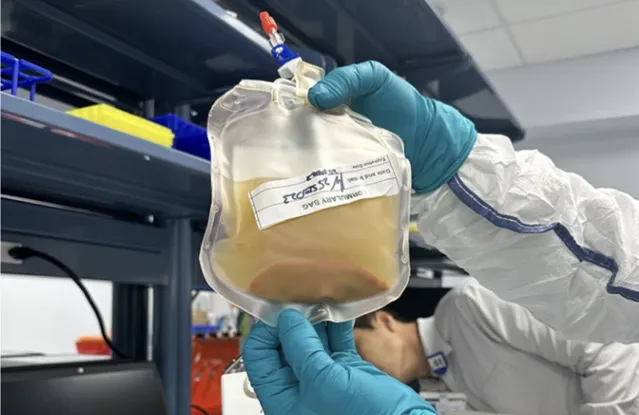
含有5000萬個肝細胞的細胞溶液
用淋巴結「孵化」肝臟
肝臟具有很強的再生能力,即便被切除一半,剩余的健康組織也能在幾個月內恢復到原始肝的大小。可如果肝損傷過於嚴重,肝移植可能就是患者的唯一選擇。
但對於一些年邁,或患有合並癥等的患者,他們的健康狀況並不一定能支持移植手術。另一方面,供體器官短缺是全球器官移植最大的障礙,合適的移植肝並非總能及時出現。因此,機械器官、異種生物器官移植和器官再生,已成為三大革命性的器官疾病解決方案。
根據LyGenesis的計劃,研究人員要先從捐贈的肝臟中分離出肝細胞,並將其註射到患者受損肝臟附近的淋巴結中,一個供肝可以同時給幾十名患者使用。同時,供肝還可以是「不完美」的,它也許匹配不到合適患者,又或者存在組織缺陷要被「丟棄」,但在再生療法中,研究人員只需取供肝中一部份健康的組織,就可以用於治療。
在3月25日首例患者的手術中,醫生將一根末端帶有網路攝影機的柔性細管穿過患者的喉嚨,穿過消化道,並聯合超聲辨識出了肝臟附近的一個目標淋巴結,5000萬個肝細胞隨之註入。
一旦註射完成,受損肝組織發出的「求救訊號」就會抵達目標淋巴結,指導新的肝細胞在淋巴結內孵化、生長。按照前期動物實驗的結果,隨時間推移,淋巴結會完全消失,最終發育成高度血管化的迷你肝臟,過濾血液,支持原生肝臟的功能。
根據【自然】報道,目前首例受試者已經出院,需要長期服用免疫抑制劑對抗排斥反應。研究人員還需要幾個月的時間,判斷術後迷你肝臟的發育和功能情況,以持續推進試驗開展。
值得一提的是,LyGenesis還宣布和另一家再生醫學公司iTolerance展開合作,目前正在開發一種技術,「使異位肝臟能夠在不需要免疫抑制的情況下生長。」
器官再生
「這種療法會成為再生醫學的一個裏程碑......有助於扭轉當前的器官供需失衡,向有利於患者的方向傾斜。」公司執行長Michael Hufford博士在新聞稿中表示。LyGenesis的「野心」並不僅僅滿足於再生肝臟,透過類似的方法,他們還在動物的淋巴結中培養了胸腺、腎臟和胰腺。
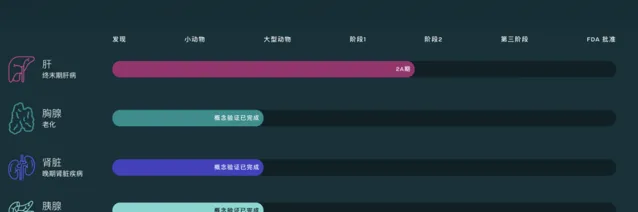
LyGenesis目前的產品管線
「從技術層面,LyGenesis的療法並不存在絕對難點,關鍵在於發現了一個能實作體內肝再生的新策略,又經過十多年的驗證,首次推進到臨床試驗階段。」董磊告訴「醫學界」。肝再生研究迄今已有幾十年歷史,但全球範圍內,真正在臨床階段有進展的研究鳳毛麟角。
「最常規的做法之一是傳統的組織工程方案,即先用生物材料搭建一個人工的模擬組織基質結構的‘框架’,然後在框架中植入功能細胞,透過體外或體內的培育,使這一結構發育成有功能的組織或器官。」
「但這一方案始終未能在肝臟這一類大型復雜器官的再生中獲得突破,其中最核心的挑戰是血管化,即如何在人工培育組織中生成足夠的功能完善的血管,並與人體迴圈系統整合。」董磊說。
既然難以「制造血管」,科學家隨後將目光轉向利用自體組織。【淺析類器官與肝臟再生研究進展】一文指出,可在腸系膜、脾臟或腎包膜下進行異位移植,這些類器官可形成具有功能性血管的獨立「迷你肝臟」單元,新生血管自發地整合到宿主的血管系統中。
LyGenesis聯合創始人Eric Lagasse博士就是其中一員。2012年,他和團隊在【自然·生物技術】釋出研究,表明將肝細胞註射到小鼠淋巴結12周後,重新長出了肝塊,小鼠也從致命的肝功能衰竭中緩解。
「人體有超過500個淋巴結,淋巴結內具有良好的血供環境,有一些獨特的組織構造,比較適合用於組織再生。」董磊說。為了進一步推進臨床轉化,2017年LyGenesis公司正式成立,並接連在小鼠、豬和狗的淋巴結中培育出了迷你肝臟。
在豬的迷你肝臟中,Eric Lagasse團隊發現了運輸膽汁的細胞。在小鼠實驗中,團隊發現如果受損的原位肝剩余足夠的健康組織,一些新植入的肝細胞會從淋巴結遷回,幫助原肝再生和愈合。此時,新的迷你肝臟會對應縮小,使肝臟組織的總量保持平衡。
2020年,美國FDA批準了此次臨床試驗。但根據【自然】報道,目前還不清楚人類的「迷你肝臟」到底會長到多大。同時,針對不同型別的肝病,需要用到多少個淋巴結,長出幾個肝臟,還需要進一步評估。
根據研發團隊的預測,迷你肝臟只要能起10%-30%的原肝輔助作用,就足以對患者產生重大影響。比如它可以幫助代謝血氨——在終末期肝病中,氨會在血液中積聚並進入大腦,導致混亂、情緒波動,甚至昏迷。
「迷你肝臟可能無法緩解所有終末期肝病的並行癥,比如嚴重的門靜脈高壓。」英國愛丁堡大學肝病學家Stuart Forbes對【自然】分析,「但它提供了一個‘權宜之計’,幫助患者等待肝臟移植。」
「很難說迷你肝臟能完全替代原肝臟。在淋巴結中培育肝組織,最大挑戰是單個淋巴結體積太小,容納不了太大的肝組織。」董磊同樣對「醫學界」分析,「人肝有上百億個肝細胞,而一個淋巴結只註射了5000萬個。假設要拿出人體10%-20%的淋巴結進行培育,可能會對免疫系統帶來很大損傷。」
「因此他們這個策略要真正在體內發揮出肝臟的生理功能,未來需要克服的障礙就是如何提升能夠植入體內,且能存活下來的肝細胞數量。肝臟是高度依賴體積的器官,如果肝細胞總量不夠,就不太可能有顯著的生理作用。」董磊說。
據了解,LyGenesis本次臨床試驗共招募了12名患者,後續還有「中劑量組(1.5億個肝細胞)」和「高劑量組(2.5億個肝細胞)」,最多將有5個淋巴結同時發育成迷你肝臟,最終試驗結果預計在2026年初公布。
能解決什麽問題?
「器官再生的策略有很多,透過向現有的器官中植入目標功能性細胞或組織結構單元,是一個重要方向,目前也只有這一技術方案能夠解決體內血管化的問題。」董磊告訴「醫學界」,在這個方向上,胰島在肝臟中的再生進展相對最快,目前已經建立了標準的細胞獲取、純化流程,或將最快實作臨床套用。
「其他大型復雜器官的再生進展都比較緩慢。以心臟為例,它是一個高度依賴結構的器官,若把一群心肌細胞‘堆’在一起,無論在微觀還是宏觀結構方面,都難以長成原心臟的樣子。」董磊說,而肝臟的代謝功能對結構依賴程度較低,可以透過簡單的細胞移植和組織發育,來實作其部份功能。
但肝臟的問題在於,它實在是太大了。肝臟是人體最大的內臟器官,一個成年男性的肝臟大約有1.5kg。
「事實上,LyGenesis的肝再生療法也降低了臨床目標,即迷你肝臟能起到輔助或短期支撐作用就算成功。」董磊說,「要造出具有完備生理功能的肝臟,需要尋找內部空間更大,且能容納肝組織在其中生長發育的移植場所,目前人體內能匹配的只有脾臟。脾臟血供豐富,組織結構疏松,內部空間很大,容易在其中培育出接近天然肝臟一半大小的肝組織。」
據悉,董磊團隊從2012年就啟動了在脾臟內進行肝再生的研究。2020年6月,聯合澳門大學,團隊在Science Advance上釋出研究成果,經肝細胞移植成功將小鼠的脾臟改造成了具有肝功能的器官。2022年1月,發表於GUT的論文進行了技術升級,利用重編程技術,不依賴移植,直接讓小鼠脾臟發育成肝組織。
在上述實驗中,小鼠在90%肝切的情況下,僅依賴脾臟中再生肝組織的支持得以存活,證明在脾臟中再生出的肝組織,由於體積可以長得很大,所以具有比較完備的生理功能。

但董磊坦言,計畫還處於基礎研究的最佳化階段,離臨床轉化尚有一定距離。他認為,終末期肝病患者往往處於非常差的健康狀態,迫切需要肝功能的支撐,或難以接受比較耗時的再生方案。因此,在淋巴結或脾臟中進行肝再生,更為合理的臨床套用場景或在於單基因遺傳性肝病。
「肝臟參與代謝過程繁多,任何一個代謝途徑的關鍵基因出現問題,包括尿素代謝異常、銅代謝異常、乳酸代謝障礙等,不加以治療可能最終誘發終末期肝病。」董磊分析,若在疾病早期,能在患者體內培育出「第二個」肝互相配合,原肝發揮其他正常功能,新肝臟則只矯正有缺陷的單基因遺傳病,那諸多遺傳肝病或許能得到一個統一的解決方案。
同時,基於自體細胞的肝再生,理論上可避免移植排斥,對患者來說非常有意義。
「這項研究非常具有挑戰性,需要生物學、基礎和臨床醫學、幹細胞、基因編輯、生物材料等多個領域的通力配合。」董磊說,「這也是此次臨床試驗的意義所在。作為一個先行者,它讓學界和監管機構意識到,目前有一個不同於傳統組織工程學的思路,有望在肝再生領域實作重要突破。」
「醫學前沿」專欄
探索前沿醫學,展示創新技術。
「醫學界」特推出「醫學前沿」專欄,旨在以「專業化、系統化、高價值、突破性」為核心,挖掘醫學研究中的先鋒探索和硬核成就,解碼新發現、新技術、新進展、新套用。
若您所在單位/機構/科室在臨床診療、學術科研上有新的發現、新的進展和新的套用,歡迎聯系我們,共同傳播醫學前沿資訊。
信箱:
責編:田棟梁
編輯:趙 靜
*「醫學界」力求所發表內容專業、可靠,但不對內容的準確性做出承諾;請相關各方在采用或以此作為決策依據時另行核查。










