*僅供醫學專業人士閱讀參考
直擊乳癌盛會,ADC研究搶先看!
撰文丨 是橘不是桔
2023 聖安東尼奧乳癌會議(SABCS)即將開幕!近年來,在科學家和臨床醫生的共同努力下,乳癌的診斷與治療取得了長足進步,新的生物標記物不斷被發現,個體化治療的方案也日益豐富。其中,抗體藥物偶聯物(ADC)作為腫瘤領域的研究熱點,在乳癌領域的研究也如火如荼。 趕快跟隨醫學界小編,共同探索入選此次SABCS大會的重磅ADC相關研究內容吧 !
全新探索!HER2陽性患者迎治療新篇章
1、HER2CLIMB-02:Tucatinib和恩美曲妥珠單抗治療經治HER2陽性轉移性乳癌的隨機化、雙盲、III期試驗
(研究結果將於SABCS會議期間公布)
2、III期JCOG1607 HERB TEA研究:恩美曲妥珠單抗與曲妥珠單抗、帕妥珠單抗和多西他賽治療HER2陽性轉移性乳癌(mBC)老年患者的療效與安全性比較
對於HER2陽性mBC患者,曲妥珠單抗、帕妥珠單抗和多西他賽聯合用藥(HPD)被推薦為一線治療方案。但對於老年患者來說,HPD常常會帶來不可承受的毒性,很難保持足夠的劑量強度。因此,老年患者群體亟需毒副作用較小且不劣於HPD療效的新型治療方案。
研究納入年齡65歲及以上、既往未接受過化療和抗HER2靶向治療的HER2陽性mBC患者。治療方案為恩美曲妥珠單抗(T-DM1)3.6mg/kg Q3W,或HPD方案(曲妥珠單抗8mg/kg,然後6mg/kg;帕妥珠單抗840mg,然後420mg/人;多西他賽60mg/m 2 ,若無不可控制的毒副作用可以提高至75mg/m 2 )Q3W,按1:1隨機分組。研究主要終點為總生存期(OS),次要終點為無進展生存期(PFS)、有效率(RR)、不良事件、乳癌特異性死亡累積率(BCSM)、安全性和日常活動下降情況等。
2018年1月至2023年3月期間,總共招募了148例患者。T-DM1組和HPD組的中位年齡分別是72歲和71歲。兩組間激素受體(HR)陽性患者的比例平衡。T-DM1組相比HPD組在OS方面未達到非劣效性終點(HR 1.487)。T-DM1組和HPD組的PFS分別為9.8個月和18.4個月。T-DM1組的RR(52.7%)低於HPD組(76.8%)。T-DM1組的BCSM高於HPD組。T-DM1組中3級或以上嗜中性球減少癥發生率低於HPD組(0 vs 30.4%),但血小板減少發生率(16.9%)高於HPD組(0%)。T-DM1組3級或以上非血液學不良反應(35.2%)低於HPD組(58.6%),包括乏力(5.6% vs 22.9%)、腹瀉(0% vs 11.4%)、食欲減退(8.5% vs 11.4%)以及發熱性嗜中性球減少(0% vs 10.0%)。
T-DM1在OS方面未達到HPD的非劣效性結局,但是T-DM1在不良事件發生率和嚴重程度方面結局良好。由於乳癌老年患者具有異質性的健康狀況,因此,根據年齡或老年評估進行亞組分析有可能辨識出更適合T-DM1治療方案的HER2陽性mBC老年患者群體。
重磅更新!HER2低表達mBC患者預後再提升
1、德曲妥珠單抗(T-DXd)聯合阿那曲唑或氟維司群治療HER2低表達、HR+晚期/轉移性乳癌患者:一項Ib期、開放標簽、多中心、劑量擴充套件研究(DESTINY-Breast08)
DESTINY-Breast08(DB-08)旨在確定德曲妥珠單抗(T-DXd)與廣泛使用的標準治療方案在HER2低表達、HR陽性轉移性乳癌(mBC)患者中的安全性、耐受性和初步活性。此次會上報告的結果來自於DB-08研究的劑量擴充套件階段,主要探索了T-DXd與內分泌治療(ET)的聯合療法。
研究納入HER2低表達且HR+的晚期/轉移性mBC患者。患者接受T-DXd 5.4 mg/kg 靜脈註射(IV)每三周1次(Q3W)+口服阿那曲唑1mg每日(T-DXd+ANA)或T-DXd 5.4 mg/kg IV Q3W +氟維司群500 mg肌內註射Q4W(T-DXd+FUL)。研究主要終點為安全性和耐受性,次要終點包括客觀緩解率(ORR)、PFS、緩解持續時間(DoR)和OS。
截至2023年2月,T-DXd+ANA組中21名患者和T-DXd+FUL組中20名患者接受了治療。中位年齡分別為55歲和66歲,T-DXd+ANA組中67%和T-DXd+FUL組中75%的患者曾接受過內分泌±靶向治療,T-DXd+ANA組中33%和T-DXd+FUL組中25%的患者沒有接受用於轉移性乳癌的前期治療。T-DXd+ANA組和T-DXd+FUL組的中位隨訪時間分別為12.1個月(範圍4.0-17.3個月)和8.5個月(範圍1.3-15.1個月)。T-DXd+ANA組中95.2%的患者和T-DXd+FUL組中100%的患者發生了不良事件(AEs),T-DXd+ANA組47.6%的患者和T-DXd+FUL組55.0%的患者發生≥3級AEs。透過減量或中斷藥物可控制不良事件。T-DXd+ANA組的ORR為71.4%,T-DXd+FUL組為40.0%。總生存數據尚未達到。
表1 安全性與療效結局
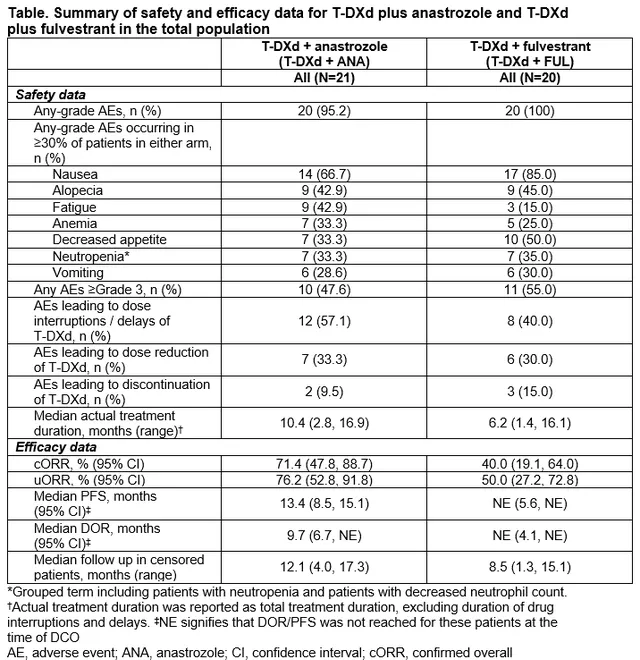
T-DXd聯合內分泌治療方案的安全性結局與T-DXd單藥治療相當,透過劑量調整和常規臨床實踐可控制。T-DXd聯合阿那曲唑或氟維司群在HER2低表達、HR陽性mBC患者的一線或二線治療中表現出活性。
2、BB-1701在局部晚期/轉移性HER2低表達乳癌癥患者中的安全性、耐受性、藥代動力學和抗腫瘤活性的I期研究佇列擴充套件報告
BB-1701是一種新型ADC藥物,由與曲妥珠單抗相同序列的人源化IgG1κ單複制抗HER2抗體與艾立布林連線而成。艾立布林是一種微管抑制劑,已獲批用於治療失敗後的mBC和進展性脂肪肉瘤的治療。本研究報告了BB-1701在HER2低表達乳癌患者中正在進行的I期佇列擴充套件試驗的初步結果(NCT04257110)。
研究納入≥18歲,經確診為局部晚期/轉移性HER2低表達乳癌(IHC 2+且FISH陰性,或IHC 1+),並經歷至少兩線標準治療失敗且ECOG PS≤2的患者。HER2表達情況在入組前透過IHC和FISH確定。樣本擴增組給予4組劑量水平的BB-1701(1.0 mg/kgQ3W、1.2 mg/kg Q3W、1.4 mg/kg Q3W和1.6 mg/kg Q3W)。研究旨在評估BB-1701的安全性、耐受性和初步抗腫瘤活性。患者每6周接受一次放射學評估。
截至2023年6月30日,共入組40例患者。其中,1.0 mg/kg Q3W組5例,1.2 mg/kg Q3W組20例,1.4 mg/kg Q3W組5例,1.6 mg/kg Q3W組10例。中位年齡55歲(範圍30-74歲),女性占97.5%,ECOG PS 0級/1級患者分別占30.0%/70.0%。中位治療線數為3(範圍2-9)。所有患者治療期間均至少出現1種AEs,30例患者出現治療相關不良事件(TRAEs)。最常見的所有級別TRAEs(≥20%)為周圍神經病變、天門冬胺酸胺基轉移酶升高、丙胺酸胺基轉移酶升高、貧血、白血球計數減少。3級TRAEs包括周圍神經病變(3例)、周圍感覺神經病變(2例)、嗜中性球計數減少(2例)、血小板計數減少(1例)、白血球計數減少(1例)。未見4級或5級事件。嚴重TRAEs包括感覺神經病變(1例)和輸液反應(1例)。未報告間質性肺病。無患者因AEs中止治療。在38例可評估療效的患者中,1.0mg/kg組有2例達到部份緩解(PR),2例疾病穩定(SD),最佳總體療效(BOR)為40.0%,疾病控制率(DCR)為80.0%。1.2mg/kg組有5例達到PR,11例SD,BOR為27.8%,DCR為88.9%。1.4mg/kg組有2例達到PR,2例SD,BOR為40.0%,DCR為80.0%。
總體而言,BB-1701在HER2低表達乳癌中的初步抗腫瘤活性顯示出潛力,包括之前接受過抗HER2藥物聯合化療的患者,並且安全性也可控。
結果喜人!Dato-DXd BC亞組數據更新
在HR+、HER2-不可手術或轉移性乳癌中比較Datopotamab deruxtecan(Dato-DXd)與化療的隨機III期研究:TROPION-Breast01的療效、安全性和生物標誌物結果
III期 TROPION-Breast01全球研究(NCT05104866)評估了以TROP2為靶點的ADC藥物Dato-DXd與依托泊苷、紫杉醇、卡培他濱或吉西他濱(ICC)聯合化療方案在不能手術或轉移性HR+/HER2‒的患者中的療效。主要結果已在2023 ESMO大會上公布。此次SABCS大會上將公布TROPION-Breast01研究的擴充套件數據。
研究納入年齡≥18歲,不能手術或轉移的HR+/HER2‒、藥物治療失敗或不適合繼續藥物治療且已接受1-2個線系統化療的乳癌患者。患者按1:1隨機分組,分別給予Dato-DXd(Q3W 6mg/kg)或ICC直至疾病進展或不可耐受的毒性。研究主要終點為盲性獨立中心評估(BICR)的PFS和OS(RECIST 1.1標準)。
截至2023年7月17日,共納入732例患者,其中Dato-DXd組365例, ICC組367例。Dato-DXd組和ICC組分別有93例/39例患者仍在治療中。接受Dato-DXd治療的患者PFS顯著優於ICC組。在轉移前線數(1線vs 2線)、以前使用CDK4/6抑制劑時間(≤12個月vs >12個月)、轉移前使用藥物治療時間(<6個月vs ≥6個月)和腦轉移(有vs無)等預定義的亞組中,Dato-DXd組PFS均優於ICC組。總體OS數據未達到。Dato-DXd組與ICC組後續治療人數分別為192例(53%)對247例(67%),包括15例(4%)及52例(14%)使用後續ADC治療,165例(45%)及186例(51%)使用後續化療。Dato-DXd組首次後續治療時間中位數為8.2個月,ICC組為5.0個月[HR 0.53(95%CI 0.45–0.64)]。整體而言,Dato-DXd組≥3級TRAEs發生率遠低於ICC組。二次患者報告結果顯示,Dato-DXd組體能狀態、疼痛和全球健康狀況/生活品質惡化時間均遲於ICC組。
TROPION-Breast01研究達到PFS主要終點,Dato-DXd組PFS顯著優於ICC組,在所有亞組中都具有統計學和臨床意義。總而言之,Dato-DXd組安全性和生活品質均優於ICC組。這些數據支持Dato-DXd作為已經接受1-2線化療後的不能手術或轉移HR+/HER2‒ BC患者的一種潛在治療選擇。
責任編輯:Sheep
*醫學界力求其發表內容專業、可靠,但不對內容的準確性做出承諾;請相關各方在采用或以此作為決策依據時另行核查。











