近年來,生物制品在市場中所占比重越來越大,與之俱來的生物安全性問題也隨之而來。中國參照WHO、FDA和歐盟的標準,在藥典中明確規定酵母、大腸桿菌表達的生物制品中的DNA殘留量不超過10ng/劑,CHO和vero細胞表達的EPO、狂犬疫苗、B肝疫苗等不超過100或10pg/劑。
生物制品的核酸殘留去除主要集中在病毒疫苗生產、重組織蛋白藥物純化、細胞治療和疫苗研究中緩解PBMC細胞結團以及慢病毒的大規模純化等。翌聖生物UCF.METM核酸酶可降解無論是單鏈、雙鏈、線性、圓形還是超螺旋形式的DNA及RNA,無堿基偏好性。UCF.METM核酸酶具有極高的核酸酶活性以及超強的耐受性,可適用於多種操作環境,短時間內就使樣品中所有的遊離核酸降解成長度為3-5個堿基的5’末端的寡核苷酸。
逐典生物提供高品質全能核酸酶,為生物制品解決宿主核酸殘留困擾。
一,病毒疫苗生產
疫苗的使用者是健康人,並且許多疫苗已用於嬰幼兒。因此,藥品監管機構應更加註意生物產品的安全性,尤其是殘留DNA和RNA的品質控制。現階段病毒疫苗純化主要是采用凝膠滲透色譜法。但是,疫苗中殘留的Vero細胞DNA經常超過規定的最低限度。Li Si-Ming等在2014年發表的文獻中指出,全能核酸酶能夠有效去除疫苗中殘留的宿主細胞DNA。經過核酸酶的病毒疫苗,再用離子交換層析的方法進行純化,可以將疫苗中的核酸殘留量降到限值以下,並且顯著提高了生產回收率。Komatsu Y等的研究表明,全能核酸酶處理對病毒的感染效率無顯著影響。

圖1. 點片法檢測經核酸酶處理的疫苗半成品中的核酸殘留

圖2. 經過核酸酶處理的樣品,殘留量降至100pg/mL以下

圖3. 核酸酶的處理對病毒感染效率無顯著影響
二,重組織蛋白藥物殘留核酸去除
在傳統的放化療治療的局限下,重組織蛋白藥物逐漸成為腫瘤治療領域的研究熱點。為了臨床治療的需要,重組織蛋白產品的使用劑量已從微克增加到毫克或甚至是克,並且大多數生物制品需要長期重復給藥。目前的重組織蛋白藥物主要來源於CHO細胞,細胞經過常規的14天反應器fed-batch培養,密度最高可以達到3×107個/mL。因此,重組織蛋白藥物中的核酸殘留去除極為重要。
三,防止細胞結團
從全血中分離出的外周血單核球(PBMC),在細胞治療和疫苗研究中有重要套用,但是,冷凍PBMC(特別是從儲存的血液中提取的PBMC)解凍時容易成團,阻礙進一步分析。2015年,Lin D等人制定的protocol中明確說明,在PBMC解凍緩沖液中加入全能核酸酶,可以有效防止細胞成團,從而實作PBMC的冷凍保存,該方法被廣泛用於疫苗評估和CAR-T細胞療法研究中PBMC細胞的復蘇。
四,慢病毒的大規模純化
慢病毒介導的基因治療和細胞治療將會很快成為不僅是罕見遺傳病,也會是血液腫瘤、HIV等感染性疾病的常規治療方法。可擴大的慢病毒生產工藝的改進變得越來越迫切。除了載體的滴度及產量,對於慢病毒批次更關心的指標主要是各種汙染物的去除。如下圖,在工業化生產領域,慢病毒大規模純化的常用步驟包括:用膜過濾澄清,隨後用切向流過濾/超濾或者體積排阻色譜來濃縮。所有機構的病毒純化流程中都采用了全能核酸酶來降低細胞殘留的以及質體來源的DNA汙染。
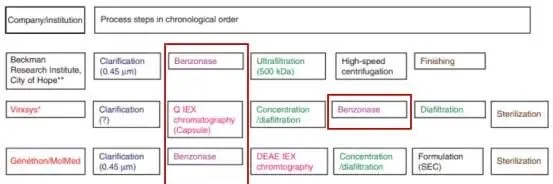
圖4. 不同公司/研究所采用的慢病毒大規模純化步驟中均含有全能核酸酶處理步驟
表1. 3種不同級別UCF.METM核酸酶質檢結果
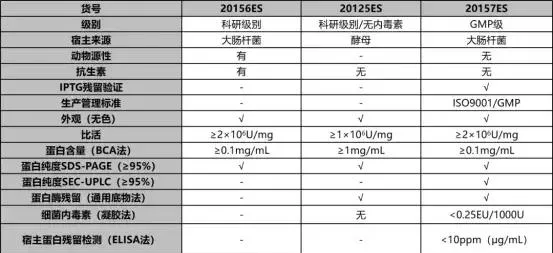
註:檢測並合格(√);無檢測該指標(-);
五,逐典Pannarase全能核酸酶優勢:
1.無動物源性、無安比西林
2.傑出單位比酶活、更高效的核酸降解能力
3.先進的生產工藝,非傳統His標簽純化、排除引入金屬離子風險
4.嚴格的質控標準,內毒水平低,確保單位酶活的準確性以及批次間穩定性
1,全能核酸酶套用條件:
全能核酸酶的酶活會受到多種因素的影響(例如溫度、pH、離子強度等),故用量範圍也會從0.1 U/mL-250 U/mL不等。因此,不同的操作環境下酶的最佳濃度不同,需要透過實驗設定梯度進行最佳條件的摸索。
2,套用例項:
1.樣品:狂犬病毒濃縮液
處理條件:核酸酶濃度50~90U/ml ,
37 ℃處理 2 h,轉入18 ~ 26 ℃處理 6h
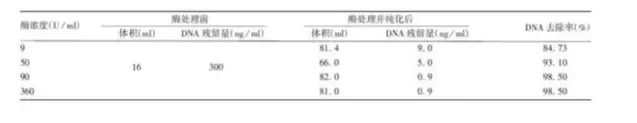
2.樣品:狂犬病病毒濃縮液
處理條件:25、50和100 U/ml,37℃

3.樣品:流感病毒濃縮液
處理條件:10 U/mL,37℃












