作者:刘晨璐,陆艺文,刘志瀚,欧欣瑜,苏士成
文章来源:中华外科杂志, 2024,62(2)
摘要
微创技术是近年外科治疗的重大进展。在乳腺癌治疗领域,微创手术仅需在腋窝等隐蔽位置做一个小切口,避免了乳房表面瘢痕,改善了术后美观度和患者满意度。随着乳腺癌微创手术的发展,多家医疗中心创立了各具特色的乳腺癌微创手术技术。层面外科膜解剖理论使腔镜乳房重建术后外观更为自然,逆序建腔法极大地优化了腔镜乳房切除手术流程,腔镜下术中导航保留乳房手术能够精确定位切缘,冷刀法皮瓣分离技术能够减少手术时间及避免皮瓣损伤。乳腺微创手术领域特色技术不断涌现,将推动我国乳腺癌微创手术进一步推广。
手术作为乳腺癌核心治疗手段,其理念逐渐由追求「最大耐受性」转变为强调「最低有效性」,即着重于减少创伤、保留正常组织功能和提高生活质量。微创手术采用较小的切口入路,患者创伤小、疼痛轻、康复快,同时提供了更清晰的手术视野,有利于保护重要结构,成为乳腺外科的重要研究方向。乳腺微创手术的安全性及有效性正逐渐得到认可,在此背景下,各中心创立了各具特色的乳腺微创手术技术。我们结合当前发展现状,与各位外科同道共同探讨乳腺癌微创手术领域最新进展和特色技术,以期为我国乳腺癌微创手术技术进步和推广提供思路。
一、微创技术在乳腺癌手术中的应用及疗效
微创技术在乳腺外科领域最初用于乳房整形手术[1]。在乳腺外科医师的不懈尝试和持续探索下,这一技术逐渐扩展至各类乳腺良恶性疾病,现已基本覆盖乳腺外科领域各手术类型。腔镜技术和机器人技术作为乳腺微创手术的两个主要分支,其独特的灵活性和视觉优势对医师的术中操作和患者的术后康复均有积极作用。已有多项回顾性研究结果表明,与传统的开放手术相比,乳腺腔镜手术能够明显改善术后乳房或其他手术部位的美观度,减少术后并发症风险,从而提高患者的社会心理评分[2, 3];近年来,机器人辅助手术在乳腺癌领域的应用也逐渐深入,其可行性和短期安全性正逐步获得认可[4, 5]。无论是腔镜技术还是机器人技术,它们在乳腺外科的应用目标都是实现最小切口下的精准切除。
1.腔镜技术:腔镜技术不仅可以用于乳房全切除术[6],也可以用于局部切除乳腺肿瘤[7],同时最大程度地保留正常的乳腺组织,改善术后的美观度和患者满意度[8]。除乳房切除术外,腔镜技术还被用于腋窝淋巴结清扫,有研究结果显示,其与传统开放手术在术后腋窝复发率方面无明显差异[9]。近年腔镜技术在自体组织乳房重建方面的应用也逐渐深入,包括腹直肌皮瓣重建[10, 11]、背阔肌皮瓣重建[12]、大网膜重建[13, 14]等。近期一项回顾性研究结果表明,微创手术和传统开放手术长期生存率的差异无统计学意义,初步证实了乳腺微创技术的安全性[15]。
2.机器人技术:机器人手术系统的出现进一步深化了乳腺外科的微创化程度,引起了广泛的关注和研究。目前机器人手术系统在乳腺外科中可应用于保留乳头乳晕的乳房全切除术(nipple-sparing mastectomy,NSM)联合假体重建、带蒂背阔肌肌皮瓣乳房重建、带蒂大网膜乳房重建、游离腹壁下动脉穿支皮瓣乳房重建、淋巴静脉吻合等领域[16, 17, 18]。已有初步研究结果显示,机器人辅助乳腺手术学习曲线短、并发症少,短期肿瘤学结局可靠[19, 20],其安全性和有效性得到初步验证。
3.存在的问题:乳腺外科微创手术在实际操作中仍面临一些问题。如与开放手术相比,乳腺微创手术空间有限,手术时间可能延长;腔镜保留乳房手术中切除区域位置难以确定等。为应对上述挑战,国内外多家医疗中心积极探索并提出了一系列特色技术,旨在提高乳腺微创手术的效率并拓宽其应用范围。
二、乳腺微创手术特色技术及思考
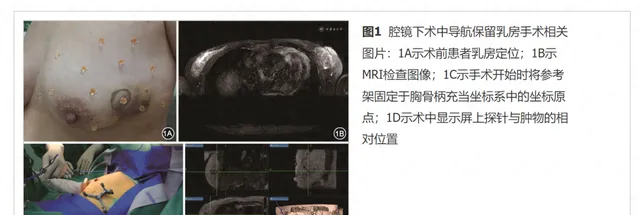
1.腔镜下术中导航保留乳房手术:传统的腔镜保留乳房手术常使用亚甲蓝环周注射标记肿块边缘。然而,亚甲蓝扩散后容易影响手术视野,导致切除不完全或切除正常组织过多。因此,需要寻找更好的方法精确定位肿块边缘。我们将术中导航技术与腔镜保留乳房手术结合,发展出腔镜下术中导航保留乳房手术,利用术前MRI联合手术导航设备建立三维图像(图1A、1B),提供准确的肿瘤位置信息。手术开始时,点对点标记患者实时乳房状态并与术前MRI图像融合(图1C、1D)。医师在术中利用探针精确勾勒肿瘤边缘,确保彻底切除病变组织并最大程度保护周围正常组织。2022年,我们完成了腔镜下术中导航保留乳房手术[21],该技术适用于可接受保留乳房手术的早期乳腺癌患者。术中导航系统解决了现有技术在腔镜保留乳房手术定位方面的不足,为临床医师选择该手术增加了保障。未来,我们期望进一步推动这一技术的发展,以满足更多患者的需求,并探索该技术在其他乳腺外科手术中的应用。
2.冷刀法皮瓣分离的腔镜乳房全切除术:【乳腺疾病腔镜手术专家共识及操作指南(2021版)】推荐采用电刀、电剪和超声刀等能量器械(简称「热刀」)来分离乳腺皮肤和腺体[22]。实际操作中,热刀法存在一些不可忽视的缺点,可能导致手术时间延长,损伤乳房皮肤血管,引发穿孔、乳房皮肤及乳头乳晕缺血等并发症。针对以上问题,笔者团队积极探索腔镜乳房切除术中冷刀法皮瓣分离。2019年国际腔镜与机器人乳腺手术研讨会就机器人乳房切除术达成共识,推荐皮瓣分离采用膨胀液+钝性分离[23]。我们首先在腺体与皮肤间注射膨胀液(图2A),随后使用24 cm组织剪在数分钟内迅速分离乳房表面皮肤(图2B)。这一方法适用于腔镜/机器人辅助乳房切除术,避免了热损伤,同时具有分离速度快、保护皮肤及皮下血管的优势。该方法尽管获得专家推荐,但仍缺乏充分的临床研究数据。文献报道,开放NSM中使用膨胀液联合冷刀器械分离皮肤,可降低乳房皮瓣坏死风险,并缩短手术时间[24]。但在微创NSM领域,该方法的有效性仍待验证。我院正在开展冷刀与电刀分离浅筋膜浅层腔镜下NSM+一期假体植入手术的对照研究,以期为证实新技术的有效性提供高质量的临床证据。
3.膜解剖理论指导下的乳房全切除术:腔镜乳房切除术中,如不能明确乳腺切除范围,往往会影响术后乳房外形。有学者利用层面外科膜解剖理论,根据吸脂后乳房周围解剖结构定位确定合理的切除范围[25]。手术通常选择腋窝入路,在乳房后间隙注入溶脂液,清除乳房周围的脂肪组织后,在腔镜的放大作用下,可显露乳房内部的关键解剖结构,如胸骨旁韧带、锁骨下韧带、外侧融合韧带及三角集束韧带等。该技术适用于腔镜下乳房切除术及一期重建手术,结合膜解剖理论,医师能在术中清晰辨认上述重要的筋膜和韧带,根据患者的病情和自身条件,选择性地保留或将其作为定位标志指导手术操作,从而在术后更好地还原乳房的自然外形。随着层面外科理念的不断深入,对乳腺膜结构的认识也将不断演进。更精确地塑造术后乳房外形,对患者具有重要的心理和生理意义,有助于减轻术后不安感,提高生活质量。
4.逆序建腔法:传统腔镜乳房重建术需依次游离皮下脂肪层、乳房后间隙、胸大肌后间隙。游离过程中,乳腺组织因重力而下垂并遮挡手术视野,会增加后一间隙的游离难度。四川大学华西医院团队提出了逆序建腔法,按胸大肌后间隙、乳房后间隙、皮下脂肪层的顺序游离,下方层次分离后,利用CO2充气法建立腔隙支撑上方乳腺组织,构建稳定、清晰的操作空间[26]。此外,为克服跨越乳峰分离内下象限皮下脂肪层时存在的困难,该团队通过乳晕上外侧缘与皮肤交界处的5 mm辅助孔(华西1号孔)插入电刀,增加了手术操作空间和灵活性,在缩短手术时间的同时,避免了特殊器械的使用,降低了手术花费[27]。该技术适用于胸肌前、胸肌后乳房重建术,这一思路还可用于背阔肌肌皮瓣等的获取。目前,逆序建腔法不仅成为乳腺腔镜手术的常规步骤,也在一定程度上影响了开放手术的操作流程。期待随着该技术的广泛应用和经验积累,逐渐形成相关临床共识,为临床医师选用该技术提供更多指导。
5.吲哚菁绿前哨淋巴结活检(sentinel lymph node biopsy,SLNB)示踪技术:亚甲蓝是国内使用最普遍的淋巴结示踪剂。其易向次级淋巴结引流,可能产生假阴性结果,且可能引发过敏反应[28];因此,学界开始关注其他替代品。吲哚菁绿作为一种广泛应用于医学领域的荧光染料,能够提供实时淋巴回流通路显像,成为前哨淋巴结准确获取的研究方向。腔镜SLNB中应用吲哚菁绿示踪淋巴结,腔镜镜头可于皮下组织直接观察发出荧光的前哨淋巴结,解决了开放手术中因皮肤和皮下组织遮挡无法直接观察前哨淋巴结的问题,前哨淋巴结检出率和获取数目与开放手术相当[29]。该技术适用于临床腋窝阴性的浸润性乳腺癌患者。医师在选择前哨淋巴结示踪技术时,应综合考虑患者的病情、临床需求和可行性。研究人员也在不断寻找更安全、更有效的示踪方式;赵军等[30]报告将三维CT淋巴造影用于腔镜SLNB,以提高准确性并减少创伤。这些技术创新有望改进淋巴结示踪技术,并为乳腺癌患者提供更好的治疗选择。
6.机器人辅助下微创乳腺癌手术:机器人手术系统具有高清、多关节机械臂等独特优势,还可减少术者的体力消耗,避免长时间手术可能导致的疲劳和手腕颤抖等问题[31]。乳腺外科医师已尝试将机器人手术系统用于经脐旁NSM[32]、完全腹膜外入路获取腹壁下动脉穿支皮瓣[33]等。未来,机器人技术在乳腺外科领域的应用有可能改变传统的手术入路和层面,更好地满足患者对手术效果的需求。
三、总结与展望
经过数十年的发展,微创技术在乳腺外科领域已积累了大量病例资料,形成了丰富的共识与指南,推动了乳腺微创技术的日益成熟和规范化,其在术后美观度及患者满意度中的优势也逐渐得到认可。尽管如此,乳腺微创手术的普及仍面临挑战。首先,长期肿瘤安全性仍缺乏高级别证据。目前,我国乳腺外科同道正积极开展大规模前瞻性临床试验,包括我院作为分中心之一的CSBrS-018研究等,为乳腺微创技术的应用提供高质量证据。其次,部分手术流程仍然存在不足,其解决方案主要依赖于各个医疗机构的经验,迫切需要更多的临床试验,将实践经验转化为证据,解决腔镜技术在应用中遇到的问题。我院正进行多项前瞻性试验,包括比较冷刀法与热刀法在全乳皮下切除中的效果、术中导航在保留乳房手术中的应用等。随着病例数量的增加和分析手段的进步,有望探索出一些量化指标,为临床提供更准确的建议。最后,在基层医疗机构的推广面临设备和技术的限制。应推动基层医疗机构医护人员的培训,不断更新手术器械,以降低使用门槛。同时,还应探索适用于乳腺腔镜手术的有效评价体系,持续推动技术创新,进一步提升手术效果和安全性。
参考文献
[1]
KompatscherP. Endoscopic capsulotomy of capsular contracture after breast augmentation: a very challenging therapeutic approach[J]. Plast Reconstr Surg, 1992, 90(6):1125-1126. DOI: 10.1097/00006534-199212000-00049.
[2]
WangZH, GaoGX, LiuWH, et al. Single-port nipple-sparing subcutaneous mastectomy with immediate prosthetic breast reconstruction for breast cancer[J]. Surg Endosc, 2023, 37(5):3842-3851. DOI: 10.1007/s00464-023-09862-6.
[3]
XieF, WangZH, WuSS, et al. Comparing outcomes of single-port insufflation endoscopic breast-conserving surgery and conventional open approach for breast cancer[J]. World J Surg Oncol, 2022, 20(1):335. DOI: 10.1186/s12957-022-02798-6.
[4]
LaiHW, ChenDR, LiuLC, et al. Robotic versus conventional or endoscopic assisted nipple sparing mastectomy and immediate prothesis breast reconstruction in the management of breast cancer - a prospectively designed multicenter trial comparing clinical outcomes,medical cost,and patient-reported- outcomes (RCENSM-P)[J/OL].Ann Surg, 2023[2023-08-20]. https://journals.lww.com/annalsofsurgery/abstract/9900/robotic_versus_conventional_or_endoscopic_assisted.477.aspx. DOI: 10.1097/SLA.0000000000005924. [published online ahead of print May 25, 2023].
[5]
HuangJJ, ChuangEY, CheongDC, et al. Robotic-assisted nipple-sparing mastectomy followed by immediate microsurgical free flap reconstruction: feasibility and aesthetic results-case series[J]. Int J Surg, 2021, 95:106143. DOI: 10.1016/j.ijsu.2021.106143.
[6]
KitamuraK, IshidaM, InoueH, et al. Early results of an endoscope-assisted subcutaneous mastectomy and reconstruction for breast cancer[J]. Surgery, 2002, 131(1Suppl):S324-S329. DOI: 10.1067/msy.2002.120120.
[7]
TakemotoN, KoyanagiA, YamamotoH. Ten-year follow up of cosmetic outcome, overall survival, and disease-free survival in endoscope-assisted partial mastectomy with filling of dead space using absorbable mesh for stage≤ ⅡA breast cancer: comparison with conventional conservative method[J]. BMC Womens Health, 2021, 21(1):253. DOI: 10.1186/s12905-021-01399-x.
[8]
WangZH, QuX, TengCS, et al. Preliminary results for treatment of early stage breast cancer with endoscopic subcutaneous mastectomy combined with endoscopic sentinel lymph node biopsy in China[J]. J Surg Oncol, 2016, 113(6):616-620. DOI: 10.1002/jso.24199.
[9]
LangerI, KocherT, GullerU, et al. Long-term outcomes of breast cancer patients after endoscopic axillary lymph node disp: a prospective analysis of 52 patients[J]. Breast Cancer Res Treat, 2005, 90(1):85-91. DOI: 10.1007/s10549-004-3268-6.
[10]
LaiHW, WuHS, ChuangKL, et al. Endoscopy-assisted total mastectomy followed by immediate pedicled transverse rectus abdominis musculocutaneous (TRAM) flap reconstruction: preliminary results of 48 patients[J]. Surg Innov, 2015, 22(4):382-389. DOI: 10.1177/1553350614546003.
[11]
ShakirS, SpencerAB, KozakGM, et al. Laparoscopically assisted DIEP flap harvest minimizes fascial incision in autologous breast reconstruction[J]. Plast Reconstr Surg, 2020, 146(3):265e-275e. DOI: 10.1097/PRS.0000000000007048.
[12]
ChaW, JeongWJ, AhnSH. Latissimus dorsi muscle free flap revisited: a novel endoscope-assisted approach[J]. Laryngoscope, 2013, 123(3):613-617. DOI: 10.1002/lary.23757.
[13]
JimenezAG, St GermainP, SiroisM, et al. Free omental flap for skin-sparing breast reconstruction harvested laparoscopically[J]. Plast Reconstr Surg, 2002, 110(2):545-551. DOI: 10.1097/00006534-200208000-00028.
[14]
ZahaH, OnomuraM, NomuraH, et al. Free omental flap for partial breast reconstruction after breast-conserving surgery[J]. Plast Reconstr Surg, 2012, 129(3):583-587. DOI: 10.1097/PRS.0b013e3182402cc6.
[15]
WanA, LiangY, ChenL, et al. Association of long-term oncologic prognosis with minimal access breast surgery vs conventional breast surgery[J]. JAMA Surg, 2022, 157(12):e224711. DOI: 10.1001/jamasurg.2022.4711.
[16]
ToescaA, SangalliC, MaisonneuveP, et al. A randomized trial of robotic mastectomy versus open surgery in women with breast cancer or BrCA mutation[J]. Ann Surg, 2022,276(1):11-19.DOI: 10.1097/SLA.0000000000004969.
[17]
AhnJH, ParkJM, ChoiSB, et al. Early experience of robotic axillary lymph node disp in patients with node-positive breast cancer[J]. Breast Cancer Res Treat, 2023,198(3):405-412. DOI: 10.1007/s10549-022-06760-8.
[18]
van MulkenT, ScholsRM, ScharmgaA, et al. First-in-human robotic supermicrosurgery using a dedicated microsurgical robot for treating breast cancer-related lymphedema: a randomized pilot trial[J]. Nat Commun, 2020, 11(1):757. DOI: 10.1038/s41467-019-14188-w.
[19]
ToescaA, PeradzeN, ManconiA, et al. Robotic nipple-sparing mastectomy for the treatment of breast cancer: feasibility and safety study[J]. Breast, 2017, 31:51-56. DOI: 10.1016/j.breast.2016.10.009.
[20]
LaiHW, LinSL, ChenST, et al. Robotic nipple-sparing mastectomy and immediate breast reconstruction with gel implant[J]. Plast Reconstr Surg Glob Open, 2018, 6(6):e1828. DOI: 10.1097/GOX.0000000000001828.
[21]
欧欣瑜, 陆艺文, 刘志瀚, 等. 术中导航系统在腔镜乳腺癌保乳根治术中的应用:病例报告[J]. 岭南现代临床外科, 2022, 22(1): 1-5. DOI: 10.3969/j.issn.1009-976X.2022.01.001.
[22]
中国医师协会微无创分会乳腺专家委员会. 乳腺疾病腔镜手术专家共识及操作指南(2021版)[J]. 中国微创外科杂志, 2021, 21(12): 1057-1067. DOI: 10.3969/j.issn.1009-6604.2021.12.001.
[23]
LaiHW, ToescaA, SarfatiB, et al. Consensus statement on robotic mastectomy-expert panel from International Endoscopic and Robotic Breast Surgery Symposium (IERBS) 2019[J]. Ann Surg, 2020, 271(6):1005-1012. DOI: 10.1097/SLA.0000000000003789.
[24]
NgT, KnowlesS, BrackstoneM, et al. Mastectomy flap necrosis after nipple-sparing mastectomy and immediate implant-based reconstruction: an evaluation of tumescence and sharp disp technique on surgical outcomes[J]. Breast J, 2019, 25(6):1079-1083. DOI: 10.1111/tbj.13442.
[25]
王子函, 白宾, 丁国乾, 等. 腔镜下显露环乳韧带以及膜解剖在乳房重建术中的作用[J].国际外科学杂志, 2022, 49(10):694-698,C5.DOI: 10.3760/cma.j.cn115396-20220530-00184.
[26]
周娇, 梁法清, 谢妍妍, 等. 华西医院日间腔镜乳腺皮下切除联合一期假体重建的临床路径简介[J].中国胸心血管外科临床杂志, 2021, 28(12):1393-1399. DOI: 10.7507/1007-4848.202107040.
[27]
ZhangS, XieY, LiangF, et al. Video-assisted transaxillary nipple-sparing mastectomy and immediate implant-based breast reconstruction: a novel and promising method[J]. Aesthetic Plast Surg, 2022, 46(1):91-98. DOI: 10.1007/s00266-021-02527-6.
[28]
中国抗癌协会. 乳腺癌前哨淋巴结活检规范化操作指南(2022精要版)[J].中国肿瘤临床, 2022, 49(22):1135-1142. DOI: 10.12354/j.issn.1000-8179.2022.20221052.
[29]
WangZH, GangTR, WuSS, et al. Single-port endoscopic-sentinel lymph node biopsy combined with indocyanine green and carbon nanoparticles in breast cancer[J]. Surg Endosc, 2023, 37(10):7591-7599. DOI: 10.1007/s00464-023-10018-9.
[30]
赵军, 田晓庆, 何华楠. 3D淋巴造影下腔镜乳腺手术与前哨淋巴结活检的疗效分析[J].腹腔镜外科杂志, 2022, 27(9):677-682, 688. DOI: 10.13499/j.cnki.fqjwkzz.2022.09.677.
[31]
DalsgaardT, JensenMD, HartwellD, et al. Robotic surgery is less physically demanding than laparoscopic surgery: paired cross pal study[J]. Ann Surg, 2020, 271(1):106-113. DOI: 10.1097/SLA.0000000000002845.
[32]
SarfatiB, ToescaA, RoulotA, et al. Transumbilical single-port robotically assisted nipple-sparing mastectomy: a cadaveric study[J]. Plast Reconstr Surg Glob Open, 2020, 8(5):e2778. DOI: 10.1097/GOX.0000000000002778.
[33]
ChoiJH, SongSY, ParkHS, et al. Robotic DIEP flap harvest through a totally extraperitoneal approach using a single-port surgical robotic system[J]. Plast Reconstr Surg, 2021, 148(2):304-307. DOI: 10.1097/PRS.0000000000008181.
相关阅读

早期乳腺癌治疗10个热点问题的冷思考
作者:李健斌, 江泽飞
文章来源:中华外科杂志, 2022, 60(3)
▲ 点击阅读
新辅助策略开启了早期乳腺癌准个体化治疗的新时代
作者:姜海洋, 郑新宇
文章来源:国际外科学杂志, 2022,49(3)
▲ 点击阅读
三阴性乳腺癌新辅助治疗的机遇与挑战
作者:郝晓鹏, 江泽飞
文章来源:中华外科杂志, 2021, 59(2)
▲ 点击阅读
平台合作联系方式
电话: 010-51322382
欢迎关注普外空间微信矩阵
普外空间订阅号
普外空间CLUB服务号
普外空间视频号
普外空间小助手











