胃肠道系统在特发性草酸钙肾结石的病理生理学中至关重要。肠道黏膜吸收影响钙和草酸盐代谢,是高钙尿症和高草酸尿症的主要驱动因素,也是结石形成者的重要尿代谢异常。肠道和肾脏间的串扰助长了结石的病理生理学。尽管肠道微生物群(如Oxalobacter formigenes)的草酸盐降解能力被认为是结石风险的因素,但研究结果存在矛盾,使微生物群在结石发生中的作用尚不确定。
过去十年,组学技术极大提升了肠道微生物群落的研究水平。肾结石的肠肾轴概念已基于微生物群革命进行梳理。研究表明,钙肾结石患者的粪便微生物群与无结石者不同,支持微生物群在肾结石病理生理学中的关键作用。但多数研究未将微生物群与肾结石的临床方面整合,尤其是营养。营养失衡是肾结石的主要危险因素,而良好的饮食习惯是非药物预防的支柱。尽管饮食习惯影响肠道微生物群,但如何整合到以肠肾轴为中心的微生物组研究中仍不确定。本综述旨在从营养学角度总结肠道菌群与草酸钙肾结石病的关系。
2.1. 在微生物群革命之前:关注草杆菌1980年首次从哺乳动物瘤胃中分离出甲氧杆菌,其独特的草酸盐降解能力使其成为已知最有效的草酸盐降解生物系统。该能力得益于草酰辅酶A脱羧酶和甲酰辅酶A转移酶的表达,能够产生甲酸酯和CO2以释放能量。随后几年,从包括人类在内的多种哺乳动物肠道中分离出该菌。研究表明,肠道内氧化杆菌的存在与草酸盐吸收成反比关系。直到1990年代后期,基于PCR的草杆菌鉴定和定量方法的发展,才进一步探索其在人肾结石病中的作用。研究发现,在30%-70%的人类粪便样本中存在草酸杆菌,其数量与膳食草酸盐摄入量和草酸盐吸收率显著相关。草酸杆菌通过降解肠道内草酸盐、减少黏膜吸收和促进内源性草酸盐分泌来预防钙肾结石。观察性研究表明,结石患者或高风险人群的草酸杆菌定植率显著降低。然而,关于定植状态与草酸尿症之间的关系仍存在争议,可能受饮食草酸盐摄入量的影响。最近研究发现,美国健康年轻人的草酸杆菌患病率低于其他人群,可能与饮食和生活方式有关。尽管小样本干预研究发现草酸杆菌或草酸盐降解益生菌混合物对降低成石风险的效果矛盾,但仍需进一步研究确定其临床意义。
2.2. 超越微生物群革命:作为网络一部分的氧化杆菌迄今,7项研究利用下一代测序技术探讨了钙结石患者的粪便微生物群特征[44-50],详情总结于表3。此外,两项研究对比了尿液与结石的微生物群组成[50,51]。
这些研究证实肠道菌群失调概念,即生理成分变化导致生物多样性降低[44-50]。Suryavanshi等人发现,复发性高草酸尿症结石患者相较于对照组,病原体和能降解草酸盐的物种(如Oxalobacter)代表性增加[44]。这些菌群在细菌网络中共同存在,表明结石患者与对照组的微生物群结构存在差异。值得注意的是,普雷沃氏菌属、迪亚利斯特菌属和粪杆菌属在结石患者中减少,而拟杆菌属比例过高[44]。
后来,两项小型研究[45,46]及一项更大规模的病例对照研究均证实了肾结石与肠道菌群失调相关[47]。研究发现,结石形成者与对照组的肠道微生物群差异与身体成分、饮食、水合作用等因素无关,且部分共生关键分类群的代表性降低,如短链脂肪酸生产者Faecalibacterium prausnitzii[47]。另外,对照组的微生物群草酸盐降解能力更高,部分细菌分类群的平均丰度与尿草酸盐排泄负相关[47],与Suryavanshi的研究结果一致[44]。
深入研究发现,在健康对照中,Oxalobacter的存在与具有草酸盐降解能力的复杂细菌网络相关,这些网络在钙结石形成者中较为少见。重要的是,不含有Oxalobacter的结石形成者中这些网络也较少。因此,肠道微生物群的草酸盐降解能力依赖于复杂的生态系统,而不仅仅是依赖于Oxalobacter。这一概念已在移植了由Oxalobacter定植的人类粪便的小鼠中得到证实。
最近,Zampini等发现结石患者的尿液样本呈现独特的微生物群,该群与肠道微生物群关联微弱,非尿路感染导致,且由低致病潜力菌群构成。与对照组比,结石患者尿液微生物群差异显著,特别是乳酸菌减少。约20%结石患者的结石菌群可被下一代测序技术识别,主要由葡萄球菌、肠杆菌、大肠杆菌和乳酸菌组成,与尿液微生物群不同,但这些潜在致病菌与明显感染无关。
3.1. 肾结石相关肠道菌群失调的决定因素据推测,抗生素治疗的增加可能与肾结石相关的肠道和泌尿微生物群失调有关。大型流行病学研究表明,终生接触抗生素,尤其是年轻时的长期治疗,增加了肾结石的风险。在特定研究中,某些抗生素与肾结石风险增加相关。然而,抗生素暴露只是影响肠道微生物群组成的众多环境因素之一,饮食因素尤其复杂。尽管有限的研究比较了结石形成者和对照组的肠道微生物群,但结果表明饮食习惯的差异可能是肠道微生物群差异的原因之一。营养可能是影响肾结石疾病中「肠-肾轴」的主要力量,尽管尚缺乏直接研究。有证据表明,与肾结石相关的饮食改变可能影响微生物群组成。
3.2. 盐和微生物群
高盐摄入是钙结石形成的主要营养失衡之一,可增加尿钙排泄并减少结石抑制剂。限制盐摄入与减少尿钙排泄和预防结石复发相关。盐具有抗菌特性,但其对肠道微生物群的影响最近才被研究。高盐摄入与尿液中某些肠道微生物来源的代谢物水平降低有关。动物研究显示,高盐饮食导致肠道菌群失调,增加肠道通透性,并诱发高血压和肾损伤。这种影响与乳酸菌减少和辅助性T细胞17的诱导有关。高盐还与心血管疾病标志物TMAO浓度升高和肠道形态改变相关。益生菌或益生元可减轻高盐对小鼠的有害影响。高盐对人类微生物群的影响研究显示乳酸菌减少和其他菌群变化。这些结果支持肠道菌群参与盐敏感性高血压和心血管风险的假设。然而,盐与肾结石患者肠道微生物群的关系尚未研究,但可能受膳食盐摄入影响。
3.3. 动物蛋白和微生物群高蛋白摄入,特别是动物蛋白,被认为是钙肾结石的重要风险因素。它可能增加肾酸负荷,减少结石抑制剂的排泄,导致肾结石发生率上升。补充氨基酸和蛋白质也增加尿钙排泄,而限制蛋白质摄入有助于预防钙石症复发。一项随机对照试验显示,均衡动物蛋白摄入相较于低钙饮食在减少肾绞痛复发方面更有效。蛋白质摄入与肠道微生物群组成之间的关系复杂且矛盾,高蛋白饮食可能引发促炎性变化和致病菌增加,但也可能与某些积极变化有关。蛋白质摄入量与微生物群组成可能呈U形关系,同时其他常量营养素如脂质对微生物群组成的影响可能更显著。高蛋白饮食可能与特定细菌代表性的增加或减少有关,但整体营养模式而非单一营养素摄入对微生物群的组成和代谢功能影响更大。坚持地中海式饮食与肠道微生物群组成的积极影响有关,而DASH型饮食的依从性降低与肾结石风险增加有关。因此,蛋白质摄入量与整体饮食模式共同影响钙结石形成者的肠道微生物群组成。
3.4. 草酸盐摄入量和微生物群
人草酸盐代谢复杂,主要不依赖于膳食草酸盐摄入量,而更受饮食中钙/草酸比值影响。尿草酸盐部分来自羟脯氨酸和抗坏血酸分解代谢,其膳食摄入量也影响尿草酸盐排泄。高草酸尿症是结石形成者常见的代谢异常,通常由肾小管草酸盐分泌过多引起。高膳食草酸盐摄入与肾结石风险轻度相关,但临床意义重大。减少草酸盐摄入仅适用于轻度患者,且可能适得其反增加结石风险。减少草酸盐的间接膳食来源如动物蛋白或抗坏血酸,通常更有效于减少草酸盐尿症和预防结石。
虽然存在诸多临床概念,但膳食草酸盐摄入量对肠道微生物群组成具有显著影响。过去5年,Miller等发现,食草动物Neotoma albigula的肠道微生物群具备高草酸盐降解能力,且微生物生态系统对草酸盐摄入量增加呈现适应性变化。乳酸菌、肠球菌和梭状芽孢杆菌等物种在其中起关键作用。草酸盐摄入量的增加导致特定微生物分类群代表性上升,但某些分类群在人类结石形成者中显著耗尽。摄入高草酸盐食物(如坚果)与肠道菌群组成的特异性变化相关,这些变化通常对健康有益。双歧杆菌和非致病性梭状芽胞杆菌的影响尚不确定。
草酸盐对微生物群修饰的作用尚不确定。坚果中的多酚化合物与微生物群相互作用,影响其组成。草酸盐摄入对肠道微生物群的影响可能因个体微生物群代谢型而异。据报道,肠道微生物群缺乏草酸盐降解能力可能导致摄入高草酸盐食物者发生肾功能衰竭。因此,草酸盐、肠道菌群与成岩风险间的相互作用复杂,需深入研究。
3.5. 钙摄入量和微生物群经常食用富含钙的乳制品或非乳制品可预防钙肾结石,但结石患者应避免使用钙补充剂。限制膳食钙摄入不如限盐和蛋白质有效预防复发,但膳食钙对结石形成的影响还受草酸盐含量和摄入时间影响。结石患者肠道钙吸收分数更高,因此应均衡膳食钙摄入以防高钙尿。目前对膳食钙与肠道微生物群关系了解有限,但研究表明钙补充剂可能与肠道微生物群有益影响有关,钙摄入变化还可能影响肥胖发展。益生元调节微生物群可正向调节小鼠膳食钙吸收,有望成为减轻肾结石患者高钙尿负担的策略。
3.6. FAV摄入量、豆类摄入量和微生物群高FAV摄入量可减少肾结石风险并降低尿液的成石潜力,是降低肾结石复发的非药物处方之一。良好的FAV摄入能增加尿量,排泄成石抑制剂,降低肾酸负荷。豆类摄入可防结石,但其草酸盐含量中高,可能导致成石风险增加。
纤维是植物中特有的不可消化碳水化合物,是FAV与微生物群互动关键。多种微生物可代谢这些化合物,作为合成短链脂肪酸(SCFA)的主要底物。研究显示,高纤维摄入可调节肠道微生物群,增加短链脂肪酸产生菌及健康促进菌的比例,减少致病菌。这种差异在地中海饮食与西式饮食的比较中也有体现。
增加可溶性纤维可增强肠道微生物群多样性及稳定性,提升双歧杆菌比例,降低Oxalobacteraceae水平。与可溶性纤维相比,不溶性纤维对肠道菌群影响较少知。不同纤维类型的摄入可选择性促进不同微生物群落生长。比较欧洲与布基纳法索儿童饮食习惯和微生物群,发现高不溶性纤维摄入与特定分类群的扩张相关,这些分类群含有水解基因,而欧洲儿童则无。因此,食物中不溶性与可溶性纤维比例也影响微生物群。
在肥胖受试者中,增加FAV摄入量与体重增长减少、身体成分改善及尿代谢特征变化相关,这些生理变化由肠道微生物群介导。高FAV摄入与植物类黄酮的微生物代谢有关,产生代谢调节剂化合物,其中马尿酸尿排泄可作为FAV摄入标志物,对肾结石患者具有监测饮食建议依从性的潜在效用。膳食果汁补充可能积极调节肾结石形成,与肠道微生物群生物多样性增加及健康菌群代表性增强有关。果汁摄入提升粪便和尿液中微生物代谢物水平,显示良好代谢活性。
豆科植物摄入有益微生物群组成,增加双歧杆菌和乳酸杆菌比例,降低厚壁菌门/拟杆菌门比例。此观点在人类和动物研究中得到支持,但作用可能与纤维无关,而是由豆类中的异黄酮化合物介导。尽管未专门针对肾结石,现有文献支持增加FAV或果汁摄入可能对肾结石风险有益,部分原因是肠道微生物群组成和代谢功能的变化。
3.7. 饮水量和肠道微生物群水合不良是肾结石病的主要风险因素,日饮水量>2L对预防复发至关重要。水的摄入与肾结石形成机制密切相关,受物理化学因素和肾脏生理学影响。新研究发现,水合作用及饮用水类型还会影响肠道微生物群,进而通过肠肾轴影响结石形成。饮用水的pH值能影响小鼠的微生物群组成,不同pH值促进不同微生物种群生长。小鼠饮用酸化水能引发肠道微生物群深层变化,类似变化在人类微生物群中也有体现。因此,研究微生物组时应考虑饮用水pH值作为协变量。人体研究也支持了这些发现,碱性水饮用与肠道微生物群特定变化相关。但现有研究未充分考虑饮用水的矿物质成分和饮食对微生物群的影响,因此结论需谨慎解释,未来需进一步探究饮用水组成与肠道微生物群的关系。
结论与观点
一些研究支持这样的假设,即肠道微生物群组成能够影响结石作用,而不仅仅是单纯地存在或不存在 Oxalobacter formigenes 。同时,与钙肾结石风险增加相关的所有主要营养失衡都与肠道微生物群组成的特定改变有关(表4).尽管这些变化与肾结石病理生理学的相关性尚不清楚,但由于没有研究从营养学的角度全面评估肠肾轴,它们允许假设微生物群在营养和肾功能之间的十字路口充当代谢调节剂,影响成石风险(图1).
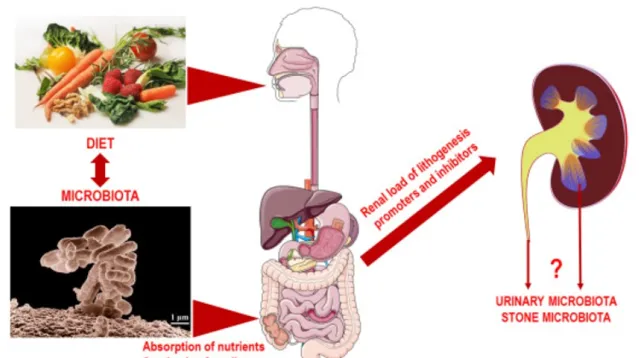
图1表示营养在肾结石中肠肾轴中的可能作用。
表4概述与高成石风险相关的主要营养失衡及其对肠道微生物群组成的影响。| 营养失衡 | 对尿液化学和成岩风险的影响 | 对肠道微生物群组成的影响 |
|---|---|---|
| 高盐摄入量 |
尿钙
增加 尿枸橼酸 盐减少 CaOx 结石风险增加 | 乳酸菌、阿克曼氏菌、双歧杆 菌的消耗 |
| 动物蛋白摄入量高 |
尿钙
升高 尿尿酸 升高 尿pH值 降低 肾酸负荷 增加 CaOx 和 AcUr 结石症的风险增加 |
厚壁菌门、
双歧杆菌门、罗斯布里亚门、普雷沃氏菌
门的耗竭 胆汁耐受细菌 的代表性增加 粪杆菌 的代表性增加 |
| 高草酸盐摄入量 |
尿草酸
盐增加 CaOx 结石风险轻度增加 |
草酸盐降解物种
的扩张 Lachnospira、Roseburia、Dialister、粪杆菌 和 乳酸菌 的代表性增加(可能是由于富含草酸盐的食物中含有的其他营养素) |
| 钙摄入量低 |
尿草酸
盐增加 骨 骼中尿钙增加 CaOx 结石的风险增加 | 生物多样性减少,产生短链脂肪酸的物种枯竭(在小鼠中) |
| 低 FAV 摄入量 |
结石
尿抑制剂减少 尿量减少 |
乳酸菌
的消耗 产生短链脂肪酸 的物种的消耗 双歧杆菌、粪杆菌、乳酸菌 的消耗 |
| 水合作用不足 | 尿量减少 | 一些选定分类群的代表性改变,包括 瘤胃球菌科、普雷沃氏菌 科、双歧杆菌科和草杆菌科,具体取决于摄入液体的pH值 |
CaOx = 草酸钙;AcUr = 尿酸;SCFAs = 短链脂肪酸;FAV = 水果和蔬菜。
未来对肾结石肠肾轴的研究不应再局限于描述粪便微生物群组成和与健康对照的比较,还应嵌入彻底的营养调查和营养物质与微生物群之间相互作用的功能方面。旨在操纵微生物群组成和功能的营养干预是调节成石风险和确定预防肾结石复发的新策略的一个有前途的领域。此外,尿液和结石微生物群的作用(图1)是另一个有争议的点,应该在未来进行调查,以确定它是否积极参与肾结石的形成,并代表了新治疗策略的另一个可能靶点。











