胆道恶性肿瘤(biliary tract cancers,BTC)是来源于胆管及胆囊上皮的一组高度异质性恶性肿瘤,具有早期诊断困难、进展迅速、解剖部位复杂等特点。流行病学数据显示,BTC每年约占全球癌症相关死亡人数的2%。近年来发病率呈持续上升趋势,以亚洲国家最为常见。临床上仅30%~40%的患者在初诊时具有根治性手术的机会,且术后复发率高。虽然BTC整体发病率不高,但其恶性程度高,容易复发转移,且大多数患者在确诊时已经处于晚期,导致治疗效果和预后极差。
BTC诊疗现状
手术切除一直以来都是BTC的根治性治疗方法,尽管手术切除可以达到根治的目的,但研究发现大约50%的患者在根治性手术切除之后因复发而影响长期生存。
2017年的一项回顾性研究发现,复发后再次进行手术治疗的BTC患者3年及5年生存率明显高于复发后接受化疗或最佳支持治疗者(3年生存率分别为38%、5.3%和0,5年生存率分别为19%、5.3%和0,P<0.0001)。
手术是目前BTC唯一可能治愈的方法,但大多数患者在诊断时处于晚期,失去手术机会,而放疗在胆系肿瘤中的作用有限,大多数晚期患者均以内科治疗为主。多项研究显示,化疗为BTC患者带来12个月左右的中位OS,为进一步延长患者生存,寻找新的治疗手段和方法亦成为BTC亟待解决的问题。
免疫治疗推进胆道恶性肿瘤治疗新突破
吉西他滨联合顺铂(GP方案)的化疗方案作为晚期BTC的标准一线治疗已经超过十年。免疫临床研究在BTC领域也大放异彩,为晚期BTC患者带来了新的治疗策略。以下是两项重要的研究结果,为晚期胆道恶性肿瘤患者的一线治疗提供了新的方案及健康相关生活质量分析。
一、TOPAZ-1研究
研究背景:
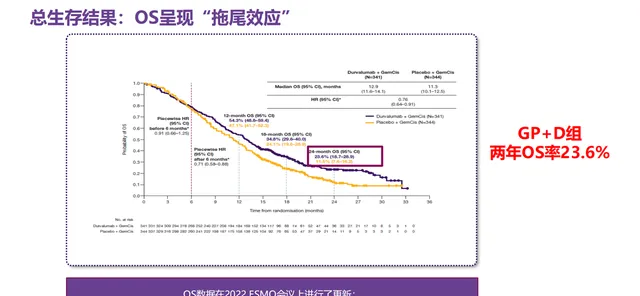
该研究是一项随机、双盲、安慰剂对照、全球多中心Ⅲ期临床试验⁵, 旨在评估度伐利尤单抗联合吉西他滨和顺铂(D+GC)对比安慰剂联合吉西他滨和顺铂(PBO+GC)用于晚期BTC一线治疗的疗效和安全性。主要终点为OS,关键次要终点包括PFS、ORR和安全性。
研究结果:
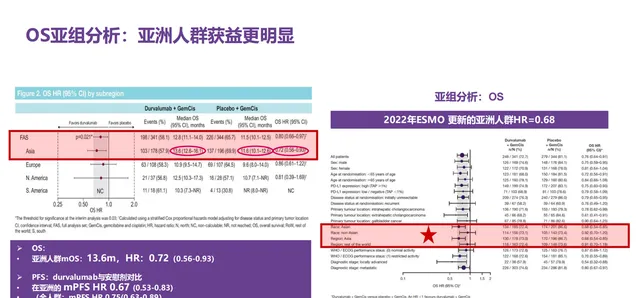
D+GC组与PBO+GC组的中位OS分别为12.9个月和11.3个月(HR=0.76,95% CI:0.64-0.91),2年OS率分别为23.6%和11.5%。安全性分析中,3-4级不良事件发生率和治疗相关不良事件导致任何研究药物中断的发生率方面,D+GC组均低于PBO+GC组,分别为60.9%和63.5%、8.9%和11.4%。此外,本研究的亚组分析结果显示,亚洲人群中度伐利尤单抗联合吉西他滨和顺铂降低死亡风险28%(HR=0.72,95%CI:0.56-0.94)⁶。
2023年11月7日,基于TOPAZ-1研究成果,中国国家药品监督管理局批准度伐利尤单抗联合吉西他滨和顺铂适用于局部晚期或转移性BTC成人患者的一线治疗。
二、KEYNOTE-966研究
研究背景:
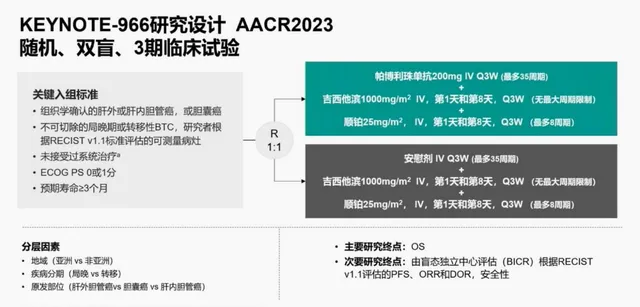
该研究是一项国际多中心、随机、安慰剂对照的一线胆管癌Ⅲ期注册性临床研究⁷, 旨在评估帕博利珠单抗对比安慰剂,联合吉西他滨+顺铂一线治疗晚期BTC的疗效和安全性。主要终点为OS,次要终点包括PFS、ORR、DoR和安全性。
研究结果:
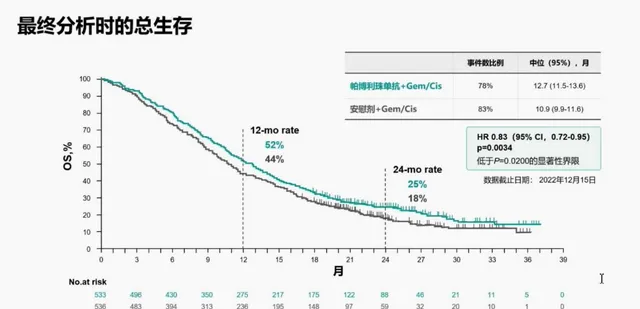
帕博利珠单抗联合化疗和安慰剂联合化疗的中位OS分别为12.7个月(95% CI, 11.5-13.6)和10.9个月(95% CI, 9.9-11.6),死亡风险降低了17%。在试验预先设定的PFS和ORR最终分析中,与安慰剂联合化疗相比,帕博利珠单抗联合化疗可将疾病进展或死亡风险降低14% (HR=0.86 [95% CI, 0.75-1.00])。安全性方面,两组间3-4级不良反应发生率无临床意义差异⁸。
2023年11月1日,美国食品药品监督管理局(FDA)批准帕博利珠单抗联合化疗(吉西他滨和顺铂)一线治疗局部晚期不可切除或转移性BTC,目前还未获中国国家药品监督管理局(NMPA)批准。
2023 CSCO指南更新
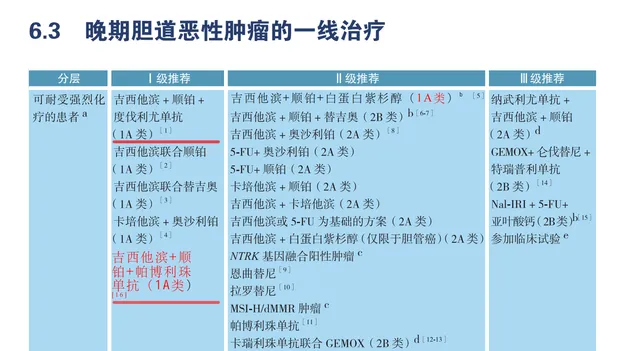
2022 CSCO 度伐利尤单抗+GP方案获得1A类推荐
2023 CSCO 帕博利珠单抗+GP方案获得1A类推荐⁹
结语
随着肿瘤精准诊疗理念的发展,围绕BTC的治疗逐步转向靶向、免疫、化疗的联合治疗方案。TOPAZ-1和KEYNOTE-966研究为晚期BTC患者的治疗提供了新的方案和证据,也希望这些新型治疗策略进入临床实践后帮助BTC患者获得更为长久的生存获益。











