
2 型糖尿病是(Diabetes type)一种复杂的代谢性疾病,其发病机理涉及多个层面,包括遗传因素、环境因素以及细胞和分子水平的变化。
一、遗传因素
2 型糖尿病具有明显的遗传倾向。从分子角度来看,多个基因的变异与 2 型糖尿病的发病密切相关。
1. 胰岛素相关基因
- 胰岛素基因的突变可能影响胰岛素的合成、加工或分泌。例如,某些突变可能导致胰岛素前体的折叠错误,使其无法正确加工为有活性的胰岛素,进而影响血糖的调节。
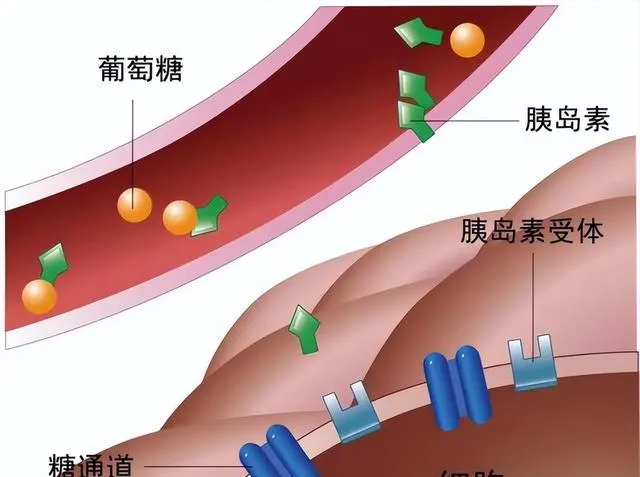
- 胰岛素受体基因的变异也较为重要。胰岛素受体是胰岛素信号传导的关键分子,基因突变可能导致胰岛素受体的结构和功能异常,使其对胰岛素的亲和力降低,影响胰岛素信号的传递,从而引起胰岛素抵抗。
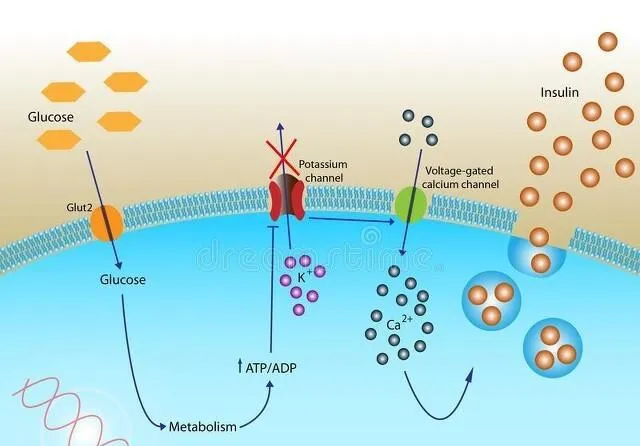
2.细胞代谢相关基因
- 与葡萄糖转运和代谢有关的基因,如葡萄糖转运蛋白 4(GLUT4)基因。GLUT4 负责将葡萄糖转运到细胞内进行代谢,其基因表达或功能异常可导致细胞摄取葡萄糖的能力下降。例如,某些遗传变异可能影响 GLUT4 的转录调控,使其在细胞表面的表达减少,导致细胞对葡萄糖的摄取不足,血糖水平升高。
- 参与糖原合成和分解的基因也可能影响 2 型糖尿病的发生。糖原合成酶基因的突变可能导致糖原合成减少,而糖原磷酸化酶基因的突变可能使糖原分解过度,这些都会影响血糖的平衡。
3.转录因子和信号通路相关基因
- 某些转录因子如过氧化物酶体增殖物激活受体γ(PPARγ)在脂肪细胞分化和胰岛素敏感性调节中起关键作用。PPARγ 基因的变异可能影响其对靶基因的调控,导致脂肪细胞功能异常,进而引发胰岛素抵抗。
- 细胞内的信号通路分子,如磷脂酰肌醇 3 - 激酶(PI3K)和蛋白激酶 B(Akt)等相关基因的突变,也会干扰胰岛素信号传导。PI3K 是胰岛素信号通路中的重要分子,它被激活后可以磷酸化多种底物,调节细胞的代谢、增殖和存活等过程。PI3K 基因的突变可能导致其活性降低,影响下游信号的传递,使细胞无法有效地响应胰岛素的作用,产生胰岛素抵抗。
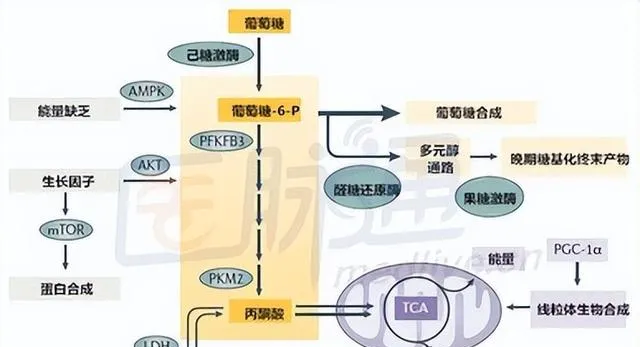
二、环境因素
1.饮食因素
- 长期高热量、高脂肪、高糖饮食是 2 型糖尿病的重要环境诱因。从分子角度看,过多的热量摄入,尤其是饱和脂肪和简单碳水化合物,会导致细胞内脂质代谢紊乱。例如,过多的脂肪酸可在肌肉、肝脏等组织中沉积,形成脂毒性。
- 脂毒性可通过多种机制影响细胞功能。一方面,它可以干扰胰岛素信号传导。脂肪酸可以激活一系列细胞内的信号通路,如丝裂原活化蛋白激酶(MAPK)通路,该通路的过度激活会抑制胰岛素信号通路。另一方面,脂肪酸可诱导细胞产生氧化应激,产生过多的活性氧(ROS)。ROS 可以损伤细胞内的蛋白质、脂质和 DNA,影响胰岛素受体和下游信号分子的功能,导致胰岛素抵抗。
- 高糖饮食可导致细胞内葡萄糖浓度过高,引起一系列代谢应激反应。例如,葡萄糖可以通过多元醇通路代谢增加,该通路的激活会消耗还原型辅酶Ⅱ(NADPH),同时产生山梨醇等物质,山梨醇在细胞内积累可导致细胞渗透压升高,损伤细胞功能。此外,高糖还可以促进晚期糖基化终末产物(AGEs)的形成。AGEs 可以与细胞表面的受体结合,激活一系列细胞内信号通路,导致炎症反应和氧化应激,进而损害细胞功能,引起胰岛素抵抗。
2. 缺乏运动
- 缺乏运动可导致肌肉组织对葡萄糖的摄取和利用减少。从分子水平来看,运动可以激活一系列信号通路,促进 GLUT4 从细胞内转位到细胞膜表面,增加细胞对葡萄糖的摄取。而缺乏运动时,这些信号通路活性降低,GLUT4 转位减少,细胞摄取葡萄糖的能力下降。
- 此外,缺乏运动还会导致脂肪堆积,尤其是腹部脂肪的增加。脂肪细胞会分泌多种脂肪细胞因子,如瘦素、脂联素等。在肥胖状态下,瘦素抵抗和脂联素水平降低较为常见。瘦素是一种由脂肪细胞分泌的激素,它可以调节食欲和能量代谢。当发生瘦素抵抗时,大脑对瘦素的信号不敏感,导致食欲增加和能量摄入过多。脂联素具有抗炎、增加胰岛素敏感性等作用,其水平降低会削弱机体对胰岛素的敏感性,促进胰岛素抵抗的发生。
3. 长期精神压力
- 长期精神压力可通过神经内分泌系统影响血糖代谢。在应激状态下,下丘脑 - 垂体 - 肾上腺轴(HPA 轴)被激活,导致肾上腺皮质分泌过多的糖皮质激素。糖皮质激素可以通过多种分子机制影响血糖代谢。它可以促进肝脏的糖异生,增加葡萄糖的输出;同时,糖皮质激素还可以抑制肌肉和脂肪组织对葡萄糖的摄取和利用,导致血糖升高。
- 此外,精神压力还可以引起自主神经系统功能紊乱。交感神经兴奋会释放去甲肾上腺素等神经递质,这些神经递质可以通过激活细胞内的信号通路,如 cAMP - 蛋白激酶 A(PKA)通路,抑制胰岛素信号传导,导致胰岛素抵抗。

三、胰岛素抵抗与胰岛β细胞功能缺陷
1. 胰岛素抵抗
胰岛素抵抗是 2 型糖尿病的早期关键特征。在分子水平上,胰岛素与胰岛素受体结合后,会激活胰岛素受体底物(IRS),进而激活 PI3K - Akt 等信号通路。在胰岛素抵抗状态下,IRS 的酪氨酸磷酸化减少,而丝氨酸/苏氨酸磷酸化增加。丝氨酸/苏氨酸磷酸化会干扰 IRS 与胰岛素受体的结合以及下游信号的传递。例如,炎症细胞因子如肿瘤坏死因子 -α(TNF -α)、白细胞介素 - 6(IL - 6)等可以激活一系列激酶,导致 IRS 的丝氨酸/苏氨酸磷酸化增加。
此外,胰岛素抵抗还与细胞内脂质代谢异常密切相关。过多的脂肪酸及其代谢产物可以抑制胰岛素信号传导。例如,二酰甘油(DAG)可以激活蛋白激酶 C(PKC),PKC 可以磷酸化 IRS 等分子,抑制胰岛素信号通路。同时,脂肪酸氧化产生的乙酰辅酶 A 可以进入细胞核,调节基因表达,影响与糖脂代谢相关酶的合成和活性,进一步加重胰岛素抵抗。
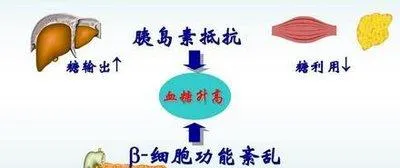
2.胰岛β细胞功能缺陷
- 随着胰岛素抵抗的持续存在,胰岛β细胞需要代偿性地增加胰岛素分泌来维持血糖正常。然而,长期的高负荷工作会导致胰岛β细胞功能逐渐减退。从分子角度来看,长期高血糖可通过多种机制损害胰岛β细胞功能。例如,高血糖可引起氧化应激,产生过多的 ROS,损伤胰岛β细胞内的线粒体功能,影响能量产生和细胞代谢。
- 高血糖还可以激活一系列应激信号通路,如未折叠蛋白反应(UPR)。当细胞内未折叠或错误折叠的蛋白质积累时,UPR 被激活,试图恢复细胞内的蛋白质稳态。但如果应激持续存在,UPR 可能会诱导细胞凋亡。此外,长期高血糖可导致胰岛β细胞的基因表达发生改变,影响胰岛素的合成和分泌相关基因的表达。同时,胰岛素抵抗状态下,脂肪细胞和肌肉细胞分泌的一些细胞因子,如脂联素、抵抗素等,也可以通过旁分泌或内分泌的方式影响胰岛β细胞的功能。
综上所述,2 型糖尿病是遗传因素和环境因素相互作用的结果,其发病机理涉及多个分子层面的变化,包括基因变异导致的细胞功能异常、环境因素引起的代谢紊乱以及胰岛素抵抗和胰岛β细胞功能缺陷等。深入理解这些发病机理对于 2 型糖尿病的预防、诊断和治疗具有重要意义。未来,随着对 2 型糖尿病分子机制研究的不断深入,有望开发出更加有效的治疗方法和策略,以更好地控制血糖,预防并发症的发生。











