随着生物医药技术的进步,近年来越来越多的抗癌靶点被发掘出来。与此同时,针对同一个抗癌靶点,不同作用机制的抗癌药物也如雨后春笋般涌现。
比如 HER2扩增 是乳腺癌、胃癌、肠癌等多种实体瘤中常见的致癌变异,针对这个明星靶点,现在既有 小分子酪氨酸激酶抑制剂 (关闭致癌蛋白的发动机)、也有 单克隆抗体 直接阻断致癌蛋白和癌细胞之间罪恶连接、还有以该靶点为导航后面挂着数量庞大化疗药的 抗体偶联药物 (ADC)、以及靶向攻击这个致癌蛋白的 CAR-T ……
一时间,携带这类靶点的病友,有了众多的选择, 那么到底哪一种作用机制的抗癌药,疗效更好、安全性更可控呢?
一般而言:
除了HER2这个明星靶点,另一个在消化道肿瘤和胸部肿瘤中常见的抗癌靶点—— Claudin18.2 ,近期也迎来了多种作用机制的抗癌药物井喷式的临床试验数据。
本文重点介绍一下这个新起的抗癌明星靶点及其多种机制的抗癌药物,以此作为一个实际的案例,来说明不同作用机制抗癌药物的异同和取舍。
首先,是 针对Claudin18.2的CAR-T ,这是一种免疫细胞治疗,需要取足够的患者的外周血,分离产生T淋巴细胞,然后体外进行基因改造,使这些T细胞获得能够特异性识别高表达Claudin18.2这种致癌蛋白的肿瘤组织的能力;此后,患者经过1-2轮的清髓化疗,把自身骨髓内的淋巴细胞清除掉,然后再将在体外经过基因改造和功能活化的T细胞,静脉输液的方式回输给病人。
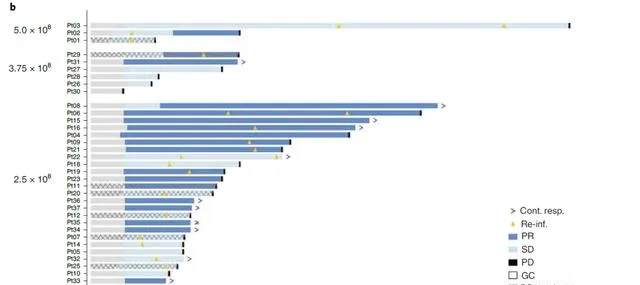
靶向Claudin18.2的CAR-T,目前研发最成熟的是一款国产的产品,其详细的抗癌数据,咚咚已经做过专门的报道( 「永不失效」的抗癌药:CAR-T细胞可在人体存活超10年 )。简而言之:这款CAR-T治疗晚期难治性消化道肿瘤,有效率为48.6%,其中那些接受了治疗剂量的晚期胃癌患者, 客观有效率高达61.1% (其中部分患者甚至是PD-1抗体治疗失败后的难治性患者);而整体的非血液学3-4级不良反应发生率大约在10%上下,主要是腹痛、溃疡、出血和胰腺炎等。
除了CAR-T,靶向Claudin18.2最明星的产品,当然是技术路线最成熟,相对而言最容易研发的 单抗 。
靶向Claudin18.2的单抗,其实六七年前就已经闪亮登场,造成过学术圈的轰动( ASCO2016 l 新药IMAB362胃癌生存期延长近1倍 )——这个一个明星药物,在过去的6年多里,经历了被天价收购、多个II期临床试验探索最佳人群和剂量,最终于去年迎来了第一个决定性的、全面胜利的III期临床试验(临床试验名字也取得很吉利:SPOTLIGHT)。
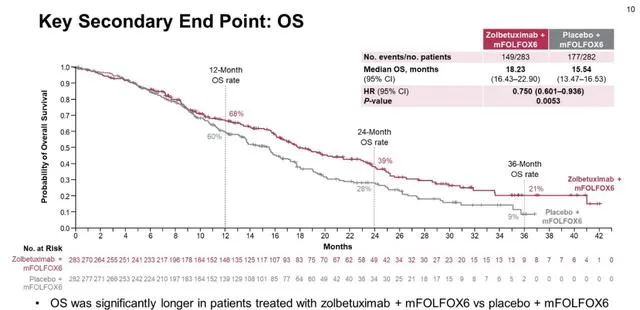
这项3期随机对照临床试验入组了565例Claudin18.2高表达的初治的晚期胃癌、食管胃结合部癌,1:1随机分组,一组接受标准的双药化疗,一组接受靶向药IMAB362(现在已经有正式的大名,zolbetuximab)联合化疗治疗,结果显示: 靶向药的加入,显著延长了患者的无疾病进展生存期 (10.61 vs 8.67月) 和总生存期 (18.23 vs 15.54月) ,3年生存率从9%翻了一倍多到21%。 客观有效率方面,两组是相似的,分别是60.7%和62.1%(这是一线治疗的数据,且主要是化疗的加成)。不良反应方面,大约有13%的病人由于无法耐受该靶向药的副作用而提前停药。
除了CAR-T和单抗,这个靶点也有很多公司正在研发 ADC 。
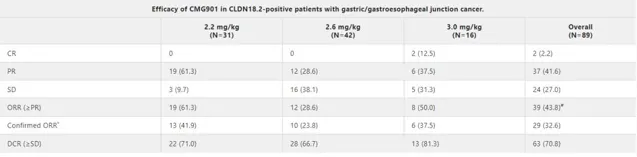
去年底召开的美国临床肿瘤协会胃肠肿瘤年会上,就公布了一款ADC药物的早期临床试验数据。中山大学肿瘤防治中心徐瑞华院长是这款新药的首要研究者,一共入组了113例其他治疗失败的晚期难治性胃癌患者,其中93例患者Claudin18.2阳性。接受ADC药物治疗后, Claudin18.2阳性患者客观有效率达到43.8%。 目前看这款ADC药物的数据激动人心,期待更进一步的大规模验证。
综上所述,针对致癌突变或致癌蛋白驱动的晚期实体瘤患者,针对致癌靶点,可以研发多种多样的抗癌药物,其抗癌活性、不良反应各有千秋,未来将给广大病友带来更多的治疗选择和生存希望。











