*仅供医学专业人士阅读参考


相比淀粉样蛋白斑块形成和神经元丢失,突触丢失是早期阿尔茨海默病(AD)相关认知功能障碍最显著的风险因素。近年来的研究显示,转录调节会影响突触可塑性[1],AD患者大脑的转录组学分析也发现,有多个转录调节因子发生了变化[2,3]。
在最近的 BRAIN 杂志上,上海市东方医院神经内科李刚教授领导的研究团队发表了最新研究结果,他们发现, AD患者大脑中转录因子Maf1的表达增加,破坏了钙稳态和突触重塑,还确定了其中的关键信号通路Maf1-NMDAR1 ,这一发现为AD相关突触丢失提供了新的机制见解和潜在治疗靶点[4]。

Maf1是一种RNA聚合酶III转录调节因子,可以通过激活PTEN通路在肿瘤、糖代谢和脂代谢等方面发挥重要作用。Maf1在中枢神经系统中也高表达,尤其是海马和皮质。Maf1负调节海马神经元的树突和树突棘生长,在小鼠中,对学习和记忆能力产生影响[5]。
基于以往的研究,研究人员认为Maf1可能在AD的发病机制中同样发挥调节作用。
带着这样的猜测,他们对人脑GEO数据库GSE5281的样本进行基因组分析。AD患者和健康人的海马组织中,差异化表达的基因就包括 Maf1 , AD患者的 Maf1 表达显著增加。在6个月大的APP/PS1小鼠海马中,也发现了同样的现象。
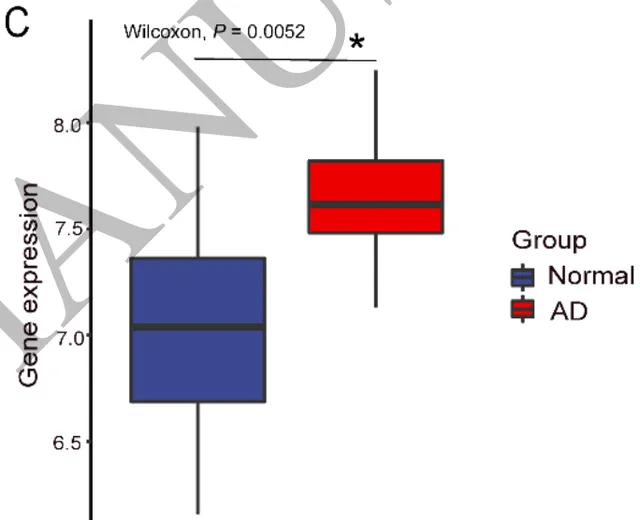
AD患者的 Maf1 表达增加
单纯的表达水平升高或许不足以说明问题。因此,研究人员敲除了AD小鼠海马中的 Maf1 , 敲除后,它们在莫里斯水迷宫等认知测试中的表现明显更好,学习和记忆能力得到增强。 这说明,Maf1表达增加并不是偶然。
敲除了 Maf1 的小鼠的树突棘的密度增加18%,蘑菇样树突棘(成熟状态)密度增加约10%,丝状伪足样树突棘(不成熟状态)减少约17%,这表明 Maf1的减少恢复了AD相关海马神经元的树突棘损伤,可能是通过促进树突棘的发育达成的。

小鼠树突棘密度的变化
树突棘中的钙信号通路在调控突触可塑性中起着重要作用,钙稳态失衡也是AD发生的重要原因之一,在 Maf1 敲除小鼠中,钙离子内流减少 ,钙离子过多会阻断长时程增强(LTP,突触可塑性的重要形式),导致突触丢失和退行性病变,因此,钙离子内流减少后, 小鼠的LTP得到恢复,同时恢复的还有mEPSC ,这是一种自发的突触活动,指每个突触囊泡作用于突触后膜引起的突触后膜电流变化,反映了突触的发育和成熟。
Maf1 敲除后,AD小鼠的基因表达和信号通路再次发生了变化,有564个基因表达下降,320个表达增加。下降的基因主要与突触功能、钙离子信号通路和神经相关配体-受体反应有关,增加的基因则主要与免疫系统疾病、补体和凝血级联反应有关。
在发生变化的与突出功能和钙离子信号通路有关的基因中, Grin1 引起了研究人员的注意,它编码的蛋白NMDAR1在神经元的钙稳态和突触重构中是必不可少的。
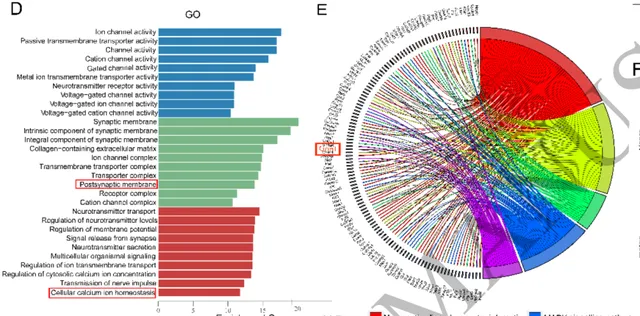
差异化表达基因
研究人员发现, Maf1能够与 Grin1 启动子区域结合,调控NMDAR1的转录,进而调控神经元钙稳态和突触重构。 Maf1- NMDAR1通路的任意一环被干扰,都可以挽救AD相关钙稳态失衡和突触丢失。
综合来看,这项研究揭示了一个AD的新分子机制,提示我们,Maf1可能是早期AD的潜在治疗靶点,研究人员指出,对突触功能障碍的进一步研究可能会为AD早期干预和治疗开辟新的思路和方向。
参考文献:
[1] Michels A A, Robitaille A M, Buczynski-Ruchonnet D, et al. mTORC1 directly phosphorylates and regulates human MAF1[J]. Molecular and cellular biology, 2010, 30(15): 3749-3757.
[2] Williams J B, Cao Q, Yan Z. Transcriptomic analysis of human brains with Alzheimer’s disease reveals the altered expression of synaptic genes linked to cognitive deficits[J]. Brain Communications, 2021, 3(3): fcab123.
[3] Mathys H, Davila-Velderrain J, Peng Z, et al. Single-cell transcriptomic analysis of Alzheimer’s disease[J]. Nature, 2019, 570(7761): 332-337.
[4] https://academic.oup.com/brain/advance-article/doi/10.1093/brain/awae015/7558437
[5] Chen K, Zhu L, Guo L, et al. Maf1 regulates dendritic morphogenesis and influences learning and memory[J]. Cell Death & Disease, 2020, 11(7): 606.
本文作者丨应雨妍











