
现如今,有过敏症状的宝宝越来越多,如何防治孩子过敏成了颇受关注的公共健康问题之一。
过敏的原因除了遗传因素外,还与宝宝肠道菌群失调,自身的免疫系统发育不成熟,环境因素等息息相关。
本文列举的最新研究进展,从 过敏早期识别干预,耐药基因,食物过敏及其因果关联 等方面,展示了微生物群如何在其中发挥作用,为儿童过敏的防治提供新思路。
过敏,早期识别干预
新生儿的第一次大便可能揭示发生过敏的风险
#1
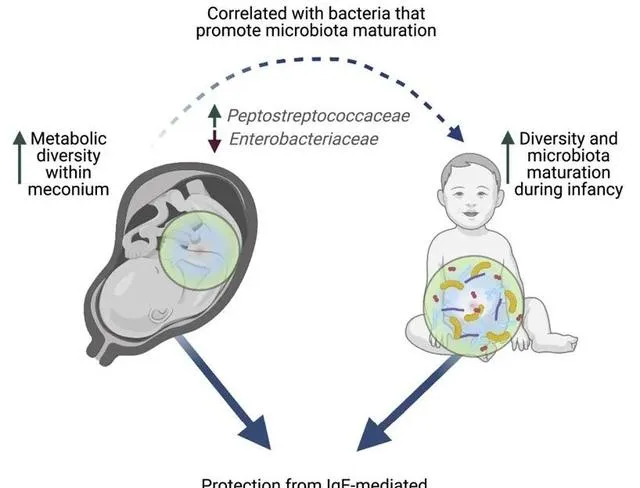
微生物群的成熟 与 免疫系统 的发育 同时发生, 两者都与一系列疾病有关,包括 过敏、花粉热、哮喘和湿疹 。
发表在Cell Reports Medicine 通过分析 100 名 新生儿的粪便 ,研究人员发现婴儿 第一次粪便的成分 可以 决定 儿童在 以后的生活中 是否有可能患上 过敏症和其他疾病 。研究小组发现,缺乏 特定分子 与一年后过敏的风险增加有关。这些 化学物质的减少 与在 微生物群成熟 中起关键作用的 细菌的变化 有关。
Petersen C et al., Cell Rep Med . 2021
新生儿的 第一次粪便,称为胎粪 。胎粪是一种粘稠的 深绿色物质 ,在怀孕 16 周左右开始在胎儿肠道中形成,含有 羊水、皮肤细胞以及婴儿 摄入的其他物质和分子。
胎粪也是出生后在 肠道中定殖的第一批微生物 的最初「 食物来源 」。胎粪就像一个 时间胶囊 ,揭示了婴儿在出生前接触过的东西。
过 敏
为了评估 胎粪成分 是否会影响以后发生 过敏 的风险,研究人员研究了新生儿第一次粪便中存在的代谢物。然后,当孩子们满一岁时,该团队进行了一项 皮肤测试 ,以测量免疫系统的反应性。
分析表明, 婴儿胎粪 中不同类型的分子 越少 ,孩子在出生后第一年内发生 过敏的风险就越高 。
一些代谢途径,包括那些涉及 氨基酸代谢 的途径,在后来出现 过敏性疾病的婴儿 的胎粪中 最少 。
与 没有发生过敏反应 的新生儿相比,在一岁时发生过敏反应的新生儿在出生时的胎粪 代谢多样性降低。
早 期 干 预
接下来,研究人员分析了 胎粪成分 是否会影响 肠道微生物群的成熟 。胎粪「代谢组」较少的婴儿的 细菌丰度平较水平低 ,如 肠杆菌科 ,这在微生物群的成熟中起着关键作用。
最后,研究人员将有关胎粪和微生物群组成的信息与新生儿及其 母亲的临床数据相结合 ,以准确预测婴儿是否会在 1 岁时出现过敏反应。
这项工作表明,健康的免疫系统和微生物群的发展实际上可能 在孩子出生之前就开始了 ——这表明婴儿在 子宫内接触的微小分子 对 未来的健康 起着至关重要的作用。
研究人员说,调节子宫内 关键代谢物的早期干预措施 有助于促进 微生物群和免疫系统的健康发育 ,从而 预防 过敏性疾病的症状。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献:
Petersen C, Dai DLY, Boutin RCT, Sbihi H, Sears MR, Moraes TJ, Becker AB, Azad MB, Mandhane PJ, Subbarao P, Turvey SE, Finlay B B. A rich meconium metabolome in human infants is associated with early-life gut microbiota composition and reduced allergic sensitization. Cell Rep Med. 2021 Apr 29;2(5):100260.
生命早期,耐药基因
婴儿的肠道微生物群包含数百个抗生素抗性基因
#2
人类 肠道微生物群 已成为细菌的储存库,这些 细菌 含有帮助它们 抵抗抗生素 的基因。
发表在Cell Host & Microbe的一项研究通过分析 丹麦 650 多名一岁儿童 的粪便样本,发现婴儿的肠道细菌有数 百个抗生素抗性基因 。
怀孕期间使用抗生素和家里有年长的兄弟姐妹似乎会影响肠道微生物群中 抗生素抗性基因 的数量。更重要的是, 较高水平的抗生素抗性基因 与 特定的肠道微生物组成 有关,而后者与晚年患 哮喘 的风险增加有关。
哥本哈根大学的Søren Johannes Sørensen及其同事收集了 丹麦 662 名一岁儿童 的粪便样本,并分析了样本中存在的微生物 DNA。
Li X et al. , Cell Host Microbe. 2021
抗 生 素 抗 性 基 因
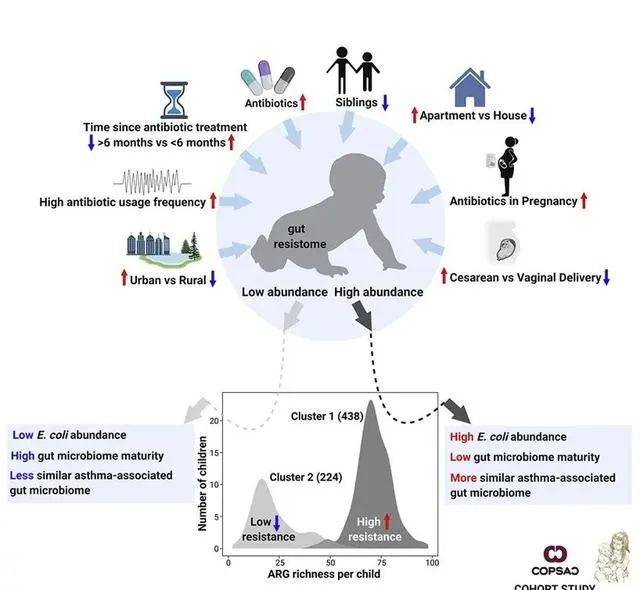
该研究研究人员发现了 409 种抗生素抗性基因 ,这些基因赋予了对 34 类抗生素的抗性 。在这些抗生素抗性基因中, 167 个赋予了对一种以上抗生素的抗性 。
所有儿童都 至少有一种基因 能够对 多种抗生素产生抗药性 ,包括被世界卫生组织列为 极其重要的抗微生物药物 。 即使 孩子们没有服用这些药物,这些 基因也存在 。
研究小组发现, 粪便样本 可以根据 抗生素抗性基因 的丰度分为 两个主要集群 ,其中 大肠杆菌 是其中一个集群中最丰富的物种。研究人员发现,该簇中所有抗生素 抗性基因中约有 55% 来自大肠杆菌 。
一般来说,变形杆菌,如 埃希氏菌( Escherichia )、克雷伯菌( Klebsiella )和肠杆菌( Enterobacter ) ,在婴儿肠道中含有 最多的抗生素抗性基因 。众所周知, 变形菌是几种感染的罪魁祸首 ,并且能够将它们的 DNA 转移到其他细菌中。
环 境 影 响
为了评估不同的 环境因素如何影响抗性基因的分布 ,研究人员研究了 抗生素的使用频率、兄弟姐妹的存在、家庭类型和分娩方式 等。
抗性基因的丰度受到多种因素的影响,例如儿童是在农村还是城市 环境 中长大。生活在 城市地区 的儿童比生活在 农村地区 的儿童具有 更高水平的抗性基因 。
家里有 兄弟姐妹以及在怀孕后期使用抗生素 也影响了婴儿肠道中的基因分布。
进一步的分析表明,较高水平的 抗生素抗性基因 往往与特定的 肠道微生物组成有关 ,而 后者与晚年患哮喘 的风险增加有关。
研究人员表示,虽然抗生素抗性基因在肠道微生物群发育中的作用尚不清楚,但高水平的 此类基因 可能会带来 更多的健康风险 。
这些发现可用于为旨在减少抗菌素耐药性传播的公共卫生干预措施提供信息,尤其是在病原菌中。
参考文献:
Li X, Stokholm J, Brejnrod A, Vestergaard GA, Russel J, Trivedi U, Thorsen J, Gupta S, Hjelmsø MH, Shah SA, Rasmussen MA, Bisgaard H, Sørensen SJ. The infant gut resistome associates with E. coli, environmental exposures, gut microbiome maturity, and asthma-associated bacterial composition. Cell Host Microbe. 2021 Jun 9;29(6):975-987.e4.
细菌失衡,食物过敏
一些肠道细菌可以预防和逆转食物过敏
#3
在过去十年中, 患有食物过敏 的人数 急剧增加 。一种假设是,某些 生活方式因素 ,例如剖腹产增加和母乳喂养减少,会破坏肠道中的正常微生物组成,剥夺婴儿的 有益细菌 ,使免疫系统将食物识别错误。
通过对 56 名食物过敏婴儿 和 98 名健康儿童的分析,研究人员发现食物过敏婴儿粪便中的细菌与健康人的粪便中的 细菌不同 。给予食物过敏儿童粪便细菌的小鼠出现 过敏反应 。但是,当给动物喂食 已知可以防止食物过敏 的 特定细菌 时,它们并 没有出现食物过敏 ,而喂食其他常见细菌的老鼠却会。
波士顿儿童医院的Azza Abdel-Gadir和Emmanuel Stephen-Victor以及布莱根妇女医院的Georg Gerber领导的一个团队研究了有和没有食物过敏的婴儿的肠道细菌。
细 菌 失 衡
研究人员收集了 56 名食物过敏婴儿和 98 名健康儿童的粪便样本,然后分析了他们的 微生物组成 。 食物过敏婴儿粪便中的细菌与健康人不同 。特别是,食物过敏的孩子属于 梭菌( Clostridiales )家族 的细菌 较少 。
接下来,该团队将 有或没有食物过敏的婴儿的粪便细菌 转移到对 鸡蛋敏感的小鼠体内 。接受来自健康儿童肠道微生物的啮齿动物比接受来自食物过敏婴儿的微生物群的啮齿动物 更能防止鸡蛋过敏。
「好」 细 菌
研究人员开发了属于 梭菌属和拟杆菌属 的不同种类细菌的 混合物 ,已知它们 可以防止食物过敏 。给予有益细菌的老鼠 不会对鸡蛋过敏,而给予其他常见细菌的老鼠却会 。
为了探索这些细菌如何影响 食物过敏易感性 ,该团队研究了人和小鼠的 免疫学变化 。梭菌和拟杆菌刺激了特定的调节性 T 细胞 ,这是一种 促进耐受反应 而不是过敏反应的免疫细胞。
这些发现最终会导致 新的治疗方法 ,以防止 有风险的新生儿发生食物过敏 ,甚至 逆转已经患有食物过敏 的人的病情。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献
Abdel-Gadir A, Stephen-Victor E, Gerber GK, Noval Rivas M, Wang S, Harb H, Wang L, Li N, Crestani E, Spielman S, Secor W, Biehl H, DiBenedetto N, Dong X, Umetsu DT, Bry L, Rachid R, Chatila TA. Microbiota therapy acts via a regulatory T cell MyD88/RORγt pathway to suppress food allergy. Nat Med. 2019 Jul;25(7):1164-1174. doi: 10.1038/s41591-019-0461-z. Epub 2019 Jun 24. Erratum in: Nat Med. 2019 Sep;25(9):1458.
食物过敏,因果关联
科学家探索肠道微生物群在食物过敏中因果作用
#4
花生酱、牛奶和面包 :它们都是童年的 经典主食 。但是它们 正成为越来越多的儿童 身体认定为 奇怪有害物质 的食物,在某些情况下会引 发危及生命的过敏反应 。
尚不清楚为什么会出现这种 患病率增加 的情况——但它使得对 食物过敏预防和治疗的科学研究变得更加重要 。最新的研究表明,婴儿和儿童的 肠道微生物群 可能在食物过敏最终的发展过程中发挥作用。
比如 牛奶过敏 特别令人感兴趣,因为在生命的最初几个月, 婴儿必须喝一种或另一种牛奶 , 牛奶是母乳的常见替代品 。据观察,与健康儿童相比,牛奶过敏儿童的 肠道微生物群存在显着差异 ;一项研究显示, 3-6个月大的婴儿的肠道菌群组成存在差异 ,这些婴儿的牛奶过敏最终在8岁时得到解决。
食物过敏的特征是接触特定 食物或「抗原」后对健康产生不利影响 。在最常见的疾病形式中,即所谓的「 IgE 介导的过敏 」,会发生非常特异性的免疫反应:抗原激活称为 Tp 细胞的免疫细胞,从而刺激产生属于一类称为免疫球蛋白 E (IgE) 的抗体) 并将它们置于血液中。这会引发症状, 从皮疹到严重的全身过敏反应 。
芝加哥大学(美国)Cathryn Nagler 实验室的一项人性化小鼠研究使这项 工作更进了一步 ,探索肠道微生物群是否可能在食物过敏反应中起 因果作用 。
首先 ,研究人员从一小群健康婴儿和一小群已确认 IgE 介导的牛奶过敏的婴儿身上采集粪便样本,并确认存在 显着不同的细菌群落 。
然后是 小鼠实验 :无菌小鼠对牛奶成分「敏感」(过敏),然后被健康婴儿和对牛奶过敏的婴儿的 肠道微生物定植 。
当小鼠暴露于抗原时,研究人员发现那些定植了过敏婴儿微生物群的小鼠会出现 过敏反应和更明显的免疫反应 ;接受了健康婴儿微生物群的小鼠 免受 过敏反应的影响。
然后研究人员仔细观察,将各种细菌物种与经历或未经历过敏反应的小鼠中上调的 基因相关联 ;他们确定了一种似乎对过敏反应具有保护作用的细菌种类: 粪厌氧棒杆菌( Anaerostipes caccae ) 。果然,如果无菌小鼠 只被这个物种定植 ,当它们遇到牛奶抗原时,它们 不会发生过敏反应 。
一些以微生物组为重点的治疗方法已经在调查中:例如,一项试验发现 ,花生口服免疫疗法加上一种特定的益生菌 (鼠李糖乳杆菌CGMCC 1.3724)可有效诱导已确诊花生过敏的儿童的免疫变化和对花生蛋白的 反应迟钝 。
从不同角度和不同模型的进一步研究应该有助于揭示肠道微生物群在与食物过敏相关的免疫反应中的作用——希望通过微生物群的操纵,能很快帮助更多的孩子健康地享受花生,牛奶等美食。
参考文献:
Tang ML, Ponsonby AL, Orsini F, Tey D, Robinson M, Su EL, Licciardi P, Burks W, Donath S. Administration of a probiotic with peanut oral immunotherapy: A randomized trial. J Allergy Clin Immunol. 2015 Mar;135(3):737-44.e8. doi: 10.1016/j.jaci.2014.11.034. Epub 2015 Jan 13. PMID: 25592987.
Sicherer SH, Sampson HA. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment. J Allergy Clin Immunol. 2014 Feb;133(2):291-307; quiz 308. doi: 10.1016/j.jaci.2013.11.020. Epub 2013 Dec 31. PMID: 24388012.











