胆汁淤积 ,作为肝脏疾病的一种显著临床表现,其发病率呈现出显著的上升趋势。在现有的治疗手段中,熊去氧胆酸(UDCA)已被证实对早期 原发性胆汁性肝硬化(PBC) 具有确切的治疗效果。然而,对于部分UDCA不耐受的PBC患者,含酒精酸被用作替代治疗方案,但其应用常伴随着不良反应的发生。更为严重的是, 胆汁淤积的持续发展可能进一步导致高胆红素血症和肝损伤 。因此,迫切需要研发新型的治疗策略。
研究表明,肠道微生物群具备多样化的生物学功能,其中之一便是调节宿主代谢。 胆汁淤积的一个显著特征是肠道微生物群的失衡 。一项临床研究指出,粪便细菌移植对PSC患者具有积极的治疗效果,这提示肠道微生物群的失调与胆汁淤积性肝病之间存在关联,调节微生物群可能对治疗胆汁淤积性疾病具有潜力。
中医(TCM)理论中,胆汁淤积亦称为黄疸。 青蒿是治疗黄疸的一种常用中草药,其活性成分涵盖了抗胆汁淤积、肝保护和抗氧化应激等方面 。在这些成分中,多糖是不可或缺的一部分。有报道显示, 茵陈蒿多糖(APS) 对大鼠妊娠期胆汁淤积和肝外胆汁淤积均表现出保护作用。但对于肝内胆汁淤积,APS的保护作用仍有待进一步研究明确。
近日,一篇名为「Artemisia capillaris Thunb. Polysaccharide alleviates cholestatic liver injury through gut microbiota modulation and Nrf2 signaling pathway activation in mice」的论文探讨了 茵陈蒿多糖对胆汁淤积和肝损伤的保护作用及其机制 。

图1 论文首页
APS改善ANIT诱导的小鼠胆汁淤积性肝损伤
图2A显示,患有胆汁淤积症的小鼠血清生化指标出现了明显的上升。然而,接受了低剂量和高剂量的APS治疗后,这些生化指标均出现了显著的降低。除此之外,胆汁淤积小鼠的肝脏损伤情况,包括中性粒细胞浸润和肝细胞坏死的程度也有所增加。经APS处理后,这些情况均得到了明显的改善(图2B、C)。结果表明, APS对于胆汁淤积性肝损伤具有显著的治疗作用 。
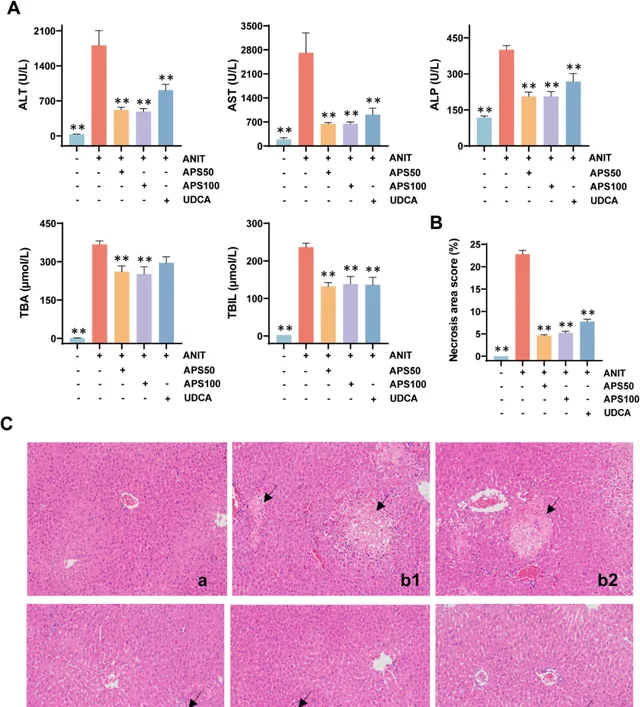
图2 茵陈蒿多糖改善胆汁淤积小鼠的肝损伤
APS通过调节Nrf2通路改善胆汁淤积小鼠的BA稳态
在Vehicle+ANIT组胆汁淤积小鼠中,血清中牛磺酸结合、甘氨酸结合以及未结合TBAs的浓度均有显著升高。但APS治疗之后,相关水平有所降低(图3A、B)。同时,胆汁淤积小鼠肝脏组织中的BA含量也有所增加,而APS则能够降低牛磺酸结合BAs和TBAs的浓度(图3C、D)。
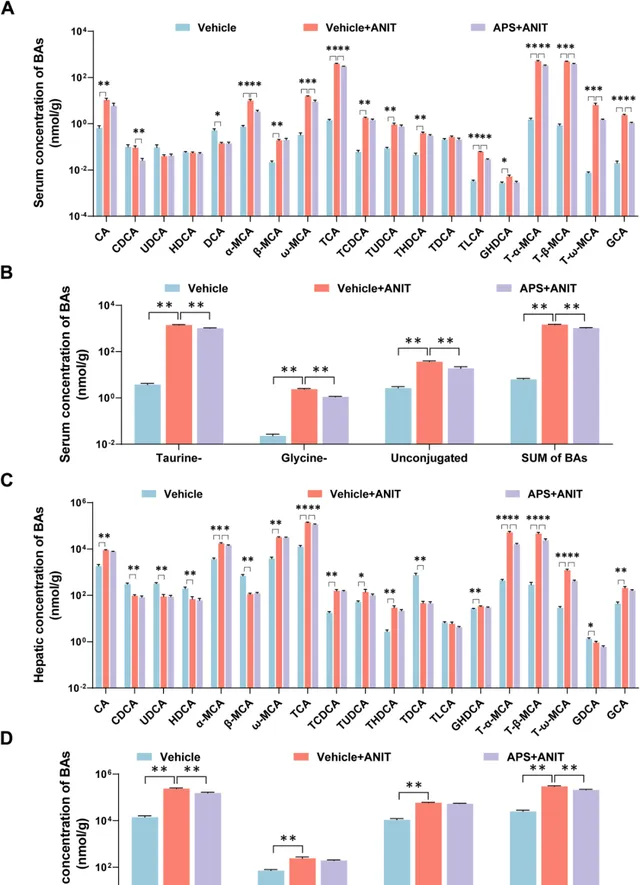
图3 茵陈蒿多糖降低胆汁淤积小鼠的血清和肝脏胆汁酸
为深入探索APS如何影响BA的稳态,研究利用实时PCR技术检测了BA摄取转运蛋白、外排转运蛋白、代谢酶以及合成酶的表达情况。结果显示,APS并未对胆汁淤积小鼠肝脏组织中Fxr、Pxr、Tgr5和Car的表达产生显著影响。然而,接受APS治疗后,胆汁淤积小鼠肝脏组织中Nrf2及其下游外排转运体Mrp2、Mrp3和Mrp4的mRNA表达水平均显著上调(图4A)。
进一步地,通过免疫荧光染色技术,研究者观察到APS治疗后,Nrf2在肝脏细胞核中的表达显著增加,而在胞质溶胶中的表达则相应减少(图4B、C),MRP2、MRP3和MRP4的蛋白表达也在APS的作用下得到上调(图4D、E)。
综上所述, APS通过上调Nrf2及其下游外排转运体的表达,促进了BA的排泄,从而减少了BA在肝脏组织中的积聚 。
APS增加Nrf2下游抗氧化基因表达并减少氧化性肝损伤
经APS给药处理后,胆汁淤积小鼠肝脏内Nrf2下游基因的mRNA表达水平得到上调,其中包括Ho-1、Nqo-1和Gclc(图4F)。此外,APS还能显著降低胆汁淤积小鼠体内活性氧自由基(ROS)的表达水平(图4G)。研究发现,APS在胆汁淤积小鼠的肝组织中显著上调了HO-1、NQO1、GCLC和GCLM蛋白的表达(图4D–H)。总之, APS通过诱导Nrf2下游抗氧化基因的表达,有效减少了氧化性肝损伤的发生 。
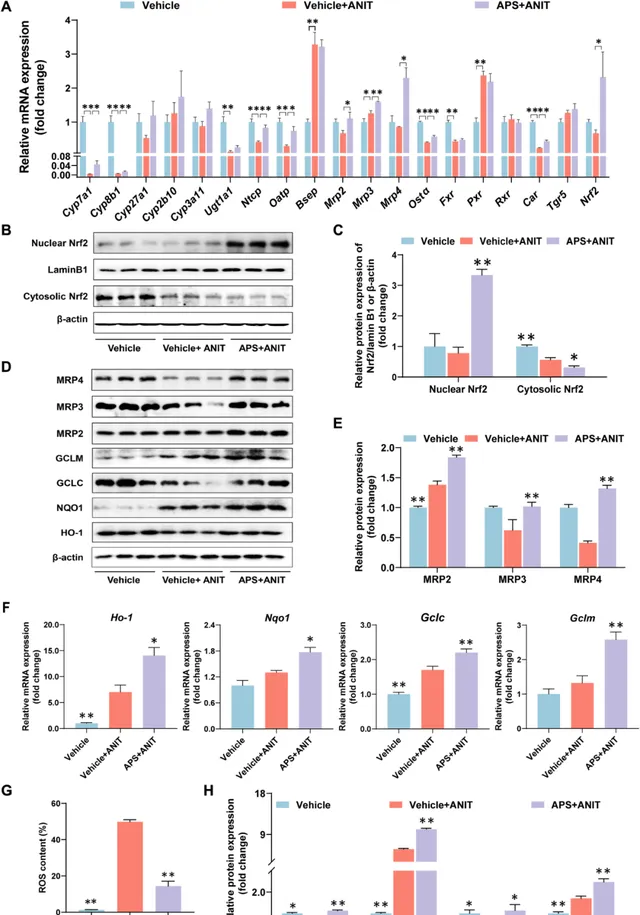
图4 茵陈蒿多糖增加胆汁淤积小鼠Nrf2、胆汁酸外排转运蛋白以及抗氧化基因的表达
APS对胆汁淤积性肝损伤的保护作用依赖于Nrf2的激活
在Nrf2基因敲除的小鼠模型中,当胆汁淤积发生时,其血清生化指标水平出现了明显的上升,然而,经过APS处理后,并未观察到这些指标的改善(图5A)。此外,对患有胆汁淤积症的Nrf2基因敲除小鼠进行APS处理,其肝细胞浸润和坏死的情况也并未得到明显缓解(图5B、C)。这些结果 进一步确认了APS对肝损伤的保护作用需要依赖于Nrf2的激活状态 。
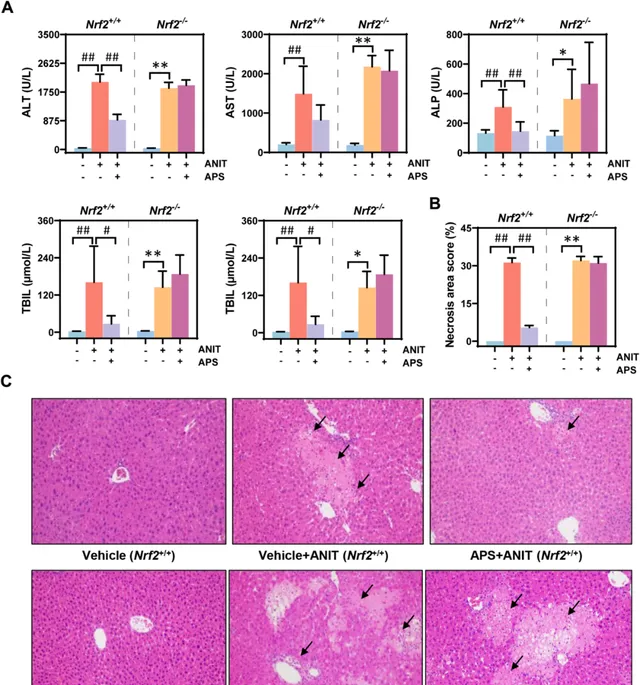
图5 在Nrf2敲除小鼠中,APS对胆汁淤积性肝损伤的保护活性消失
APS对BA稳态和氧化性肝损伤的保护作用依赖于Nrf2的激活
在Vehicle+ANIT组中,观察到胆汁淤积小鼠(Nrf2−/−)血清和肝组织中的牛磺酸结合、甘氨酸结合以及非结合型胆汁酸(BA)水平均有显著上升,而APS对此并无缓解作用(图6A-D)。进一步分析显示,在胆汁淤积的Nrf2敲除小鼠中,APS原本对肝组织中Mrp2、Mrp3和Mrp4的mRNA及蛋白表达上调作用被完全消除(图6E-F,H)。
此外,在胆汁淤积的Nrf2敲除小鼠中,APS并未能增加肝脏Nrf2下游抗氧化基因的表达(图6H-J)。同时,APS也未能降低胆汁淤积的Nrf2敲除小鼠肝脏中的活性氧(ROS)水平(图6G)。结果 明确表明APS对胆汁酸稳态以及胆汁淤积性氧化损伤的影响是依赖于Nrf2途径的 。
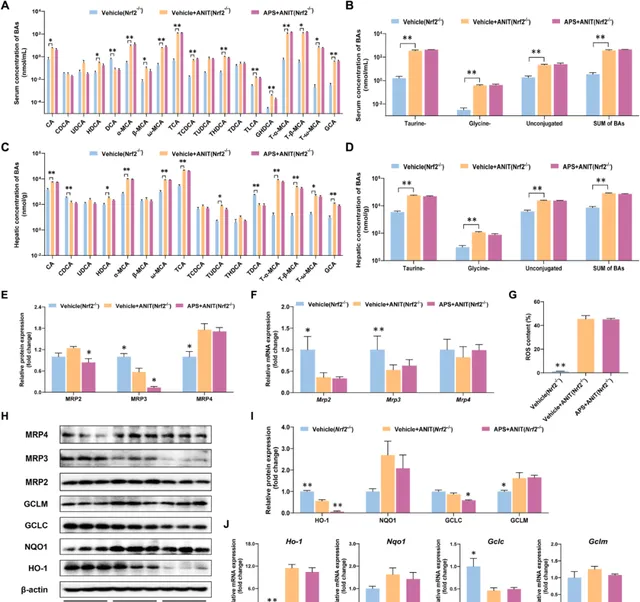
图6 在胆汁淤积的Nrf2敲除小鼠中,APS改善的BAs稳态和氧化性肝损伤无效
APS缓解胆汁淤积小鼠肠道微生物群失调
经对 肠道微生物群 的数据分析(图7)。在α多样性分析中,Sobs指数在Vehicle、ANIT和APS处理组之间并无显著差异(图7A)。然而,在β多样性分析中,通过主坐标分析(PCA)和非度量多维标度分析(NMDS)揭示,Vehicle、ANIT和APS处理组的微生物群组成存在显著差异(图7B-C)。
为了更直观地了解不同组(Vehicle、ANIT、APS)间共享的操作分类单元(OTU)及OTU的平均数量,研究采用了维恩图进行可视化(图7D)。在门水平上,与Vehicle组相比,ANIT组中拟杆菌门和变形菌门的丰度有所增加,而厚壁菌门的丰度则降低;相反,APS处理组则表现出变形菌门和厚壁菌门的丰度降低,而丰度增加的趋势(图7E)。
在科水平上,研究发现ANIT组中肠杆菌科的丰度增加,而毛螺菌科的丰度减少;而APS给药后,这些组成变化得到了逆转(图7F)。在属水平上,APS显著增加了胆汁淤积小鼠肠道中产生短链脂肪酸(SCFAs)的细菌(如罗氏菌和乳杆菌)的数量,并降低了条件致病菌(如肠球菌)的数量(图7G)。这些结果表明, APS能够有效改善胆汁淤积小鼠的肠道微生物群失调状况 。

图7 APS缓解胆汁淤积小鼠肠道微生物群失调
结论
结果显示, APS能够通过调节微生物群和激活Nrf2信号通路,有效缓解胆汁淤积性肝损伤的症状 。这一发现为胆汁淤积性肝病治疗提供了新的科学依据,为其靶向肠道微生物群的治疗策略提供了有力证据。
参考文献:
Cai J, Zhu Z, Li Y, Li Q, Tian T, Meng Q, Wang T, Ma Y, Wu J. Artemisia capillaris Thunb. Polysaccharide alleviates cholestatic liver injury through gut microbiota modulation and Nrf2 signaling pathway activation in mice. J Ethnopharmacol. 2024 Jun 12;327:118009. doi: 10.1016/j.jep.2024.118009
来源:梅斯循证中医药











