中心靜脈壓(CVP)反映了主要靜脈,即上腔靜脈和下腔靜脈的壓力。從生理學的角度來看,中心靜脈壓是潛在的心臟表現和靜脈回流之間復雜相互作用的產物;因此,在不同的ICU患者中,CVP對類似血液動力學幹預的反應可能是相反的。從歷史上看,CVP通常用於評估血流動力學、容量狀態和液體反應性。然而,在過去的幾十年裏,多項研究表明,CVP的絕對值和變化與舒張末期左心室容積和心輸出量之間缺乏相關性。不出所料,CVP無法預測液體挑戰時心輸出量的變化。現今CVP的某種「復興」似乎是可能的,因為新的研究表明,基線值的增加和/或該參數的快速增加與急性腎損傷、多器官衰竭、內臟充血和死亡的進展有關。因此,旨在降低CVP的治療可以改善器官功能和臨床結果。顯然,在決定何時以及如何使用該血流動力學參數之前,有許多關於危重患者CVP的問題需要解決。
介紹
血液在某種被稱為「充盈壓」的力作用下進入心室。在右心房的情況下,充盈壓被稱為中心靜脈壓(CVP);更準確地說,CVP近似於右心房的舒張末期壓力。由於中心靜脈通路是大多數ICU患者進行的常規侵入性手術之一,因此可以廣泛監測該參數。
CVP測量的一個典型點是腔靜脈的近端,位於與右心房交界處附近,中央靜脈導管的尖端位於該交界處。通常,右心房的幾何中心應作為CVP測量的基線水平。壓力傳感器在「右心房點」處歸零至大氣壓力,這可以透過從胸骨角度水平開始降低胸部前表面約5厘米長的垂直線(對於成年人)到胸骨和第二肋骨的連線點來容易地確定。在實踐中,「靜脈穩定點」位於腋中線與第五肋骨或第四肋間的交叉處。它很容易辨識,但只有在水平位置才能進行測量。在「靜脈穩定點」投影中測得的值超過「右心房點」水平處的值約3 mmHg。
中心靜脈壓力曲線的形態學
CVP曲線的形狀與系統(動脈)血壓有一些明顯的相似之處。根據經典表示法,曲線中可以區分五個分段,其中三個是峰值(a、c和v波),兩個是下降(x和y波)(圖1)。人們普遍認為,c、x和v起源於收縮,而a波和下降y是舒張。CVP曲線中最引人註目的元素是a波,它反映了心臟舒張期結束後發生的右心房收縮。近似地,a波對應於心電圖上的P波。隨著右心房舒張的開始,a波逐漸消失,並被一個小的重搏c波中斷,該波與右心室的等容量收縮和關閉的三尖瓣向心房「脫垂」有關。
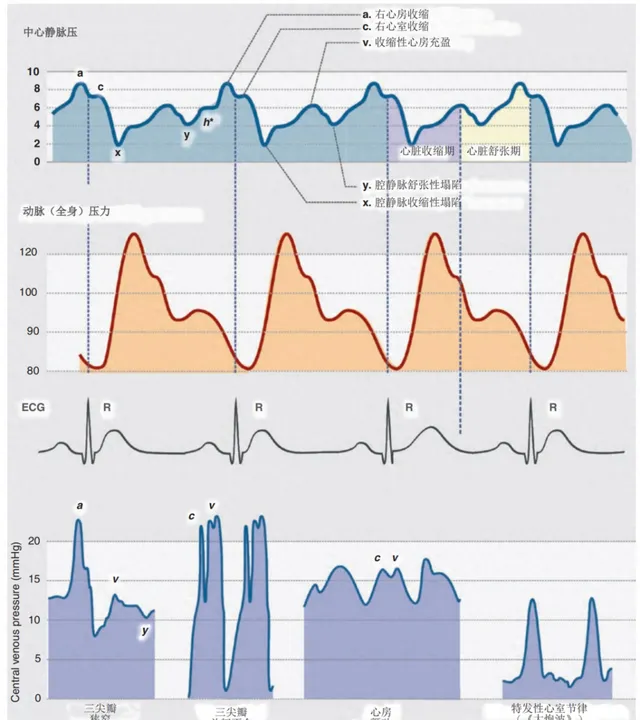
如果在靜脈床的更遠端部份進行測量,例如在頸內靜脈的上球中,波c可能與從頸內動脈傳輸的脈動(「頸動脈波」)有關。c波對應於心室收縮的開始,部份對應於早期射血期。心房壓在整個心室收縮過程中持續下降,轉變為下降或切口x。在心室收縮結束時,觀察到CVP的第二次上升,波v與舒張期心房的靜脈充盈有關,波形v大致對應於ECG上的T波,隨後隨著下降y的形成,壓力曲線進一步降低,這與在將血液噴射到心室(舒張期收縮)和開啟三尖瓣期間右心房壓力的下降有關。在某些情況下,可以記錄平台h,從舒張期中期一直持續到末期。
支持分析CVP曲線形狀的最重要論點是早期辨識心律不整的可能性。
中心靜脈壓的決定因素
CVP的最終值是兩個關鍵因素相互作用的產物:表征血液回流到右心的「靜脈回流」功能和心臟功能(心輸出量和收縮力)(圖2)
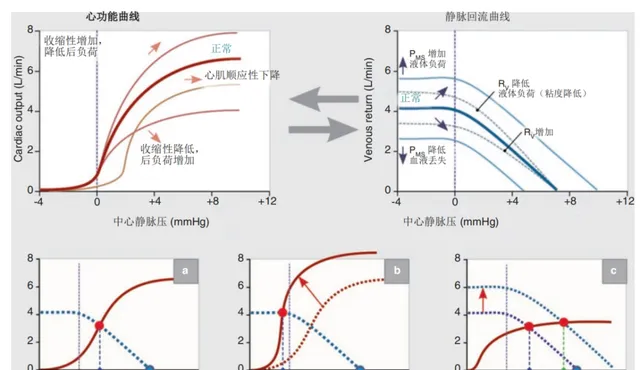
圖2靜脈回流和心臟功能(收縮性)之間相互作用的模型。(a) 心功能和靜脈回流曲線的交點給出心輸出量(CO)、靜脈回流和CVP的結果值。(b) 當收縮力的增加不會導致CO進一步增加時,垂直位置CVP低(負)時的最大靜脈回流(「瀑布」現象)。(c) 靜脈回流曲線穿過心功能曲線的平台;因此,靜脈回流的增加不會導致CO的進一步增加。請註意,根據曲線的同時位置偏移,所產生的CVP值可以增加和減少,這取決於對類似幹預(即液體負荷、血管升壓藥)的個人化反應。CVP中心靜脈壓、CO心輸出量、PMS平均迴圈充盈壓、RV靜脈回流阻力
中心靜脈壓在很大程度上取決於靜脈儲存器的張力(由此產生的順應性)。人們認為,CVP是由血容量和靜脈血管床容量、主靜脈和心臟瓣膜(在更大程度上是三尖瓣)的狀況以及右心室和肺動脈壓力的順應性之間的對應關系決定的。這些眾多因素嚴重阻礙了對CVP基線值和變化的直接臨床解釋。
根據Guyton迴圈模型,心輸出量有三個主要決定因素——心臟的泵送功能、外周血流量阻力和迴圈系統的容量。由於靜脈回流相當於心輸出量,後者的增加可以透過增加平均全身壓力和降低對靜脈回流或CVP的抵抗來實作。在中等體力活動期間,心輸出量增加和CVP同時降低的觀察結果證實了這一點(圖2)
中心靜脈壓的解釋
中心靜脈壓反映了心臟「泵送」流入血液的能力,並表征了右心室的充盈壓力。在這個術語中,臨床醫生經常使用CVP作為心室預負荷和血管內容量的間接指標。
在心臟功能正常和血管內容量充足的情況下,當患者站起來或坐著時,CVP通常低於零(大氣壓)。這可以用舒張期心室的「抽吸」功能來解釋。由於存在空氣栓塞的風險,在直立位(神經外科)進行手術幹預時必須考慮這種影響。
此外,在大多數情況下,CVP換能器是針對相對恒定的大氣壓力進行「校準」的,而不考慮氣道壓力的變化。然而,在評估CVP時,應考慮呼吸的階段、類別和其他特征。在自主吸氣過程中,由於胸部的「抽吸」作用,可以觀察到CVP下降(胸膜內壓力下降後)和流入心臟的血液流量增加(前負荷)。相反,機械通氣過程中的吸氣伴隨著CVP的增加,此外,由於血液流動的限制,還會導致心臟體積的一定減少。在常規臨床實踐中,CVP通常在呼氣末進行評估,從而提供最準確的透壁壓力評估。到被動自主呼氣結束時,或當患者與機械通氣斷開且透壁壓力與CVP最匹配時,胸膜內壓力逐漸恢復為零(大氣壓)。
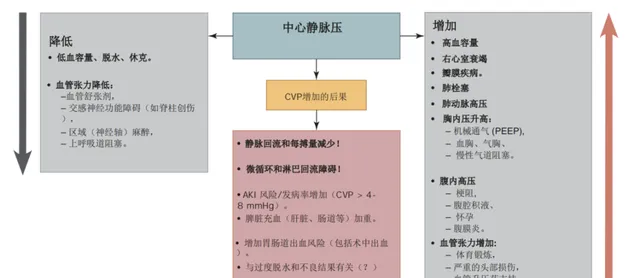
在病理條件下,CVP的作用並不局限於僅指示血管內容量的變化(圖3)。例如,在心輸出量增加(分布性休克、高動態狀態)的情況下,盡管正常或高容量,我們仍可以觀察到CVP降低。相反,當患者患有嚴重的心臟功能障礙或肺動脈高壓(如肺栓塞)時,CVP的增加值既可以記錄在真正的容量過負荷中,也可以記錄在正常容量中。心肌順應性的動態變化(例如,由於使用各種β-腎上腺素能藥物)會使這些相互作用進一步復混成。
中心靜脈壓在臨床套用中的地位
幾十年來,CVP的平均值及其動態變化一直被用作流入心臟的血容量的間接標誌,因此也被用作心室前負荷的間接標誌。20世紀50年代,Hughes和Magovern首次在接受開胸手術的患者中介紹了使用CVP作為液體治療指南的生理基礎。後來,CVP作為前負荷標誌物的臨床價值成為了一個建設性批評的主題。然而,關於最佳心室前負荷指標——容量或壓力——的問題仍未解決。由於心臟的左右部份在功能上是結合的,當右心室達到其功能平台時,左心室的射血也會受到限制。對這一現象的認識導致了「沒有右心室的成功,左心室的成功是不可能的。」在此基礎上,Magder主張使用PAOP和左心室的大小來最佳化前負荷是不可接受的。應該認識到,左心室只能排出右心室輸送的血液量,反之亦然,右心室只能處理左心室能夠接受的血液量。
許多研究和最近的系統綜述表明,在大多數危重患者中,使用CVP的絕對值來預測液體反應性是不可靠的。值得註意的是,CVP關於左心室前負荷的預後價值在腹內高血壓或氣道壓力升高的患者(例如COPD患者)中變得完全不可接受。與此同時,「如何治療休克和CVP正常的患者,或者相反,如何治療該參數值較低的穩定患者?」這個問題仍未解決。
臨床要點
中心靜脈壓是液體反應性的不可靠預測指標。因此,應停止為此目的使用CVP。
中心靜脈壓升高的風險及進一步展望
最近的研究表明,對危重病人進行寬松(或 "激進")輸液治療,導致 CVP 升至 8-12 mmHg 以上,會增加急性腎損傷、多器官功能障礙和死亡的風險和發生率。據報道,CVP 上升 1 mmHg 會導致發生 AKI 的風險增加近 2%。還有研究表明,膿毒癥患者的 CVP 升高≥12 mmHg 與嚴重的微迴圈障礙有關。值得註意的是,"膿毒癥生存運動 "已不再將中心靜脈壓為 8-12 mmHg 作為液體復蘇的目標 . 最近,Xing 等人證實了早期腎臟替代療法降低中心靜脈壓對膿毒癥誘發急性腎損傷患者腎功能恢復的優勢。此外,ARDS 患者的液體降級策略導致 CVP 下降與機械通氣天數減少有關 . 最近的薈萃分析表明,在肝臟切除術中采用不同的策略(特倫德倫堡體位、硝酸甘油、呋塞米、芬太尼、控制輸液速度、夾緊肝內腔靜脈)以控制低 CVP(甚至是目標 "零 "CVP),可顯著減少失血和輸血需求。
臨床要點
中心靜脈壓有可能被視為液體療法安全參數之一。在輸液期間,醫生應註意 CVP 超過 12 mmHg 的多重風險。
然而,"最佳 "CVP 值尚未確定。它應該是個人化的,並盡可能保持在較低水平。此外,CVP 曲線的視覺化分析在心臟手術中仍很有用,可提供有關三尖瓣和二尖瓣功能、心律紊亂對血流動力學的影響以及是否存在縮窄性心包炎和心包填塞的資訊。因此,一些學者主張開展進一步研究,以評估 CVP 監測的潛在益處。
結論
測量 CVP 需要了解測量方法和心血管生理學知識,而分析 CVP 的波形輪廓則有助於發現心臟功能紊亂。顯然,不能建議將 CVP 進一步用作液體反應性的可靠預測指標。不過,監測 CVP 的變化有可能為液體治療的安全性提供重要資訊,並檢測急性腎損傷和微迴圈障礙的風險。未來的研究應探討 CVP 與過度補液和外周組織水腫的關系,並回答該參數在液體療法降級的個人化演算法中可能發揮的作用。











