*僅供醫學專業人士閱讀參考


抗β澱粉樣蛋白(Aβ)單抗和誘導體液免疫反應的主動免疫療法是降低大腦中Aβ斑塊水平的兩種有效方法。主動免疫療法可以透過註射短的或片段的Aβ肽來刺激免疫系統,產生針對Aβ的抗體,減少Aβ斑塊沈積,並且與較少的澱粉樣蛋白相關影像學異常(ARIA)有關[1]。
此前開發的 基於Aβ的主動免疫療法CAD106 ,包含Aβ1-6肽段的多個拷貝 ,可以刺激強烈的B細胞反應,是第二代免疫療法,不會啟用與嚴重不良反應有關的Aβ特異性T細胞反應[1-3]。
在一項2期臨床試驗中,CAD106表現出了良好的安全性和耐受性,以及抗體反應與大腦澱粉樣蛋白變化之間的顯著相關性[4],這賦予了CAD106成為阿爾茨海默病(AD)疫苗的可能性。
基於此類發現,阿爾茨海默病預防倡議(API)代際計劃啟動了 首個晚發性AD預防臨床試驗,納入具有晚發性AD遺傳風險但認知尚未受損的人群接受基於CAD106的預防性治療。
最近,試驗結果發表在 Alzheimer's & Dementia 上, 絕大多數受試者可檢測到血清Aβ免疫球蛋白G(IgG)滴度,與安慰劑相比,CAD106使得Aβ斑塊增加速度顯著減緩 (CAD106組和安慰劑組的澱粉樣蛋白PET Centiloid值的平均年度變化:-0.91 vs. 8.36)[5]。

本研究已於2019年9月23日提前終止,這一決定與CAD106無關,是基於其他抗澱粉樣蛋白治療的陰性結果。盡管提前終止使得研究樣本量不夠大,隨訪時間不夠長,但研究人員認為,他們的發現支持在有AD風險的人群中進行更大規模的Aβ主動免疫療法預防AD的臨床試驗。
研究共納入65例認知未受損的參與者,平均年齡65歲,均為APOEε4純合子,以5:3的比例隨機分配至CAD106 450μg+明礬 450μg(佐劑)或安慰劑+明礬。
大多數CAD106組受試者接受CAD106治療的時間≥18個月,研究人員僅在CAD106組檢測到了Aβ特異性IgG滴度, 97.6%(41/42)的CAD106組受試者有可檢測到的Aβ特異性IgG滴度 ,17例受試者同意在研究完成後繼續接受每三個月一次的抗體檢測,隨訪結束(最後一劑註射後約2年)時,仍有14例(82%)有可檢測到的抗體滴度。
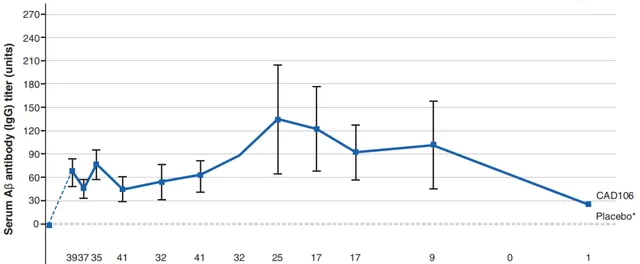
血清Aβ抗體平均滴度隨時間的變化
CAD106未啟用Aβ特異性T細胞。
CAD106組和安慰劑組分別有35例和16例受試者在治療後18-24個月接受了PET, 與CAD106組相比,安慰劑組的澱粉樣蛋白斑塊增加顯著更多 (Aβ PET Centiloid值距基線的平均年度變化:-0.91 vs. 8.36,p<0.001)。 探索性分析顯示,基線Aβ水平升高和未升高的亞組中,CAD106組的Aβ斑塊沈積速度均顯著低於安慰劑組。
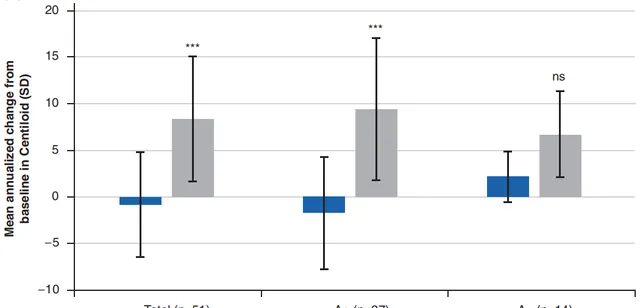
總體、基線Aβ水平升高和未升高亞組受試者,在CAD106組或安慰劑組中的Aβ PET結果距基線的平均年度變化
校正基線Aβ水平後, 與安慰劑相比,CAD106對Aβ清除率有顯著影響。
在CAD106組中,Aβ PET檢測結果距基線的年度變化與抗體滴度之間存在弱線性關系。
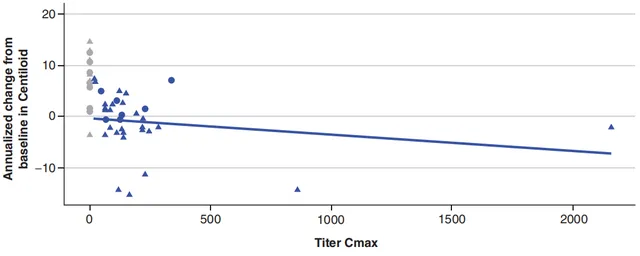
Aβ PET檢測結果變化與抗體滴度之間的線性關系
第26周和52周的腦容量測量結果顯示,CAD106組和安慰劑組沒有顯著差異。兩組的認知功能評估結果較基線的平均變化也沒有差異。
CAD106組和安慰劑組分別有90.5%和91.3%的受試者報告了不良事件(AE), CAD106組的一般反應和註射部位反應發生率高於安慰劑組 (64.3% vs. 21.7%), 其他AE發生率相近。 CAD106組1例受試者因註射相關反應和感覺異常停藥, 3例受試者的MRI檢測結果符合ARIA標準 ,其中1例為有癥狀的ARIA水腫,2例為無癥狀的ARIA出血。
除CAD106組受試者出現過1次嚴重註射部位反應,其余所有疑似藥物相關AE均為輕至中度。沒有出現腦膜炎或腦炎AE。
綜上所述,CAD106具有良好的安全性和耐受性,未出現認知受損的APOEε4純合子個體接受CAD106治療後Aβ抗體滴度一致升高,並且顯著抑制了Aβ斑塊的增加。研究人員認為,這項研究提供了Aβ主動免疫療法在AD一級和/或二級預防中存在價值的證據,支持後續進行更大規模臨床試驗的探索。
參考文獻:
[1] Chackerian B, Rangel M, Hunter Z, et al. Virus and virus-like particle-based immunogens for Alzheimer's disease induce antibody responses against amyloid-β without concomitant T cell responses[J]. Vaccine, 2006, 24(37-39): 6321-6331.
[2] Winblad B, Andreasen N, Minthon L, et al. Safety, tolerability, and antibody response of active Aβ immunotherapy with CAD106 in patients with Alzheimer's disease: randomised, double-blind, placebo-controlled, first-in-human study[J]. The Lancet Neurology, 2012, 11(7): 597-604.
[3] Wiessner C, Wiederhold K H, Tissot A C, et al. The second-generation active Aβ immunotherapy CAD106 reduces amyloid accumulation in APP transgenic mice while minimizing potential side effects[J]. Journal of Neuroscience, 2011, 31(25): 9323-9331.
[4] Vandenberghe R, Riviere M E, Caputo A, et al. Active Aβ immunotherapy CAD106 in Alzheimer's disease: A phase 2b study[J]. Alzheimer's & Dementia: Translational Research & Clinical Interventions, 2017, 3(1): 10-22.
[5] Riviere ME, Langbaum JB, Turner RS, et al. Effects of the active amyloid beta immunotherapy CAD106 on PET measurements of amyloid plaque deposition in cognitively unimpaired APOE ε4 homozygotes. Alzheimer's Dement. 2023; 1-12. https://doi.org/10.1002/alz.13532
本文作者丨應雨妍











