今年ADC領域重大的安全事件黑榜上,Mersana一定榜上有名。今年以來,公司的兩款核心管線都報告了5級(致命)嚴重不良事件(SAE),導致被FDA叫停臨床。
年初,公司還對計劃送出首款產品上市行程而信心滿滿。公司總裁&CEO Anna Protopapas發言表示:「2023年有望成為公司的轉型之年」,今年年中,公司將讀出UpRi的頂線數據並在2023年底送出上市申請。
然而,這一美好期望的破滅也發生短短幾個月之間。UpRi的臨床失利讓其從公司希望之星變為催命之符。

手握四大平台的高光
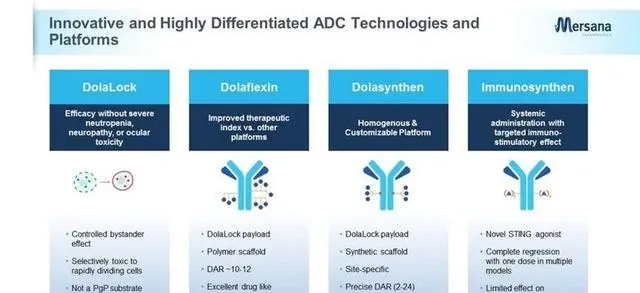
Mersana Therapeutics成立於2002年,2017年在納斯達克上市。公司建立四大ADC研發平台, DolaLock、 Dolaflexin、Dolasynthen和Immunosynthen,代表性產品分別有UpRi、 XMT-1660、XMT-2056等。憑借其專有的ADC技術平台,Mersana獲得了強生、 武田、 葛蘭素史克、德國默克等多家大藥企的認可。
UpRi:2023年的巨變
Dolaflexin是Mersana最重要的技術平台,是一種多彈頭ADC技術,透過將藥物分子(微管抑制劑)連線到Fleximer支架(一種水溶性聚合物)上,大幅提高毒素分子的載量。Dolaflexin能夠實作最大24的DAR值。
UpRi是這個平台下開發的進度最快,也是公司最受期待的管線, 已經推進到了臨床III期階段,開發的適應癥覆蓋卵巢癌、輸卵管癌、腹膜癌。UpRi由人源NaPi2b單複制抗體和微管抑制劑羥丙胺澳瑞他汀F透過可裂解連線子偶聯而成,DAR值約為10,也是全球首款NaPi2b靶向的ADC。

在早期的臨床中,關於這款產品的安全性和有效性數據已讓人存疑。Mersana曾在2021年更新過UpRi的Ⅰ期劑量拓展佇列臨床數據。結果發現,UpRi的ORR呈現了相反的量效關系,即隨著UpRi劑量的升高,ORR反而降低( ORR從2020年5月公布的35%下降至28% )。
此外,該臨床中報告了令人擔憂的毒性問題。有48%的患者出現治療相關性SAE,44%因為治療相關性毒性需要進行藥物暫停,減量或者治療中斷,尤其是在高劑量組中出現了高頻的肝功能異常和肺炎。這個不及預期的臨床結果也直接導致公司股價大跌29%。
2023年6月15日,Mersana宣布停止對兩項臨床試驗UP-NEXT和UPGRADE-A的新患者招募,因為UpRi的臨床中報告了5例5級嚴重(致死)不良事件。根據公司送出給FDA的UpRi安全性分析報告顯示,接受UpRi治療的鉑耐藥卵巢癌患者的嚴重出血事件發生率較高,並且觀察到5例5級(致命)出血事件。
市場對此訊息反應頗為劇烈,Mersana股價當日大跌59%。
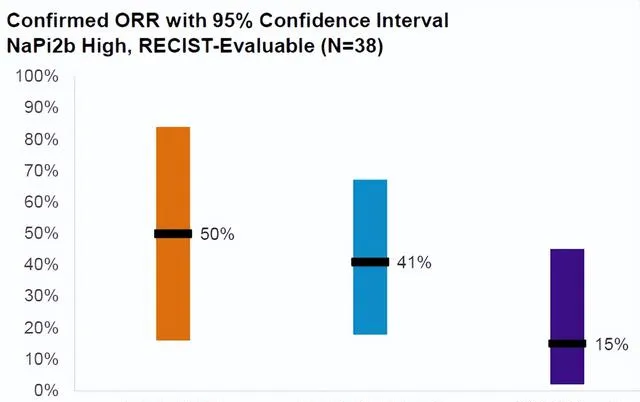
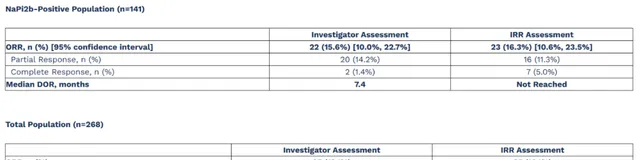
給予公司更致命一擊的是來自UPLIFT頂線數據 。2023年7月27日,UpRi治療鉑類耐藥卵巢癌患者UPLIFT頂線數據公布,UpRi在全部患者群體中的ORR為13.1%,在NaPi2b陽性組中的ORR也僅為15.6%,未達到試驗的主要終點。至此,這款計劃將於今年年底申報上市的ADC管線,失敗的非常徹底。
為此,Mersana重新調整了開發重點,終止UpRi相關的開發工作 ,XMT-1660被升級為公司的重點管線。公司還透過施行50%的裁員措施來大幅削減開支。目前Mersana官網的管線中已經看不到UpRi。
ADC的DAR值一直被認為是提高療效的關鍵,但是DAR的提高很可能會帶來更加嚴重的副作用。最早在2018年7月19日,Dolaflexin公司的第一款管線XMT-1522就因為5級SAE(患者死亡)被FDA暫停臨床,該事件結果最終導致Mersana宣布停止開發。
Dolaflexin下的兩個管線的失敗,無疑導致了合作夥伴對該技術平台的質疑。2023年12月21日,德國默克宣布終止與公司在Dolaflexin平台上達成的合作協定。
踏足ISDC領域的失利
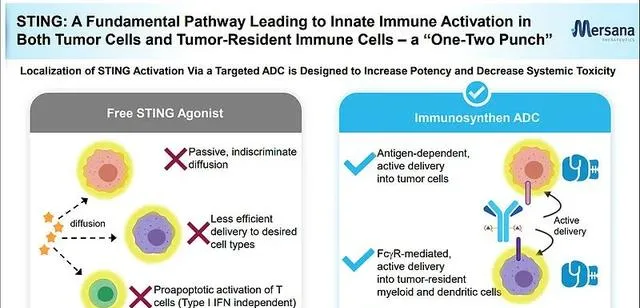
XMT-2056是Immunosynthen平台中進度最快、代表性管線,靶向HER-2的免疫激動ADC,透過將STING激動劑作為ISAC的毒性載荷與HER2抗體進行偶聯,實作STING激動劑在腫瘤中的靶向遞送,DAR值為8。MT-2056較高的DAR使得它在臨床前腫瘤模型中表現優秀,不管是在HER2高表達還是低表達模型中,都表現出了強大的抗腫瘤活性。
基於其套用潛力,XMT-2056也獲得了GSK高價引進。 2022年8月8日,Mersana與GSK就XMT-2056達成了合作協定,後者以1億美元預付款+13.6億美元裏程碑付款+銷售分成獲得了XMT-2056獨家權益。
劑量爬坡對於ISAC而言同樣是一道大關,TLRs、STING等激動劑本身開發常伴有治療視窗窄、全身毒性的問題,在療效提升的同時毒性也將增大,相較於ADC而言,ISAC的治療視窗更難以把控。
一進入臨床後,XMT-2056的毒性就凸顯了出來。今年3月, Mersana報告 XMT-2056的Ⅰ期臨床試驗中,劑量爬坡的第一個劑量組中就出現了5級(致命)嚴重不良事件(SAE),導致被FDA叫停。 這是公司首次踏足XDC領域上的失利,這一事件同樣引發了對Immunosynthen技術平台價值的擔憂。 GSK如今仍未對XMT-2056行駛獨家選擇權。
為了提高安全性,Mersana選擇降低了XMT-2056的起始劑量。10月31日,MT-2056的臨床擱置獲得了FDA解除。
總結
累計三個管線的重大5級SAE事件,讓這家成立20余年的老牌ADC藥企司試錯機會消耗殆盡。如今在公司官網有關技術平台的介紹一欄,只剩下了Dolasynthen和Immunosynthen, DolaLock、 Dolaflexin兩個技術平台已消失無蹤,也沒有任何相應的管線在推進。對於繩處寒冬的 Mersana而言,再也經不起任何的臨床挫折了。
參考出處:
https://www.mersana.com/our-technology-platforms/about-adcs/
https://www.mersana.com/pipeline/overview/
https://ir.mersana.com/static-files/5b93b635-7f16-4f26-8b44-7c69b6131266











