隨著生物醫藥技術的進步,近年來越來越多的抗癌靶點被發掘出來。與此同時,針對同一個抗癌靶點,不同作用機制的抗癌藥物也如雨後春筍般湧現。
比如 HER2擴增 是乳癌、胃癌、腸癌等多種實體瘤中常見的致癌變異,針對這個明星靶點,現在既有 小分子酪胺酸激酶抑制劑 (關閉致癌蛋白的發動機)、也有 單複制抗體 直接阻斷致癌蛋白和癌細胞之間罪惡連線、還有以該靶點為導航後面掛著數量龐大化療藥的 抗體偶聯藥物 (ADC)、以及靶向攻擊這個致癌蛋白的 CAR-T ……
一時間,攜帶這類靶點的病友,有了眾多的選擇, 那麽到底哪一種作用機制的抗癌藥,療效更好、安全性更可控呢?
一般而言:
除了HER2這個明星靶點,另一個在消化道腫瘤和胸部腫瘤中常見的抗癌靶點—— Claudin18.2 ,近期也迎來了多種作用機制的抗癌藥物井噴式的臨床試驗數據。
本文重點介紹一下這個新起的抗癌明星靶點及其多種機制的抗癌藥物,以此作為一個實際的案例,來說明不同作用機制抗癌藥物的異同和取舍。
首先,是 針對Claudin18.2的CAR-T ,這是一種免疫細胞治療,需要取足夠的患者的外周血,分離產生T淋巴細胞,然後體外進行基因改造,使這些T細胞獲得能夠特異性辨識高表達Claudin18.2這種致癌蛋白的腫瘤組織的能力;此後,患者經過1-2輪的清髓化療,把自身骨髓內的淋巴細胞清除掉,然後再將在體外經過基因改造和功能活化的T細胞,靜脈輸液的方式回輸給病人。
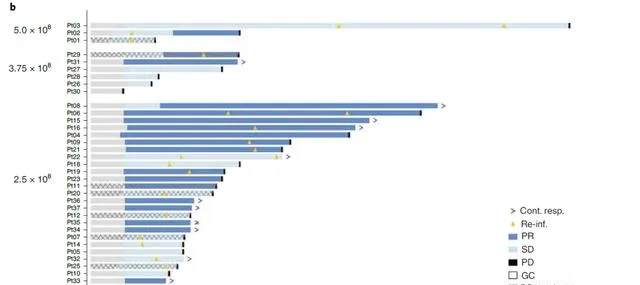
靶向Claudin18.2的CAR-T,目前研發最成熟的是一款國產的產品,其詳細的抗癌數據,咚咚已經做過專門的報道( 「永不失效」的抗癌藥:CAR-T細胞可在人體存活超10年 )。簡而言之:這款CAR-T治療晚期難治性消化道腫瘤,有效率為48.6%,其中那些接受了治療劑量的晚期胃癌患者, 客觀有效率高達61.1% (其中部份患者甚至是PD-1抗體治療失敗後的難治性患者);而整體的非血液學3-4級不良反應發生率大約在10%上下,主要是腹痛、潰瘍、出血和胰腺炎等。
除了CAR-T,靶向Claudin18.2最明星的產品,當然是技術路線最成熟,相對而言最容易研發的 單抗 。
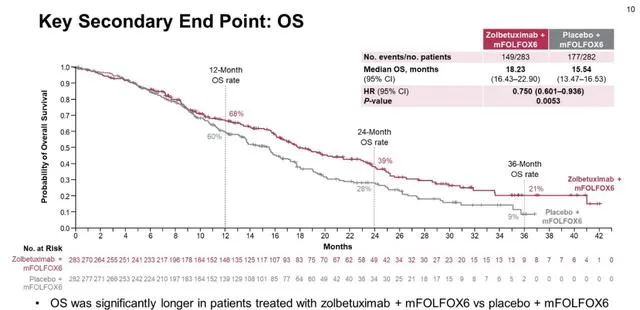
靶向Claudin18.2的單抗,其實六七年前就已經閃亮登場,造成過學術圈的轟動( ASCO2016 l 新藥IMAB362胃癌生存期延長近1倍 )——這個一個明星藥物,在過去的6年多裏,經歷了被天價收購、多個II期臨床試驗探索最佳人群和劑量,最終於去年迎來了第一個決定性的、全面勝利的III期臨床試驗(臨床試驗名字也取得很吉利:SPOTLIGHT)。
這項3期隨機對照臨床試驗入組了565例Claudin18.2高表達的初治的晚期胃癌、食管胃結合部癌,1:1隨機分組,一組接受標準的雙藥化療,一組接受靶向藥IMAB362(現在已經有正式的大名,zolbetuximab)聯合化療治療,結果顯示: 靶向藥的加入,顯著延長了患者的無疾病進展生存期 (10.61 vs 8.67月) 和總生存期 (18.23 vs 15.54月) ,3年生存率從9%翻了一倍多到21%。 客觀有效率方面,兩組是相似的,分別是60.7%和62.1%(這是一線治療的數據,且主要是化療的加成)。不良反應方面,大約有13%的病人由於無法耐受該靶向藥的副作用而提前停藥。
除了CAR-T和單抗,這個靶點也有很多公司正在研發 ADC 。
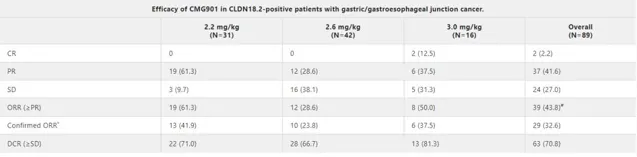
去年底召開的美國臨床腫瘤協會胃腸腫瘤年會上,就公布了一款ADC藥物的早期臨床試驗數據。中山大學腫瘤防治中心徐瑞華院長是這款新藥的首要研究者,一共入組了113例其他治療失敗的晚期難治性胃癌患者,其中93例患者Claudin18.2陽性。接受ADC藥物治療後, Claudin18.2陽性患者客觀有效率達到43.8%。 目前看這款ADC藥物的數據激動人心,期待更進一步的大規模驗證。
綜上所述,針對致癌突變或致癌蛋白驅動的晚期實體瘤患者,針對致癌靶點,可以研發多種多樣的抗癌藥物,其抗癌活性、不良反應各有千秋,未來將給廣大病友帶來更多的治療選擇和生存希望。











