*僅供醫學專業人士閱讀參考
由中國科研人員完成的一項革命性的研究,或將糖尿病治療引入新紀元!
中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)程新研究組聯合海軍軍醫大學上海長征醫院殷浩團隊,采用了一種開創性的策略,
從一名2型糖尿病患者體內提取外周血單個核細胞,將其體外培養為內胚層幹細胞並誘導分化成胰島組織,再將這些組織移植回患者體內
。
這位59歲的患者有25年糖尿病史,自體胰島組織移植治療後,第11周時已完全停用外源胰島素,血糖得到有效控制,且移植物耐受性良好
。
這是世界首個自體再生胰島移植治愈嚴重2型糖尿病的病例
。這一成就不僅彰顯了利用幹細胞技術治療糖尿病的巨大潛力,也為那些長期依賴胰島素的糖尿病患者提供了一種全新的、可能的替代治療方案。論文於近日發表在Cell Discovery期刊上[1]。
論文首頁截圖
糖尿病的全球負擔日益嚴重,作為一種慢性代謝病,還可能引起涉及多個器官系統的並行癥。2型糖尿病(T2D)是最常見的形式,初期通常由周圍組織對胰島素的抵抗開始,隨後是胰島β細胞質素的減少或功能退化,導致對外源胰島素的依賴,超過30%的2型糖尿病患者最終需要外源胰島素治療。
胰島移植是治療嚴重依賴胰島素的糖尿病的有效方法
,然而合適的供體器官極度短缺限制了這一治療方法的普及。因此科研界致力於開發可行的替代方案,以減少對捐贈器官的依賴。
於是,中國科學院生物化學與細胞生物學研究所聯合上海長征醫院啟動了一項初步試驗,
旨在
探索自體再生胰島移植的治療潛力
。
自體再生胰島移植治療的原理,是將患者體內提取的細胞進行分離,在特定培養條件下將其轉化為具有分化潛能的幹細胞,誘導分化為胰島組織,最後移植給患者。如此不僅可以填上供體不足的缺口,自體移植還能降低免疫排斥風險,不涉及倫理問題。
而此次自體再生胰島移植的重大亮點,在於
培養得到的幹細胞有些獨到之處
。
十幾年前,
程新團隊建立了世界上首個胚層特異性幹細胞系——內胚層祖細胞(EP cells)及其改良型內胚層幹細胞(EnSCs)
。EnSCs由多能幹細胞(PSCs)衍生,能夠分化成內胚層衍生的多種細胞類別,如肝細胞,其特點是具有非致瘤性[2-4]。
在多種小鼠或食蟹猴糖尿病模型實驗中,科研人員對EnSCs分化得到的胰島組織(E-islets)進行自體移植,評估了E-islets的體記憶體活、成瘤風險、體內功能及免疫原性,為臨床轉化做好了鋪墊。

研究設計和動物實驗結果
此次臨床試驗的參與者,是一名飽受疾病困擾長達25年的2型糖尿病患者,患有終末期糖尿病腎病,於2017年6月接受過腎移植,自2019年11月起血糖控制不佳。於2021年7月同意在上海長征醫院接受自體再生胰島移植治療。
科研團隊
提取、分離患者來源的外周血單個核細胞,體外培養為EnSCs,並以EnSCs作為種子培育出E-islets,將120萬胰島當量(IEQs)的自體E-islets透過經皮肝門靜脈介入的方式輸註到患者的肝臟中
。
治療後,
患者對外源胰島素需求逐漸減少,至第11周完全停用
。口服抗糖尿病藥物(阿卡波糖和二甲雙胍)分別在第48周和第56周停用。
患者的血糖控制顯著改善
,第32周時患者MAGE(血糖波動平均振幅)從5.50 mmol/L降至1.60 mmol/L,TITR( 嚴格的範圍內時間)從56.7%提高到99%。餐前和餐後的血糖濃度顯著降低,糖化血紅蛋白(HbA1c)從6.6%可下降至4.6%(113周時)。
與術前相比,
患者術後空腹C肽水平增加3倍
,說明移植的自體E-islets能夠在體內成活並有效地發揮功能,產生胰島素。
術後隨訪116周內沒有發生低血糖或嚴重高血糖事件,移植物沒有觀察到致瘤性
。僅在術後4-8周內出現可透過藥物緩解的暫時性腹脹和食欲減退,以及可恢復的、微小的體重減輕(80公斤降至76公斤)。
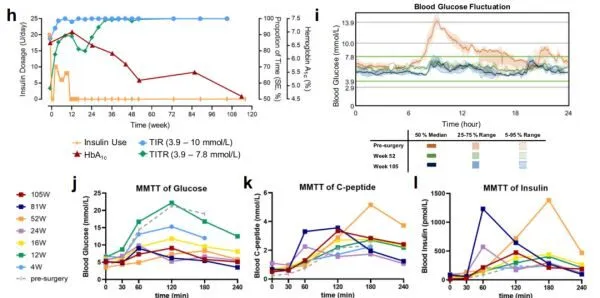
患者治療後的胰島功能改善,血糖水平恢復至正常
這項研究
首次報道了使用自體E-islets移植成功治愈2型糖尿病患者
,這一方法顯示出顯著的血糖控制改善,移植體可耐受、無致瘤性。同時也
提供了世界上第一個證據表明,幹細胞衍生的胰島組織可以挽救晚期2型糖尿病患者的胰島功能
。
科研團隊預計進一步研究幹細胞衍生胰島組織的藥動學內容,探索其在各類糖尿病治療中的套用並開發「通用胰島」。此外,增加試驗樣本量以及對1型糖尿病患者進行更多的臨床試驗,將有助於驗證這一治療策略的效果和安全性。
參考文獻:
[1]Wu, J., Li, T., Guo, M. et al. Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue. Cell Discov 10, 45 (2024). https://doi.org/10.1038/s41421-024-00662-3
[2]Cheng, X., Ying, L., Lu, L., Galvão, A. M., Mills, J. A., Lin, H. C., Kotton, D. N., Shen, S. S., Nostro, M. C., Choi, J. K., Weiss, M. J., French, D. L., & Gadue, P. (2012). Self-renewing endodermal progenitor lines generated from human pluripotent stem cells. Cell stem cell, 10(4), 371–384. https://doi.org/10.1016/j.stem.2012.02.024
[3]Feng, S., Wu, J., Qiu, W. L., Yang, L., Deng, X., Zhou, Y., Chen, Y., Li, X., Yu, L., Li, H., Xu, Z. R., Xiao, Y., Ren, X., Zhang, L., Wang, C., Sun, Z., Wang, J., Ding, X., Chen, Y., Gadue, P., … Cheng, X. (2020). Large-scale Generation of Functional and Transplantable Hepatocytes and Cholangiocytes from Human Endoderm Stem Cells. Cell reports, 33(10), 108455. https://doi.org/10.1016/j.celrep.2020.108455
[4]https://www.shkjdw.gov.cn/c/2024-05-07/532130.shtml
本文作者丨張艾迪











