關於停止腎臟替代治療的時機,我們知道些什麽?
河北省胸科醫院重癥醫學科 李寧
重癥行者轉譯組
acute kidney injury,AKI 急性腎損傷
renal replacement therapy,RRT 腎臟替代治療
randomised controlled trial,RCT 隨機對照試驗
sustained low efficiency dialysis,SLED 持續低效率透析
intermittent haemodialysis,IHD 間歇性血液透析
Neutrophil gelatinase- associated lipocalin,NGAL 嗜中性球明膠酶相關脂質運載蛋白
目的 急性腎損傷在重癥患者中很常見,支持治療包括使用腎臟替代療法作為器官支持。在過去的幾年中,腎臟替代治療的啟動時機一直是備受關註的話題,有幾項隨機對照研究探討了開始RRT的最佳時間。與此相反,關於停止RRT時機的證據卻很少。鑒於這種治療復雜、價格昂貴且有一定風險,我們似乎應該及時花費精力來解決這個棘手的問題。
近期發現 盡管有幾項研究報告了腎臟替代治療的成功終止,但迄今為止的所有研究都是觀察性的,大多使用了常規的生化指標以及包括尿量在內的生理參數。近年來,更多新的腎功能生物標誌物被納入研究,但到目前為止並沒有確定出最佳變量或終止閾值。
總結 目前已知有幾個變量可能在確定哪些患者可以成功撤離腎臟替代治療中發揮著作用。盡管尿量是最常用的指標,但卻很少有人接受過有力的檢查,任何可疑指標的支持證據都十分稀少。最近,一些新的生物標誌物也被納入研究,但同樣受到研究設計和異質性的限制。很明顯,我們需要進一步的研究來更好地關註多變量模型中的優選變量,以提高預測能力並成功終止治療。
引言
急性腎損傷( AKI )在危重癥中很常見,據報道其發生率高達60 %,當然這取決於AKI的定義和標準。AKI的發展與短期和長期死亡率增加均有關,其中病情嚴重到需要套用腎臟支持治療的患者死亡率高達50 %。因此,腎臟替代治療(RRT )仍然是約4 - 10 %危重癥患者的常用幹預措施,在ICU患者中更是高達23.5 %。
迄今為止,大多數研究都集中在何時啟動RRT這一棘手問題上,更是透過多個大型隨機對照試驗(RCT )以及大量的回顧性佇列和臨床研究對此進行了調查。這些研究包括審查RRT的"經典指征"(如難治性高鉀血癥和/或酸中毒)以及側重於RRT最佳啟動時機的研究。相比之下,RRT的終止相對被我們忽視,事實上,最近的一項系統評價也並未能確定出任何研究該問題的RCT。這與機械通氣的撤機過程形成了鮮明對比,例如,在撤機過程中,有多個基於RCT的指南和已發表的協定,以幫助臨床醫生就撤出這種形式的器官支持做出決策。
相關證據表明,嘗試停止RRT的失敗與較差的臨床結果相關,包括ICU住院時間延長和死亡率增加。然而,目前尚不清楚撤機失敗是否代表著整體臨床情況更差——即疾病的嚴重程度,而不是與RRT的過早停止直接相關。結合證據表明,RRT治療的非必要延長可能損害腎臟功能恢復,特別是當對治療產生不利影響時,因此RRT的成功撤離似乎是一個與啟動RRT同樣值得關註的領域。目前,減少RRT治療劑量、改變治療模式甚至完全停止都是基於一系列生化參數(血清尿素、肌酐、肌酐清除率)、患者特征(如血流動力學穩定性、液體平衡、電解質紊亂和臨床決策)以及管理工作(如管路凝血、人員可用性和管路並行癥)的決定。
有效停止的定義
簡單來說,這意味著脫離器官支持——不再需要進一步的體外腎臟支持,但目前尚無公認的RRT有效停止的定義。KDIGO指南建議在「不再需要RRT的情況下」停止RRT ——要麽是因為固有腎功能已經恢復到足以滿足患者需求的程度,要麽是因為RRT不再符合護理的目標。這也符合機械通氣撤機的原則,即腎損傷的根本原因已經解決,支持治療可以撤離並最終使患者解放出來。由於缺乏共識,已發表的研究對成功停止RRT的定義存在顯著差異。大多數研究將其定義為患者未接受進一步RRT的特定時期,但這一"無RRT期"的確切時間跨度在為期3 ~ 60天的研究中存在顯著差異,這使得比較工作變得困難。
最近,關於RRT時機的研究也包括了對停止治療的指導。例如,在AKIKI試驗中,根據預定義的尿量標準或在利尿足以使血肌酐濃度自發下降的情況下,可以考慮停止RRT。在STARRT AKI試驗中,RRT一旦啟動,將持續進行,除非遇到下列情況之一:①死亡;②患者的護理目標發生改變的情況下撤銷生命支持幹預措施;③臨床醫生判斷患者腎功能恢復無需繼續RRT。如果停用RRT一段時間後再次出現腎功能不全,則由治療醫師酌情重新啟動RRT。
模式改變
CRRT的撤機過程可能是一個逐步過渡到完全停止RRT的過程,這可能包括減少處方劑量、過渡到混合模式(如持續低效率透析或使用間歇性血液透析)。這種從連續性治療到間歇性治療的過渡並沒有顯示出連續性腎臟替代治療( CRRT )和混合模式在死亡率、血流動力學穩定性、溶質清除或透析依賴方面的差異,因此它是一種可行的從CRRT中離線的實用方法。
成功停止腎臟替代治療的預測因素
一些探討成功停止RRT預測因素的研究在確定停止閾值的生化和生理值方面再次表現出顯著的差異性。此外,這些變量的測量時機(即RRT停止前或停止後)往往沒有統一要求。其中涵蓋了尿量、傳統生物標誌物(如血清肌酐)、更新穎的指標和多變量預測模型等。
(1) 尿量
近年來,作為AKI分級的標準,尿量也常被臨床醫生認為是在ICU環境下成功停用或脫離RRT的最重要的預測因素。2013年一項關於英國重癥監護病房AKI管理的當代實踐調查顯示,停止RRT最常見的原因是尿量增加( 74 % )、pH值正常化( 70 % )和容量狀態目標得到滿足( 55 % )。有趣的是,39 %的患者也使用了血清尿素和肌酐的正常化作為撤機指標。尿量仍是迄今為止關於預測RRT成功終止的變量中被研究得最多的。然而,相關研究中預測可能成功停止RRT治療的尿量差異十分顯著(範圍從191 ml / 24 h到超過1700 ml / 24 h),這使得研究之間的可推廣性和比較變得困難。Best Kidney研究納入了529例患者的數據,其發現自發尿量達436 ml/天和使用利尿劑後2330 ml/天的尿量對成功撤機具有最高的敏感性、特異性和陽性預測值( 80.9 %和87.9 %)。而另有研究認為尿量增加100ml/天是成功預測因素。實際上,這一標準也被用於關於RRT啟動策略的AKIKI試驗——①如果自發尿量≥500 ml/24 h,則考慮停止RRT;②對於需接受利尿劑治療的患者,其自主排尿量> 1 000 ml/24 h或使用利尿劑情況下> 2000 ml/24 h,建議停用RRT;③在試驗期間,如果利尿足以使血清肌酐濃度自發下降,則必須停止腎臟替代治療。如果利尿不足以導致肌酐水平自發下降,或在沒有利尿治療的情況下,尿量每24小時低於1000毫升(或接受利尿治療的患者每24小時低於2000毫升),則恢復RRT。同樣,在RRT時機的ELAIN研究中,腎臟恢復定義為在沒有利尿劑治療的情況下尿量>400 ml / 24 h,而在使用利尿劑治療的情況下尿量為>2100 ml / 24 h。
然而到目前為止,用來指導停止RRT的尿量或產生率還沒有統一標準。關於尿液排出的時間,不管是停止前還是停止後的一小時內的尿量,對於預測成功都沒有體現出更高的價值。一項納入86例患者的回顧性研究中有78 %的患者成功撤機,研究指出停止RRT後的6小時尿量是最成功的預測因素,當尿量<0.3 ml/kg/h時,超過70 %的患者撤機失敗。考慮到這反映了無法排出足夠的溶質負荷,這些發現並不令人意外,也符合尿量作為最廣泛研究的變量的優勢。如前所述,利尿劑的使用和反應也被考慮在內。在預測AKI方面,呋塞米的腎小管反應性已經透過呋塞米負荷試驗進行了廣泛的評估。然而,利尿劑在停用RRT中的作用尚不清楚。有趣的是,本研究建立了多變量模型,確定了CRRT撤機成功的危險因素是性別和停止CRRT後6 h尿量。在接受呋塞米治療的患者中,停止治療後6 h尿量預測CRRT成功撤機的受試者工作曲線下面積( AUC-ROC )為0.94 ( 0.88 ~ 1.0 ),在腎小管功能未恢復的患者中為0.85 ( 0.72 ~ 0.99 )。然而,來自BEST腎臟研究的數據發現,尿量對成功停止RRT的預測能力受到包括利尿劑的負面影響。這似乎表明,增加利尿在RRT停止時可能作為一種管理液體正平衡和液體超負荷的方法,降低了RRT的再啟動率。然而,一項探討RRT後給予呋塞米的RCT研究並未顯示出對肌酐清除率高於30 ml/min或肌酐清除率低於30 ml/min且血肌酐水平穩定至少3天的AKI恢復的顯著影響。與安慰劑相比,盡管呋塞米的使用並沒有改善腎功能,但那些尿生成率顯著升高的患者並不需要再繼續進行腎臟替代治療。
(2) 傳統生物標誌物
盡管所使用的血肌酐值之間也存在顯著的異質性,但在個別研究和多變量模型中,血肌酐已被確定為有助於預測RRT離線的因素。血肌酐傾向於與一系列其他臨床和生化值結合使用,以幫助有關RRT的決策。例如,在ICU患者中,每日24 h尿肌酐排泄量可預測RRT的撤機——當尿肌酐> 5.2 mmol/24 h時,受試者曲線下面積為0.76。值得註意的是,利尿劑的使用並不影響結果。在進一步的前瞻性研究中發現,2 h肌酐清除率可用於指導CRRT的停止,且優於血肌酐值或尿量。同樣,在ATN試驗中,也使用了2 h肌酐清除率值來決定是否停止RRT。在因AKI接受間歇性血液透析( IHD )的患者中,尿量和尿尿素濃度也被發現可以預測撤機成功。IHD撤機的最佳診斷閾值為尿量>8.5 ml/kg/24 h,尿尿素濃度>148mmol/L,每日尿素排泄量>1.35 mmol / kg / 24 h。每日尿尿素排泄量的AUROC ( 0.96 )大於尿量的AUROC ( 0.86 )或尿尿素濃度的AUROC ( 0.83 ) ( P < 0.001)。
估算的腎小球濾過率是最常用的腎功能指標,但其在RRT停止決策中的價值尚不清楚。eGFR計算公式的準確性取決於穩態血清肌酐( SCr )濃度,但這在RRT停止後幾乎是不可能實作的。SCr的一個潛在套用是透過使用動態eGFR,即一種在血清肌酐變化的情況下估計腎功能的措施,透過在不同時間點兩次測量SCr計算的肌酐清除率,從理論上反映腎功能的動態變化。有2項小型的回顧性研究顯示了良好的區分度,AUROC為0.87。值得註意的是,在ICU患者中,如果不直接測量,通常會出現肌肉消耗導致肌酐值下降,高估腎功能的情況。
(3) 新型標誌物
與腎損傷相關的新型生物標誌物也被用於預測腎臟恢復和轉歸。一些研究致力於使用這些生物標誌物來區分短暫性和持續性AKI以及腎臟功能恢復,如果這些生物標誌物的初始水平較低,或者濃度下降,那麽腎臟恢復的可能性更大。這些生物標誌物也是用於預測成功停止RRT或在RRT停止之前證明腎臟恢復的證據的焦點。嗜中性球明膠酶相關脂質運載蛋白( NGAL )在遠端腎元產生,在腎損傷時其合成上調,因此被認為是預測和辨識AKI的生物標誌物,也是需要行RRT治療的預測因子。保守治療AKI時NGAL的降低可作為AKI恢復的良好預測指標。事實上,多位學者已經進行了關於NGAL對預測停用RRT時機相關的研究。
Chen等人的研究表明,停止RRT治療時血清NAGL水平403ng /ml預測成功撤機的AUROC值為0.81,然而其他研究認為血漿NT-proBNP,(而不是血漿NGAL)是撤機相關預測因素。各項研究(尤其是綜合性研究)往往沒有報告使用的參考標準和閾值,因此使用NGAL作為預測因素的研究之間往往很難進行比較。也有研究表明,血清NGAL值的連續下降,而並非一個特定的閾值,也與預測腎臟恢復和成功停止RRT的能力有關。最近的一項多中心研究中,NGAL和白介素- 6 在嚴重AKI患者CRRT治療中的套用價值得到了驗證。研究共納入133名患者,其中存活組105名。死亡組患者RRT開始時尿NGAL和血漿IL - 6水平均顯著高於存活組,但RRT停止時尿NGAL水平顯著低於治療成功組(定義為7 d時脫離RRT ),血漿IL - 6水平在兩組間差異無統計學意義。
胱抑素C 是腎功能的可靠生物標誌物,在估算腎小球濾過率方面顯示出替代肌酐的前景。胱抑素C是中等大小的分子( 13.3 k Da ),在近端腎小管中完全分解代謝,不被重吸收回血液,不受性別、年齡、種族、蛋白質攝入量或肌肉量的影響,當GFR相應下降時,胱抑素C升高,在AKI的早期檢測中具有重要的套用前景。同樣地,在已報道的研究中,使用的時間和閾值都存在顯著的異質性,範圍波動於從撤離CRRT時的1.85 mg /l到入住ICU時的2.98mg/l不等。一些學者提出將血清胱抑素C作為CVVH過程中殘余腎功能的標誌物。然而,這一發現受到了質疑,即基於不同模式胱抑素可以在啟動RRT後顯著下降,表明有顯著的體外清除。
前腦啡肽A 119- 159(penKid)已被作為研究腎功能的生物標誌物,在AKI患者中具有重要套用。即使在不穩定的環境中,其也可以反映即時腎小球濾過率,且不受系統危重癥、炎癥、年齡或性別的影響。在一項ELAIN試驗的事後分析中,RRT開始前較低的penKid水平( 89pmol / l)與早期成功脫離RRT有關。然而,該分子的確切藥代動力學和生物學調控在很大程度上仍然是未知的。
(4) 危險評分
為了預測患者如何成功撤離RRT治療,一些研究采用了多變量分析。在一項單中心研究中,共有1158例患者成功撤機——定義為撤機後7天內不需要RRT。符合成功撤機標準的患者在撤機前一天( D-1 ) UO更大,多因素分析顯示D-1尿量300 ml、平均動脈壓50 ~ 78 mm Hg、血鉀< 4.1mmol/l、BUN <35mg/dl ( 12.5 mmol / l )是CRRT成功撤機的預測因素。使用這四個變量開發評分系統時,其AUROC為0.731。在另一個單中心研究中,納入1135例需要CRRT的患者,成功撤機被定義為在撤機後72 h內未接受任何RRT治療並存活至出院。建立多變量logistic回歸模型並進行內部驗證,獨立預測因素包括撤機前12 h內平均每小時尿量、撤機前24 h內平均血肌酐值、入ICU至撤機前累積液體平衡量、撤機前CRRT持續時間和撤機前24 h內血管活性藥物需要量。該模型在驗證集中表現出良好的區分度( AUROC分別為0.76和0.78;陽性預測值分別為36 %和48 %;陰性預測值分別為92 %和94 % )和校準度。
當前的建議
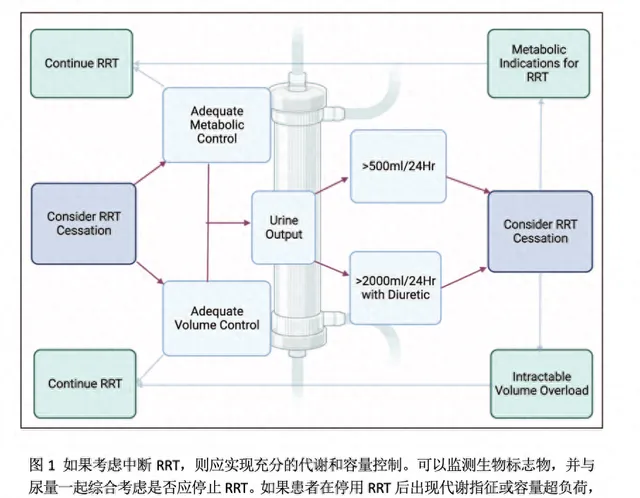
目前尚缺乏足夠的證據來提出關於停止RRT的建議。專家們已經提出了幾種成功撤機的預測因子,但由於所使用的標誌物及參考值和時間的異質性使得各項研究難以進行相互比較。與單獨的個體因素相比,綜合評分可能會更好地預測RRT的成功撤機。圖1展示了一種比較貼合臨床實際的撤機路徑。在患者血流動力學和代謝得以改善且實作理想的容量平衡的情況下,可以考慮停止RRT治療,其中尿量被認為是合適的預測指標。目前文獻建議,若患者停用利尿劑24 h內尿量≥500 ml或予利尿劑後≥2L/24h,方可考慮撤機。未來關於新型生物標誌物研究的數據可能會提高尿量的單獨預測能力。在考慮最佳的撤機和停止時機時需要考慮的其他因素包括開始治療的根本原因:如果啟動RRT是為了控制液體量、電解質紊亂或急性尿毒癥的治療,那麽在撤機前必須充分控制這些變量,並評估呼吸和心血管血流動力學,否則很難成功撤機。急性RRT如果用於治療中毒,則撤機關鍵將取決於毒素的清除。在一項回顧性觀察性研究中顯示,在有清除毒素相關指征的患者中,RRT的撤機成功率為100 %。
結論
迄今為止,尚無多中心隨機對照研究探討成功撤機的潛在預測因素。一些觀察性研究表明,當患者自發尿量> 400 ml/24h且肌酐清除率為15~20 ml/min,或當尿量> 30 ml/h且24h尿肌酐排泄量> 5.2mmol/L時,可以嘗試停止RRT。然而,最近的一項系統評價認為,目前文獻的異質性較大,以至於無法得出最佳撤機閾值的建議。由於目前各項研究的異質性很大,未來需要制定一個含有記錄的RRT自由時間框架,以使進一步的研究工作順利進行,並讓專家學者對成功中止腎臟替代治療有更明確的定義。停止RRT的決定可能需要個體化,並考慮到行RRT的根本原因、患者目前的臨床狀態以及納入臨床和生化指標,未來我們還需開發並使用復合模型對此進行預測。











