2024年6月13日,復旦大學基礎醫學院團隊聯合復旦大學附屬中山醫院團隊,合作在【科學】(Science)雜誌上線上發表了關於青蒿素研究的最新成果——【青蒿素類衍生物可透過增強LONP1-CYP11A1互作治療多囊卵巢症候群】(ArtemisininsamelioratepolycysticovariansyndromebymediatingLONP1-CYP11A1interaction),研究團隊發現青蒿素類衍生物能夠顯著改善多囊卵巢症候群的疾病表型。
站在巨人的肩膀上
多囊卵巢症候群(polycysticovarysyndrome,PCOS)是最常見的生殖內分泌紊亂疾病之一,也是育齡期女性不孕的罪魁禍首,全球發病率約為10%-13%。
根據2003年鹿特丹釋出的診斷標準,滿足以下三種特征的其中兩項,即可確診為PCOS:一是不排卵或偶發性排卵,即無月經或月經周期紊亂;二是高雄激素血癥或高雄激素的臨床表現;三是卵巢呈現多囊樣改變。其中雄激素升高是最典型的癥狀之一,也是導致患者卵泡發育受損、排卵異常的直接誘因,降低PCOS患者的雄激素水平是目前治療PCOS的主要方式。
此外,PCOS患者往往伴有肥胖、胰島素抵抗及糖尿病代謝異常,隨著疾病的發展,還會引起心腦血管疾病、生殖系統腫瘤以及精神性障礙等疾病,對女性生殖生育和生命健康帶來了嚴重威脅。
然而,學界尚未理清PCOS發病誘導機制,臨床上只能對癥下藥,多使用聯合口服避孕藥以降低高雄激素血癥,但並不能改善不孕癥以及多囊卵巢的形態。總而言之,治療效果並不理想。
青蒿素是來源於黃花蒿的倍半萜內酯化合物,由於其療效穩定且副作用小,臨床上一直將其作為一線抗瘧疾藥物使用。瘧疾是一種經按蚊叮咬而感染瘧原蟲所引起的蟲媒傳染病,而PCOS是誘因機制尚不明確的生殖內分泌紊亂疾病,乍一看,瘧疾和PCOS兩者是八竿子打不著的關系,研究人員是如何發揮奇思妙想,將青蒿素與PCOS聯系在一起的呢?
「這主要得益於站在巨人的肩膀上。」該項研究的第一作者復旦大學基礎醫學院副教授劉洋告訴【返樸】。大概從2016年開始萌生了啟動這項研究的想法,彼時他正在復旦大學讀博後,掛靠在復旦大學附屬婦產科醫院,研究脂肪細胞的發育及代謝調控相關方向。在個人研究領域與臨床常見女性生殖疾病之間找到結合點進而解決臨床問題,是劉洋的初心所在。
劉洋的博士生導師——湯其群教授,一直深耕於脂肪細胞的研究。學界將脂肪組織分為三種類別,白色脂肪負責儲存能量,棕色和米色脂肪可以將營養物質代謝產生的能量轉化成熱能,用於維持體溫。人體內經典的棕色脂肪只出現在嬰幼兒時期,而米色脂肪主要分布於成年人體內,棕色脂肪的啟用和白色脂肪的米色化,可以促進機體能量消耗,一直被視為抵抗肥胖的有效策略。由此,如何啟用白色脂肪的米色化進而改善代謝,成為領域內的前沿問題。
2015年,屠呦呦教授獲得諾貝爾生理學或醫學獎,青蒿素一時間成為學界研究的香餑餑。2016年,湯其群教授團隊在CellResearch發表論文,透過系統篩選了促進白色脂肪米色化的小分子化合物,發現青蒿素類衍生物——青蒿素甲醚(ATM)能夠促進白色脂肪米色化,同時增強棕色脂肪的功能,對肥胖誘導的代謝症候群發揮了很好的預防和治療作用。
同年,PNAS期刊上發表了棕色脂肪移植能夠治療多囊卵巢症候群的重要工作,發現透過在PCOS模型大鼠體內移植外源性棕色脂肪組織(BAT)之後,內源性BAT被顯著啟用,胰島素抵抗明顯改善,規律性排卵恢復,受孕率提高。需要補充說明的是,此前已有研究表明PCOS患者體內棕色脂肪功能異常,進而出現胰島素抵抗等代謝紊亂癥狀。換句話說,棕色脂肪組織對PCOS治療舉足輕重。
這兩篇文章給研究團隊指引了一個方向,青蒿素是否能夠影響PCOS的發生發展呢?
抽絲剝繭,乘勝追擊
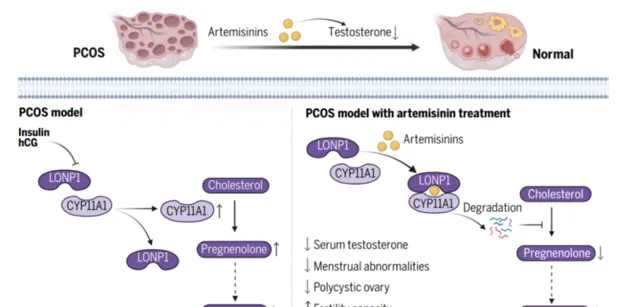
青蒿素類衍生物抑制PCOS發生的分子機制丨圖源:論文
為了研究青蒿素對PCOS是否有治療作用,研究團隊采用了外源雄激素——去氫表雄酮(DHEA)構建了PCOS樣小鼠及大鼠模型,同時團隊也采用了胰島素和人絨毛膜促性腺激素hCG構建了另一種PCOS樣大鼠模型,並使用青蒿素類衍生物蒿甲醚(ATM)處理上述模型。
實驗結果讓研究團隊非常興奮,無論是腹腔註射還是口服,ATM都能夠顯著抑制血清雄激素水平,改善PCOS樣動物模型的發情周期,降低卵巢中囊狀卵泡的數量,並且能夠提高PCOS樣大鼠的生育能力。
那麽,蒿甲醚是透過何種機制降低雄激素水平的呢?團隊帶著這些問題進一步研究。
下丘腦-垂體-卵巢軸在類固醇激素生成中發揮著重要的神經內分泌作用,卵泡刺激素(FSH)和黃體生成素(LH)是控制類固醇激素合成的上遊激素。以此為切入點,研究團隊探究了ATM是否直接參與控制雄激素合成的上遊激素。然而在PCOS樣模型中,無論是腹腔給藥還是口服給藥,ATM對FSH和LH均無影響,這表明ATM不是透過改變促性腺激素的生成進而調控雄激素。
團隊進一步假設ATM可能直接透過靶向卵巢來調節睪酮水平。為了驗證這一想法,研究團隊測定了卵巢卵泡膜間質細胞上清液中的類固醇激素。實驗表明,青蒿素類衍生物抑制了卵巢卵泡膜間質細胞的類固醇生成過程和隨後的雄激素合成。為了進一步探究青蒿素衍生物誘導雄激素合成減少的細胞途徑,團隊對ATM處理前後分離得到的卵泡膜間質細胞進行了基於質譜的相對定量蛋白質組學分析,發現CYP11A1是ATM誘導下調最顯著的蛋白。CYP11A1能夠催化膽固醇轉化為孕烯醇酮,是雄性激素合成的限速酶。為了驗證蛋白質組學數據,研究團隊檢測了小鼠和大鼠卵泡膜間質細胞中類固醇激素合成酶的表達,結果發現青蒿素類衍生物能夠劑量依賴性地下調CYP11A1蛋白。而在CYP11A1缺失的細胞中,青蒿素類衍生物無法進一步抑制雄激素合成,表明其透過下調CYP11A1蛋白進而抑制雄激素合成。
青蒿素衍生物對CYP11A1的調控機制又是如何呢?研究團隊使用了免疫共沈澱結合質譜技術(IP-MS)鑒定了ATM處理下CYP11A1的相互作用蛋白,基於IP-MS數據發現了青蒿素類衍生物能夠促進LONP1與CYP11A1蛋白相互作用。LONP1是AAA+的線粒體蛋白酶,透過利用ATP水解來降解錯誤折疊或氧化的蛋白質,在線粒體中蛋白質質素控制中至關重要。研究團隊發現LONP1能夠響應青蒿素類衍生物進而降解CYP11A1,從而抑制卵巢雄激素的合成。
推廣大規模臨床實驗
在嚙齒類動物上的實驗揭示了青蒿素衍生物具有治療PCOS癥狀的功效,隨後研究團隊招募了19名PCOS患者,開展臨床研究。參與受試的患者口服雙氫青蒿素(40mg,每日3次)持續治療12周。
實驗前,所有患者在均有高雄激素血癥、月經稀發或閉經、多囊卵巢表現。實驗後,所有參與者均未觀察到任何副作用。雙氫青蒿素治療顯著降低了PCOS患者的血清睪酮水平。抗苗勒氏管激素(anti-Müllerianhormone,AMH)主要由卵巢中竇前卵泡和小竇卵泡的顆顆粒球產生,PCOS患者AMH通常較高,而雙氫青蒿素處理顯著降低了血清AMH。此外,12名PCOS患者在治療後恢復了規律的月經周期。總之,雙氫青蒿素有效地改善了高雄激素血癥,改善了多囊卵巢形態,並有助於PCOS患者月經的正常化。
Science同期發表了瑞典卡羅林斯卡學院ElisabetStener-Victorin教授題為「Remedyhopeforpolycysticovarysyndrome」的專評,認為該研究為PCOS治療提供了新的希望。
「雖然使用外源雄激素造模是業內慣用的操作辦法,但這些模型都不能完全復制女性PCOS的復雜情況。本研究使用了圍青春期DHEA模型,可以使PCOS樣小鼠表現出血清睪酮水平升高,發情周期不規律和多囊卵巢形態。然而,該模型也表現出包括高泌乳素血癥在內的其他內分泌疾病,因此它不能完全反映女性PCOS的特征。」盡管團隊頂刊上岸,劉洋心中對研究的局限仍然「耿耿於懷」,發展更好地反映人體PCOS發病的動物模型也是領域內亟待解決的問題。
「團隊目前正在進一步最佳化雙氫青蒿素的使用劑量和用藥時間,後續計劃開展更大規模的臨床研究。」劉洋表示,「在改善PCOS女性臨床癥狀的基礎上,團隊未來也將進一步關註PCOS患者的生育能力,以期為育齡期女性解決生育難題提供解決辦法。」
參考文獻
[1]https://www.eurekalert.org/news-releases/1047601











