這次組會,小崔醫生介紹了這篇剛發表在Hypertension雜誌上的綜述「Kidney Intrinsic Mechanisms as Novel Targets in Renovascular Hypertension」。

只看簡略版
腎動脈阻塞引起血壓升高的認識已近百年。目前,由於腎動脈狹窄引起的慢性腎血管病(renovascular disease,RVD)被認為是腎血管性高血壓和腎臟疾病的主要原因。在一些病人中,RVD不伴有明顯的腎功能不全或血壓升高,可在外周血管造影術中偶然發現。然而,在另一些患者中,RVD可能表現為與彌漫性動脈粥樣硬化相關的進展性疾病,導致腎功能喪失、腎血管性高血壓、血流動力學損害以及心血管疾病發病率和死亡率的增加。動脈粥樣硬化性RVD導致腎萎縮、炎癥和缺氧,但可能是可治療的慢性腎功能衰竭原因,因為在缺血腎出現嚴重纖維化之前,它保留了血管和腎小管再生的強大潛力。腎臟恢復能力強,需要早期診斷和治療。然而,從動物研究和隨機臨床試驗中積累的證據令人信服地證實了腎動脈血運重建在完全恢復腎功能或血壓控制方面的不足,並闡明了針對缺血腎實質的治療促進腎再生的潛力。一些潛在的治療靶點包括氧化應激、微血管疾病、炎癥、線粒體損傷和細胞衰老。本文綜述了RVD腎損害和恢復的內在機制,並介紹了治療可能性。
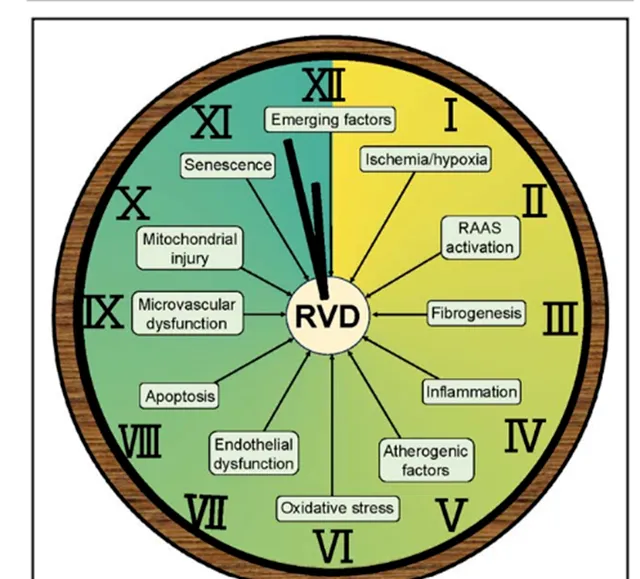
圖3 腎血管疾病(RVD)腎損傷的內在機制示意圖
在狹窄後腎臟中啟用的相互交織和按時間順序發現的致病機制的時鐘時間線。那些以黃色表示的顏色主要是在過去2到3年中提出的。RAAS:腎素-血管緊張素-醛固酮系統。
詳細版
1934年,Goldblatt首先在2腎1夾犬模型中對腎動脈收縮觸發腎素釋放和動脈壓升高進行了開創性的觀察。這些觀察結果不僅支持腎臟在血壓(BP)調節中的關鍵作用,而且隨後使得人們認識到腎血管病(RVD)是繼發性高血壓和腎損害的驅動因素。
單側RVD的腎臟損害發生在繼發於腎臟灌註減少和炎癥及促纖維化機制啟用的狹窄側腎臟,以及暴露於腎血管性高血壓的非狹窄對側腎臟中,並因動脈粥樣硬化和代謝紊亂等共病而加劇。在幾乎一半的患者中,動脈粥樣硬化性RVD可能是雙側的, 腎臟損害模式可能呈現混合的影像,這取決於狹窄的相對嚴重程度、持續時間和進展率。
血流動力學顯著的RVD最常見的誘發原因是動脈粥樣硬化病變,通常位於血管的近三分之一,其次是纖維肌性疾病。目前,RVD被認為與≈5.5%的高血壓和10%以上沒有其他可辨識主要原因的開始腎臟替代治療的患者有關。RVD可在老年患者中偶然發現,但也可作為一種潛在的、進行性的疾病,影響腎臟功能。它的存在將心血管風險放大了幾倍,而這又往往是導致這些患者死亡的原因。
傳統上,RVD患者腎功能不全和腎血管性高血壓的發生與腎灌註減少導致缺血,腎小球旁細胞釋放腎素有關。在經典的嚙齒動物2腎1夾模型中,腎素-血管緊張素-醛固酮系統(RAAS)與血管擴張劑NO和血管收縮劑前列腺素的相互作用似乎決定了腎血管性高血壓和腎損傷的發展。這些機制似乎在某種程度上再現了纖維肌發育不良,其涉及腎動脈壁的局部改變。在動脈粥樣硬化性RVD中,環境致動脈粥樣硬化因子和失調的代謝因子使這些機制復混成,並放大腎內損傷和微血管稀疏。
RAAS啟用是RVD的一個標誌,但可能是暫時的。其在維持腎血管性高血壓中的調節作用可能隨後被升高的PGF2α-異前列腺素、有效的血管收縮劑和氧化應激生物標記物所激發。在狹窄後腎臟內,慢性RAAS啟用也會導致炎癥、微血管遺失和纖維化。 事實上,阻斷血管緊張素II AT1受體比利血平+肼屈嗪+氫氯噻嗪三聯療法更有效地穩定狹窄後腎功能 。
盡管狹窄後的腎臟表現出顯著的降低代謝活性和維持灌註的能力,但嚴重狹窄超過了這一代償能力,加重了腎臟瘢痕形成和微血管重塑,可能導致腎臟損害不可逆轉。有趣的是,腎血管性高血壓和腎損傷的程度可能不一定對應,因為兩者都可能因並存的動脈粥樣硬化或原發性高血壓而加劇,且兩者都不一定與狹窄嚴重程度直接相關。此外,腎血管性高血壓可能因腎動脈血運重建而改善,逆轉腎損傷眾所周知具有挑戰性,需推動替代或輔助治療,以削弱直接導致腎損傷的潛在機制。以下各節總結了過去2至30年中為針對RVD腎損傷的基本機制和改善腎再生而采用的顯著策略。
腎臟內在機制
氧化應啟用性氧(ROS)
作為重要的第二信使,ROS在腎臟病理生理學中起著重要的作用,但當ROS過量時,它們會破壞抗氧化防禦系統,增加氧化應激。缺血損傷誘導氧化應激,有利於一氧化氮(NO)的猝滅導致微血管內皮功能障礙,因為ROS豐度啟用氧化還原依賴性炎癥和生長因子,釋放腎臟微血管結構的漸進性重塑,包括內膜增厚和管腔狹窄。這些為腎小球硬化、小管間質和血管周圍纖維化以及促進慢性RVD腎功能不全發展和進展的小管萎縮的發展鋪平了道路。因此,腎臟中ROS的豐度開始較早,並積極參與RVD的病理生理過程。
RVD的消退可降低氧化應激,改善抗氧化防禦,增加NO的生物利用度,改善血管功能和高血壓控制,支持多步驟病理生理級聯。因此,將ROS作為單一或協同幹預措施作為RVD的邏輯策略,但在實驗和臨床環境中顯示出不同的結果。ROS的主要來源是菸鹼醯胺腺嘌呤二核苷酸磷酸氧化酶和線粒體,它們普遍存在於整個腎臟。靶向ROS的特定來源可能促進針對機制新療法的發展,可抵消RVD中的腎損傷,如後續章節所述。然而,由於ROS的減少可能部份改善RVD中的腎功能不全、高血壓、微血管重構、炎癥和纖維化活動,因此它們的來源很難作為藥物靶點加以區分。因此,作為治療藥物的腎細胞/胞器特異性抗氧化化合物很少,需要進一步研究。
炎癥
腎臟炎癥在RVD的發病機制中起著重要作用,對腎臟和其他器官具有負面影響。在大鼠中,2腎1夾導致間質淋巴細胞和巨噬細胞浸潤。促炎細胞因子的表達與單核球趨化蛋白(MCP) -1、核因子 (NF )-κB和腫瘤壞死因子 (TNF )-α一樣,豬RVD功能障礙性腎臟中的MCP-1、NF-κB和TNF-α升高,與B-T細胞和巨噬細胞浸潤相關。同樣,來自嚴重RVD患者的腎活檢和腎切除標本顯示巨噬細胞浸潤和纖維化。
此外,狹窄豬和人腎臟的腎靜脈樣本顯示炎性細胞因子水平升高,預示急性腎損傷和腎功能受損,並與嗜中性球明膠酶相關脂質運載蛋白水平相關,反映腎臟和全身炎癥和缺血。全身C-反應蛋白和外周白細胞水平也升高,並與更高的冠心病患病率和死亡率相關。在動脈粥樣硬化性RVD豬中,恢復腎動脈通暢性未能減輕腎臟炎癥或改善腎功能,促炎細胞因子釋放與腎功能恢復呈負相關,強調炎癥在RVD中的主導作用。 同樣,在RVD患者中,恢復動脈血流並不能逆轉組織炎癥和損傷標誌物或改善腎功能,這可能部份解釋了腎支架置入術的有限臨床益處。
事實上,抗炎幹預似乎在減少實驗性RVD腎損害方面有效。在豬體內,MCP-1抑制劑可改善炎癥和纖維化,並提高狹窄腎的腎小球濾過率 。同樣,腎內輸註具有重要抗炎特性的間充質幹細胞(MSCs)可保持狹窄腎的結構和功能,表明RVD中抗炎幹預具有新的治療潛力。
成纖維途徑
腎瘢痕形成和組織重塑是RVD進展為腎功能不全的關鍵。進行性腎小球硬化、間質纖維化和腎小管萎縮常見於慢性缺血腎臟,並與進展為腎功能不全相關。促纖維化因子,如轉化生長因子
(TGF
)-β、組織抑制劑基質金屬蛋白酶
(TIMP
)-1,腎小球系膜細胞TGF-β和MCP-1訊號的正反饋促進ROS的產生和腎臟疾病的進展,在實驗性RVD中,其抑制可減少纖維化和萎縮。當血管重塑完成時,狹窄後腎臟中的TGF-β上調尤其明顯。其下遊介質Smad2/3在狹窄腎臟中持續增加並引發間質纖維化,而TIMP-1抑制細胞外基質降解並促進膠原沈積,和PAI-1調節血管緊張素II介導的高血壓損傷。因此,靶向這些促纖維化級聯可能會減弱RVD中的纖維化和腎功能障礙。細胞治療、線粒體保護藥物、顆粒球集落刺激因子
(G-CSF
)、MCP-1抑制劑、ACE抑制劑/血管緊張素II受體阻滯劑、三聯療法等,對改善實驗性RVD狹窄性腎纖維化有效。
動脈粥樣硬化
動脈粥樣硬化形成過程在阻塞性病變形成之前對腎損傷的發展有很大影響,因為動脈粥樣硬化性RVD比非動脈粥樣硬化性RVD更易發生進展性腎外血管疾病和腎功能不全。迴圈脂質及其氧化產物沈積在腎內,促進腎小球,腎小管間質和足細胞損傷,導致蛋白尿和腎功能喪失。系統性動脈粥樣硬化還影響血管壁和微血管重塑,因為豬RVD中共存的動脈粥樣硬化促進氧化應激、炎癥和纖維化,強調脂質異常和動脈粥樣硬化在RVD發展過程中的動態病理生理作用。動脈粥樣硬化也影響治療結果。非動脈粥樣硬化性狹窄豬腎動脈的血運重建可改善腎血流並恢復功能,但當動脈粥樣硬化疊加時,其保護作用顯著減弱。具體而言,腎血管成形術後微血管稀疏和纖維化持續存在,這可能是動脈粥樣硬化RVD中血運重建結果常常不一致的基礎。重要的是,這些數據暗示阻塞本身並不是唯一的損傷,動脈粥樣硬化過程中的早期損傷機制可能獨立於缺血而持續存在,需要改進治療策略。事實上, 基於腎內細胞或促血管生成的治療可在不解決血管阻塞的情況下改善腎臟恢復和高血壓,強調了狹窄性腎實質損害的重要性 ,並為臨床治療套用提供了新的路徑。
RAAS啟用
Goldblatt在犬2腎1夾中顯示腎灌註減少的開創性實驗為該方法在其他轉化動物平台(如大鼠和豬)中的套用奠定了基礎。這些觀察結果透過顯示RAAS阻斷可延遲高血壓的發展得到支持,血管緊張素I(AT1)受體敲除2腎1夾小鼠不能發展為高血壓。在2腎1夾模型中,對側腎臟暴露於升高的全身灌註壓力,這有利於利鈉肽分泌,阻止腎素釋放,抑制全身壓力升高,維持灌註減少並增加狹窄腎臟的腎素釋放。重要的是,Goldblatt模型作為RVD功能研究的平台,如卡托普利腎造影或腎靜脈腎素測定。
RAAS在RVD中的作用包括血管收縮和血管阻力增加、鈉瀦留和醛固酮釋放。此外,血管緊張素II有助於腎血管重塑、炎癥和纖維化以及靶器官損傷(如左心室肥厚)。因此,RAAS調節劑(如ACE抑制劑、血管緊張素II受體阻滯劑)可以透過調節腎臟損傷的多個方面實作多水平的腎臟保護。
微血管疾病
健康的腎臟微血管對腎臟的功能和營養至關重要。研究表明,
腎微血管(主要位於皮質)的功能障礙和重塑先於腎動脈的明顯阻塞性病變
,支持微血管損傷,這是RVD的一個主要病理生理特征。反過來,阻塞性病變透過加速小血管重塑和遺失而加重微血管疾病,不僅在皮質,而且在髓質。豬RVD導致狹窄腎皮質和髓質微血管密度降低(圖1),這取決於其大小,影響小葉間、入球、出球、腎小球或管周血管系統。盡管微血管可在RVD早期維持腎功能,氧化應激、炎癥和纖維化的同時進展可損害其功能、形態和修復。狹窄腎內小血管的數量和質素均受損,這反映在形態異常和迂曲度增加的不成熟和滲漏血管中,強調進行性微血管疾病是腎臟血流動力學、濾過和可能的腎小管功能的重要決定因素。實驗性RVD與血管生成因子(如血管內皮細胞和肝細胞生長因子)的腎臟表達降低相關。然而,它們的補充可預防和逆轉微血管損傷並恢復狹窄的腎功能。此外,豬RVD中的微血管遺失與腎動脈支架置入術後不良的腎功能結果相關,可透過協同靶向促血管生成幹預來改善。確實,皮質外微血管的遺失與腎動脈血運重建術後殘余腎功能相關,支持腎微血管的不可逆變化也可能損害腎治療的反應的觀點。
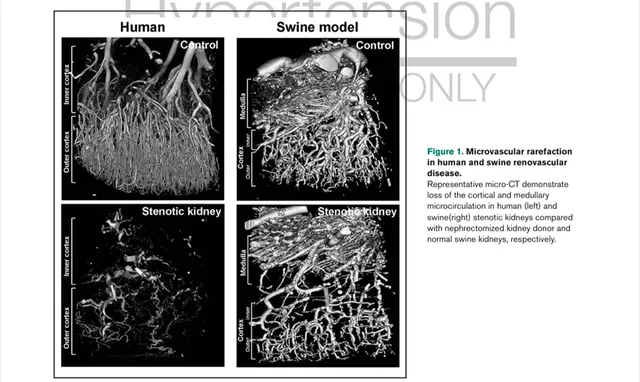
圖1 人和豬 腎血管病中的微血管稀疏
與腎切除供腎和正常豬腎相比,具有代表性的顯微CT顯示人(左)和豬(右)狹窄腎皮質和髓質微迴圈喪失
內皮功能障礙
腎血管內皮的完整性是血液與周圍組織分子交換的關鍵。健康的內皮屏障對於血管張力、通透性和液體平衡的動態平衡至關重要,同時作為血管活性化合物(如NO、前列環素、血管緊張素II或內皮素-1)的靶點和來源。內皮功能障礙的一個中心機制是ROS介導的NO猝滅。這導致血管持續收縮,這是內皮功能障礙的一個標誌,可減少腎臟灌註,損害氧氣和營養物輸送,增加 血管通透性,從而破壞血管內外空間的液體平衡。
此外,健康的內皮細胞具有抗炎特性,而內皮功能障礙促進其與迴圈炎性細胞的相互作用和趨化因子的產生。此外,促炎細胞因子可刺激內皮細胞產生ROS,從而導致進一步內皮功能障礙的惡性迴圈。此外,透過減少NO的產生和生物利用度,功能失調的內皮也可能透過上調粘附分子和破壞促凝和纖溶活性促進血栓形成活動。因此,RVD中的內皮功能障礙是腎內微血管網絡的多因素侵擾者,可能阻礙腎血流動力學和功能。
衰老
作為對損傷的反應,細胞經歷增殖停滯和復雜的分子變化,並可能形成與衰老相關的致病性分泌表型,從而傳播炎癥並破壞組織修復。雖然短期細胞衰老可能具有腎臟保護作用,但持續衰老最終會導致急性和慢性腎缺血損傷。在單側RVD小鼠中,選擇性清除p16 + 衰老(主要是上皮)細胞可減輕腎損傷;而p16 + 和p21 + 細胞的大範圍清除更為有效。在人類狹窄後腎臟中也觀察到細胞衰老,表明這一過程是保守的。在豬RVD中,細胞衰老伴隨著線粒體損傷和自愈受損。然而 ,線粒體保護和基於細胞的治療均不能完全緩解細胞衰老,支持制定特定的抗衰老策略,以修復衰老的腎臟。
細胞雕亡
程式性細胞死亡是狹窄後腎臟常見的早期發現,主要發生在升支粗段,可能是誘導腎小管重塑和萎縮的一種保護機制。 2腎-1夾大鼠夾腎透過啟用血紅素氧合酶-1系統對腎灌註減少作出反應,透過降低caspases-3和-9活性,增加抗雕亡B細胞淋巴瘤-2(BCL2)和Bcl-xl的表達,發揮抗雕亡作用。 然而,這種防禦機制在並行動脈粥樣硬化的環境中減弱,可能繼發於NF-κB活化和細胞內蛋白降解減少。
血管緊張素II透過AT1和AT2受體以及TGF-β部份誘導腎小管細胞雕亡,TGF-β促進促雕亡基因FAS細胞表面死亡受體、FAS配體和BCL2-相關-X雕亡調節因子的轉錄。 促雕亡和抗雕亡介質的不平衡表達也可能導致雕亡,腎線粒體損傷也可透過線粒體通透性轉換孔(mPTP)的開放和caspase-3和-9的啟用引起細胞雕亡。 雕亡是部份可逆的,直到纖維化開始,並導致炎癥和血管遺失,導致整體腎萎縮和永久性實質損傷。 內皮祖細胞(EPCs)招募到狹窄腎臟參與腎修復,也發生雕亡,表明其啟用損害腎修復。
保護狹窄後腎臟的策略與減少細胞雕亡相關,包括腎內給予EPCs或MSCs,靜脈輸註線粒體保護藥物或G-CSF,口服辛伐他汀,或腹腔註射ACE抑制劑。 在缺血再灌註損傷小鼠中,抗雕亡胰島素樣生長因子-1和ZVAD-fmk(半胱胺酸天門冬胺酸蛋白酶失活劑)可阻止腎細胞雕亡、炎癥和組織損傷的早期發生。 然而,需要進一步研究這些化合物在RVD中的安全性和有效性。
線粒體損傷
腎小管細胞富含線粒體,線粒體損傷和功能障礙對多種細胞功能產生不利影響。線粒體內膜AT2受體的啟用刺激線粒體ROS的產生和腎小管細胞的雕亡。缺血和氧化應激觸發mPTP開放,有利於細胞色素c釋放到胞漿中,從而導致細胞雕亡。在RVD患者中,尿線粒體損傷標誌物水平與腎動脈血運重建術後腎功能的變化相關,提示線粒體參與腎損傷。腎血運重建術可增高尿線粒體DNA,可能反映再灌註引起的腎臟線粒體損傷,進而抑制腎臟恢復。
有針對性地,在豬RVD中,保護心磷脂(一種防止mPTP形成和提高電子傳遞鏈效率的內膜磷脂)的藥物,減輕微血管稀疏和改善腎功能。重要的是,這些藥物對心肌發揮了有益的作用。強調線粒體保護在改善靶器官損害方面的潛力。在RVD患者中,在腎血運重建過程中輔助性有絲分裂保護可減輕術後缺氧,增加腎血流量,提高腎小球濾過率,定位線粒體保護是一種新的治療選擇。
缺氧
腎臟高度灌註含氧血液,可自動調節血流,直到動脈直徑減少75%。因此,全器官缺血是罕見的。 血氧水平依賴性(BOLD)-MRI評估腎內去氧血紅蛋白水平已用於評估腎氧合。 除了基礎氧合之外,功能性缺氧是基於對速尿的反應,狹窄後腎臟氧合的緩慢增加表明與腎小管轉運相關的基礎氧耗減弱。在正常條件下,接近缺氧和RVD水平的腎髓質功能可透過組織灌註相對於皮質血流的適應力維持來保護。即使在相對嚴重的條件下,腎組織也可持續處於冬眠狀態,以雕亡和小管萎縮為特征,如果腎血流恢復,這種狀態可能是可逆的。然而,BOLD-MRI顯示,在腎動脈逐漸閉塞和慢性RVD期間,豬皮質和髓質缺氧增加,與腎功能不全相關。同樣,RVD患者,盡管皮質氧合保存,但髓質深部區域出現缺氧,盡管組織氧合相對保存良好,部份原因是腎臟減少溶質過濾和重吸收的能力,從而減少耗氧量。然而, 嚴重RVD的皮質氧合減少表明潛在的不可逆腎小管損傷。
治療性幹預措施
血運重建
基於導管的介入治療(例如,血管成形術,有支架和無支架)是目前首選的介入治療方法,因為它們具有微創性,比手術恢復快;外科血管重建術(如搭橋術)僅限於經皮途徑不可行的患者。幾十年前,這種幹預措施構成了RVD的主要治療方法,其基本原理是阻塞的解決應抵消高血壓和腎功能的惡化,這一假設得到了有希望的初步報告的支持(圖2)。
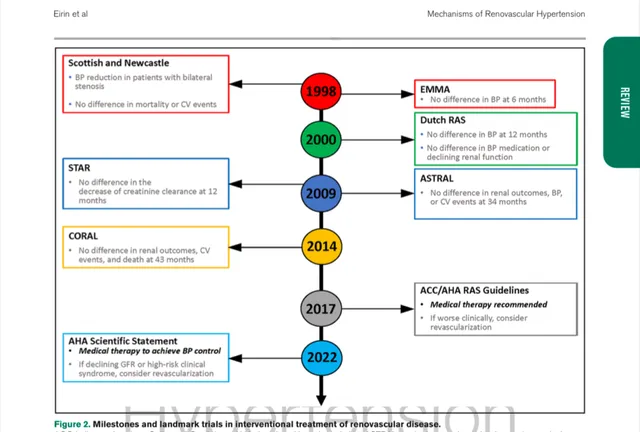
然而,2個主要的前瞻性隨機臨床試驗,腎動脈病變的血管成形術和支架置入術(ASTRAL,806例)和腎動脈粥樣硬化病變的心血管結局(CORAL,947例)清楚地表明,腎血管成形術和支架置入術與綜合藥物治療相比,對預防臨床事件沒有顯著益處。盡管納入的患者中有相當一部份僅有中度狹窄,但數據顯示,在高血壓或腎功能恢復方面,臨床獲益的證據有限的情況下,幹預增加了大量風險。然而,這些結論並不能從RVD的病理生理學上排除血管阻塞的影響。顯然, RVD是一個長期過程的結果,可以在斑塊形成過程中以及發生阻塞以外的腎臟損傷。因此,血管重建不可能完全解決狹窄帶來的病理生理過程 。對疾病過程的綜合理解支持這樣一種觀點,即腎實質損害的進展速度和嚴重程度影響介入策略的成功率,並強調需要更精細和個體化方法。例如,研究表明,早期診斷和充分的血運重建可影響血壓控制、恢復、預防或保留腎功能,並提高患者生存率。此外,對ASTRAL人群的輔助研究表明,特定根據其基礎腎功能或心血管狀況的 亞組人群患者可能受益於血管成形術。特別是, 反復發作性充血性心力衰竭和肺水腫被認為是RVD支架置入的適應癥。
在最近的一項研究中,我們發現RVD患者的腎微血管結構發生了顯著重構,有血管生成和微血管修復缺陷的跡象, 強調腎內微血管疾病是RVD的重要病理生理學組成部份。 此外,這些發現擴充套件和證實了臨床前的數據,即治療策略(例如血管生成、線粒體保護)的能力,這些治療策略以腎實質為靶點,作為支架置入術的獨立和輔助手段,被視為一種潛在的臨床方法。
傳統藥物
當血壓和腎功能得到很好的控制時,藥物治療可以有效地治療動脈粥樣硬化性RVD,並且在許多高血壓患者中並未出現腎動脈狹窄。降壓藥、他汀類藥物、阿司匹林、戒煙與心血管風險的顯著降低相關,並已納入CORAL和ASTRAL等大型隨機臨床試驗。 這些試驗的結果表明,2至5年期間最佳化藥物治療的益處與增加腎動脈血運重建後獲得的益處相當。
許多RVD患者既往有高血壓,許多可透過中度降壓治療得到很好的控制,包括ACE抑制劑和血管緊張素Ⅱ受體阻滯劑。在豬RVD中,與三聯療法相比,ARB對腎微血管具有更大的保護作用。在RVD大鼠中,盡管濾過減少,但在移除夾或停止ACE抑制劑後,腎臟結構完整性得以保留和恢復。總體而言,RVD患者對這些藥物耐受性良好,並改善 死亡率。
然而,盡管許多患者不需要血運重建,但單純藥物治療RVD通常會進展。兩個治療組的CORAL和ASTRAL試驗分別報告了16%和22%的進展率(藥物治療加或不加腎血運重建),強調密切監測接受藥物治療的RVD患者的重要性。
血壓控制應伴隨適當的血脂管理、抗血小板治療、血糖控制和生活方式改變,包括飲食、運動和戒煙。他汀類藥物減少RVD的發展和進展,可能獨立於降脂。 在豬RVD中,慢性補充辛伐他汀可減弱狹窄後腎臟微血管重構和腎臟EPC雕亡,強調其保留腎臟修復機制的能力。
新的治療方法
SGLT2 抑制劑
裏程碑式的臨床試驗揭示了SGLT2(鈉-葡萄糖共轉運體-2)抑制劑對慢性腎臟疾病患者的益處;然而,它們在RVD中的腎臟保護作用尚未確定。這將是一個合理的假設,因為它們有能力降低動脈僵硬度,並改善內皮功能、腎臟炎癥和缺氧。然而,它們假定的作用機制包括抑制管球反饋和引起入球血管收縮,這可能有利於超濾過,但可能不利於缺血腎臟。可能,它們與其他治療幹預措施(如ACE抑制素或胰高血糖素樣肽-1受體激動劑)聯合使用可能有用,但還需要更多的研究來確定SGLT2抑制劑在RVD患者中的作用。
細胞治療方法
以細胞為基礎的治療可以改善實驗性RVD的腎損害。 在豬非動脈粥樣硬化性RVD中,腎內輸註自體EPCs可恢復狹窄腎臟的血流動力學和功能。同樣,盡管持續高血壓,腎內MSCs仍能保護狹窄後腎臟,並結合支架植入改善豬RVD的腎功能。重要的是,micro-CT研究顯示,這些幹預與新血管(主要直徑小於200µm)的形成有關,可能包括入球小動脈、出球小動脈以及小葉間、管周和腎小球血管。在臨床上,動脈內輸註自體MSCs可改善RVD患者3個月後的腎氧合和血流量,顯示出治療前景。MSC衍生的細胞外囊泡也改善了實驗性RVD的腎臟結構和功能,但需要研究以確定其在人類中的療效。
觀點和結論
新出現的技術是可用的,並有潛力推動這一領域的發展。例如,單細胞測序、飛行時間流式細胞術或位點特異性尿EVs 可能有助於精確定位腎細胞損傷部位,並聚集規則間隔的短回文重復序列以編輯失調基因,而線粒體移植可能補充耗盡的能量源。人工智能技術可以將狹窄後的腎臟與其他形式的腎臟損害區分開來,並確定哪些可能受益於特定的幹預措施。因此,令人興奮的發展可能有選擇地恢復體內平衡和改善患者管理。未來的發展需要利用新興的創新,以闡明組織損傷的機制和改善患者的管理。還需要進行研究,基於 個體 患者的主要病理生理學指導 以選擇最有效的治療策略(例如,微血管遺失與炎癥)。
自RVD被確定為腎血管性高血壓的原因,雖然腎動脈血運重建術對RVD患者的益處不大,但有效的藥物可用於控制血壓。此外,研究表明,有針對性的幹預措施,以增強腎組織修復的能力,包括建立目的明確的藥物和新的療法。雖然在RVD中相互作用並經常協同作用的一組復雜的內在機制(圖3)使腎臟病理生理學具有挑戰性,但希望正在進行的研究將繼續指導RVD的基於機制的治療。
閱讀原文 2023 Kidney Intrinsic Mechanisms as Novel Targets in Renovascular Hypertension.pdf










