特殊醫學用途配方食品生產特許審查細則
第一章 總 則
第一條 本細則適用於特殊醫學用途配方食品的生產特許條件審查。細則中所稱特殊醫學用途配方食品,是指為滿足進食受限、消化吸收障礙、代謝紊亂或者特定疾病狀態人群對營養素或者膳食的特殊需要,專門加工配制而成的配方食品,包括適用於0月齡至12月齡的特殊醫學用途嬰兒配方食品和適用於1歲以上人群的特殊醫學用途配方食品。
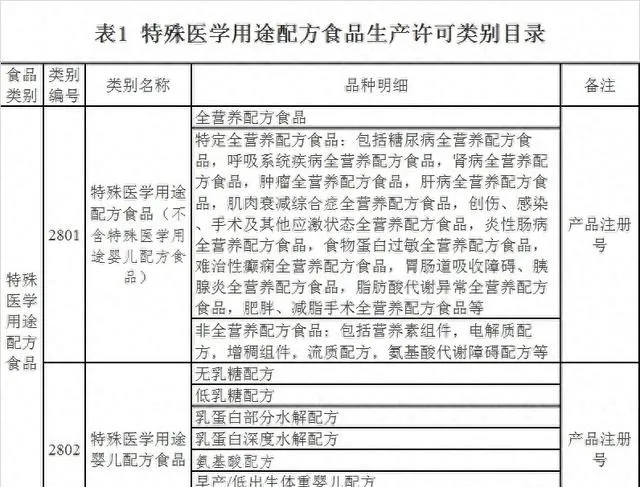
第二條 特殊醫學用途配方食品申證類別名稱分為:特殊醫學用途配方食品(不含特殊醫學用途嬰兒配方食品),類別編號2801;特殊醫學用途嬰兒配方食品,類別編號2802。特殊醫學用途配方食品生產特許食品類別、類別名稱、品種明細等見表1。
表1 特殊醫學用途配方食品生產特許類別目錄
第三條 特殊醫學用途配方食品生產企業(以下簡稱「企業」)應當按照批準註冊的產品配方、生產工藝等技術要求組織生產。僅有包裝場地、工序、器材,沒有完整生產工藝條件的,不予生產特許。
第四條 本細則中參照的檔、標準透過參照成為本細則的內容。凡是參照檔、標準,其最新版本(包括所有的修改單)適用於本細則。
第二章 生產場所
第五條 生產場所、周圍環境以及廠區的布局、道路和綠化應當符合【食品生產特許審查通則】(以下簡稱【審查通則】)的相關要求。
第六條 廠房和車間的種類、布局應當與產品特性、生產工藝和生產能力相適應,符合【審查通則】的相關要求,避免交叉汙染。生產車間通常包括原輔料預處理、稱量配料、熱處理、殺菌(滅菌)、幹燥、混合(預混料)以及包裝(灌裝)等車間。企業可以根據產品批準註冊的實際生產工藝需求適當調整車間的種類。
第七條 生產車間應當按照生產工藝和防止交叉汙染的要求劃分作業區的潔凈級別,原則上分為一般作業區、準清潔作業區和清潔作業區。不同潔凈級別的作業區域之間、濕區域與幹燥區域之間應當設定有效的分隔。原則上生產車間及各潔凈級別作業區的具體劃分見表2。
表2 特殊醫學用途配方食品生產車間及作業區劃分表
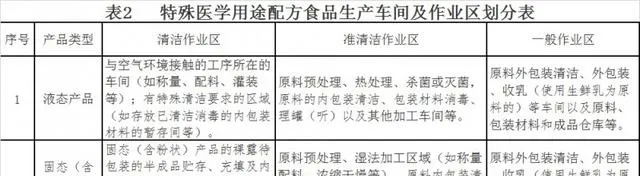
對於灌裝、封蓋後滅菌的液態產品,其灌裝、封蓋後的滅菌工序可在一般作業區進行。
其他類別產品的生產車間及作業區劃分參照表2執行。
第八條 清潔作業區應當安裝具有過濾裝置的獨立的空氣凈化系統和空氣調節設施,保持正壓,防止未凈化的空氣進入清潔作業區以及蒸汽凝結。生產粉狀產品的清潔作業區應當控制環境溫度和空氣濕度,無特殊要求時,溫度應不高於25℃,相對濕度應在65%以下。清潔作業區、準清潔作業區的空氣潔凈度應符合【食品安全國家標準 特殊醫學用途配方食品良好生產規範】(GB 29923)中相應條款的控制要求,且清潔作業區與非清潔作業區之間的壓差應大於等於10Pa。
第九條 廠房和車間建築物應保持完好,環境整潔,防止蟲害的侵入及孳生。生產車間的墻壁、地面、頂棚、門窗等應當符合【審查通則】的相關要求。車間室內的頂棚、頂角還應易於清掃,避免灰塵積聚、結露、長黴或脫落等情形發生。清潔作業區、準清潔作業區及其他食品暴露場所的頂棚若為易於藏汙納垢的結構,宜加設平滑易清掃的天花板;若為鋼筋混凝土結構,其室內頂棚應平坦無縫隙。地面應使用無毒、無味、不滲透、耐腐蝕的材料建造,其結構應易於排汙和清洗。
第十條 產塵車間(如幹燥物料或產品的取樣、稱量、混合、包裝等)應當采取適當的除塵或粉塵收集措施,防止粉塵擴散,避免交叉汙染。
第十一條 清潔作業區、準清潔作業區的對外出入口應裝設能自動關閉(如安裝自動感應器或閉門器等)的門和(或)空氣幕。原料、包裝材料、廢棄物、器材等進出清潔作業區時,應有防止交叉汙染的措施(如專用物流通道以及廢棄物通道等)。
第十二條 清潔作業區需保持幹燥,並盡量減少供排水設施和系統。如無法避免,應有防止汙染的措施。
第十三條 原料、半成品、成品倉庫應當符合【審查通則】的相關要求。接收區的布局和設施應能確保食品原料、食品添加物和包裝材料在進入倉儲區前可對外包裝進行必要的清潔。原料、半成品、成品、包裝材料等應當依據性質的不同分設貯存場所,必要時應設有具備溫度監控設施的冷藏(凍)庫。同一倉庫貯存性質不同物品時,應適當分離或分隔(如分類、分架、分區存放等),並有明顯的標識。
第三章 器材設施
第十四條 企業應當配備與生產的產品品種、數量相適應的生產器材,器材的效能和精度應能滿足生產加工的要求。用於混合的器材應能保證物料混合均勻;幹燥器材的進風應當有空氣過濾裝置,排風應當有防止空氣倒流裝置,過濾裝置應定期檢查和維護;用於生產的計量器具和關鍵儀表應定期進行校準或檢定。
第十五條 與食品直接接觸的生產器材和工器具的內壁應采用不與物料反應、不吸附物料的材料,並應光滑、平整、無死角、耐腐蝕且易於清洗。
第十六條 供排水設施應當符合【審查通則】的相關要求。使用二次供水的,應符合【二次供水設施衛生規範】(GB 17051)的規定。排水系統內及其下方不應有生產用水的供水管路。
第十七條 企業應當配備與生產需求相適應的食品、工器具和器材的清潔設施,必要時配備相應的消毒設施。使用的洗滌劑、消毒劑應當符合相關規定以及【食品安全國家標準 洗滌劑】(GB 14930.1)、【食品安全國家標準 消毒劑】(GB 14930.2)的要求。
第十八條 廢棄物存放設施應當符合【審查通則】的相關要求。盛裝廢棄物、加工副產品以及不可食用物或危險物質的容器應特別標識、構造合理且不透水,必要時容器應封閉,防止汙染食品。應在適當地點設定廢棄物臨時存放設施,並依廢棄物特性分類存放。易腐敗的廢棄物應及時清除。
第十九條 個人衛生設施應當符合【審查通則】的相關要求及下列要求:
(一)清潔作業區的入口應設定二次更衣室,二次更衣室內應設定阻攔式鞋櫃、獨立清潔作業區工作服存放櫃及消毒設施,使用前後的工作服應分開存放。更衣室對應的不同潔凈級別區域兩邊的門應防止同時被開啟,更換清潔作業區工作服的房間的空氣潔凈度應達到清潔作業區的要求。
(二)準清潔作業區及一般作業區的工作服應符合相應區域的衛生要求,並配備帽子和工作鞋;清潔作業區的工作服應為連體式或一次性工作服,並配備帽子(或頭罩)、口罩和工作鞋(或鞋罩)。
(三)人員進入生產作業區前的凈化流程一般為:
1.準清潔作業區:換鞋(穿戴鞋套或工作鞋靴消毒)→更外衣→洗手→更準清潔作業區工作服→手消毒。
2.清潔作業區:換鞋(穿戴鞋套或工作鞋靴消毒)→更準清潔作業區工作服或外衣(人員不經過準清潔區的)→洗手(人員不經過準清潔作業區的或必要時)→手消毒→更清潔作業區工作服→手消毒。
如采取其他人員凈化流程,應對凈化效果進行驗證,確保符合人員凈化要求。
第二十條 通風設施應當符合【審查通則】的相關要求。在有異味及氣體(蒸汽及有毒有害氣體)或粉塵產生而有可能汙染食品的區域,應有適當的排除、收集或控制裝置。進氣口應遠離汙染源和排氣口,並設有空氣過濾器材。
用於食品輸送或包裝、清潔食品接觸面或器材的壓縮空氣或其他惰性氣體應經過除油、除水、潔凈過濾、除菌(必要時)等處理。
第二十一條 照明設施應當符合【審查通則】的相關要求。質素監控場所工作面的混合照度不宜低於540 lx,加工場所工作面不宜低於220 lx,其他場所不宜低於110 lx,對光敏感的區域除外。
第二十二條 企業應當根據生產的需要,配備適宜的加熱、冷卻、冷凍以及用於監測溫度和控制室溫的設施。
第二十三條 企業應當具備與自行檢驗專案相適應的檢驗器材設施和試劑。檢驗室應當布局合理,檢驗器材的數量、效能、精度等應當滿足相應的檢驗需求。相關食品安全國家標準和產品註冊涉及的檢驗專案、檢驗方法修訂或變更後,應及時配備相應的檢驗器材設施和試劑。
第四章 器材布局和工藝流程
第二十四條 生產器材應當按照工藝流程有序排列,合理布局,便於清潔、消毒和維護,避免交叉汙染。
第二十五條 器材布局和工藝流程應當與批準註冊的產品配方、生產工藝等技術要求保持一致。
第二十六條 企業應當按照產品批準註冊的技術要求和GB 29923關於生產工藝特定處理步驟的要求,制定配料、稱量、熱處理、中間貯存、殺菌(商業無菌)、幹燥(粉狀產品)、冷卻、混合、內包裝(灌裝)等生產工序的工藝檔,明確關鍵控制環節、技術參數及要求。
第五章 人員管理
第二十七條 企業應當配備與所生產特殊醫學用途配方食品相適應的食品安全管理人員和食品安全專業技術人員(包括研發人員、檢驗人員等),並符合下列要求:
(一)應當設立獨立的食品安全管理機構,明確食品安全管理職責,負責按照GB 29923的要求建立、實施和持續改進生產質素管理體系。
(二)企業負責人應當組織落實食品安全管理制度,對本企業的食品安全工作全面負責。食品安全管理機構負責人應具有食品、醫藥、營養學或相關專業本科以上學歷,以及5年及以上從事食品或者藥品生產的工作經歷和管理經驗,掌握特殊醫學用途配方食品的質素安全知識,了解應承擔的法律責任和義務,且經專業理論和實踐培訓合格,可獨立行使食品安全管理職權,承擔產品出廠放行責任,確保放行的每批產品符合食品安全國家標準和相關法律法規的要求。
(三)食品安全管理人員應具有食品、醫藥、營養學或相關專業本科以上學歷,或專科以上學歷並具有3年及以上從事食品或者藥品生產的工作經歷和生產管理經驗。應經過培訓並考核合格。經考核不具備食品安全管理能力的,不得上崗。
(四)食品安全技術人員應有食品、醫藥、營養學或相關專業本科以上學歷,或專科以上學歷並具有3年及以上相關工作經歷。
從事檢測的人員應具有食品、化學或相關專業專科以上的學歷,或者具有3年及以上相關檢測工作經歷,經專業理論和實踐培訓,具備相應檢測和儀器器材操作能力,考核合格後可授權開展檢驗工作。實驗室負責人應具有食品、化學或相關專業本科以上學歷,並具有3年及以上相關技術工作經歷。每個檢驗專案應至少有2人具有獨立檢驗的能力。
專職研發人員應有食品、醫藥、營養學或相關專業本科以上學歷,掌握食品生產工藝、營養和質素安全等相關專業知識。
(五)生產管理部門負責人應具有食品、醫藥、營養學或相關專業本科以上學歷,3年及以上從事食品或者藥品生產的工作經歷和生產管理經驗;或專科以上學歷,具有5年及以上從事食品或者藥品生產的工作經歷和生產管理經驗。生產操作人員應當掌握生產工藝操作規程,可按照技術檔進行生產,可熟練操作生產器材設施。生產操作人員的數量應當與生產需求相適應。
第二十八條 人員培訓應當符合【審查通則】的相關要求。應根據崗位的不同需求制定年度培訓計劃,開展培訓工作並保存培訓記錄。當食品安全相關法律、法規、標準更新時,應及時開展培訓。
第二十九條 企業應當建立從業人員健康管理制度,明確患有國務院衛生行政部門規定的有礙食品安全疾病的或有明顯皮膚損傷未愈合的人員,不得從事接觸直接入口食品的工作。從事接觸直接入口食品工作的食品生產人員應當每年進行健康檢查,取得健康證明後方可上崗工作。
第六章 管理制度
第三十條 進貨查驗記錄制度應當符合【審查通則】的相關要求。采購進口食品原料、食品添加物時,應當查驗每批物料隨附的合格證明材料以及海關(或出入境檢驗檢疫機構)出具的準予入境的產品合格證明。進口的食品原料、食品添加物應當附有符合中國法律法規和食品安全國家標準要求的中文標簽和(或)說明書,並載明原產地以及境內代理商的名稱、地址、聯系方式等。
第三十一條 企業應當設立下列原料控制要求:
(一)建立原料供應商稽核制度。食品原料、食品添加物和食品相關產品供應商(生產企業、經銷商或進口商)的確定及變更應進行質素安全評估,並經食品安全管理機構批準後方可采購。進口食品原料、食品添加物的境外生產企業及其進口商應在海關(或出入境檢驗檢疫部門)定期公布的備案名單中。對食品原料、食品添加物和食品相關產品供應商的稽核至少應包括:供應商的資質證明檔、質素標準、產品合格證明;采購進口食品原料、食品添加物的,還應稽核進口商(含國內經銷商)的相關證明檔(如授權委托書等);如進行現場質素體系稽核的,還應包括現場質素體系稽核報告。食品安全管理機構應定期組織對蛋白質(包括蛋白水解物、胺基酸、肽類等)、脂肪(脂肪酸)、碳水化合物以及維生素、礦物質等主要營養素供應商的質素管理體系進行現場稽核。應與采購的主要食品原料、食品添加物和食品相關產品供應商簽訂質素安全協定,明確雙方所承擔的質素安全責任。
(二)建立原料采購驗收管理制度。采購的食品原料、食品添加物和食品相關產品的品種、質素標準應當符合食品安全國家標準和產品註冊時的技術要求,並經驗收合格後方可使用。直接進入幹混合工序(無後續滅菌/殺菌工藝的)的原料的微生物指標應當達到終產品標準的要求;大豆原料應徹底滅酶(或在生產過程中滅酶),保證脲酶活性為陰性。生產特殊醫學用途嬰兒配方食品所使用的食品原料和食品添加物不應含有谷蛋白,加入的澱粉應經過預糊化處理;不得使用氫化油脂、果糖和經輻照處理過的原料;生產0—6個月齡的特殊醫學用途嬰兒配方食品,應使用灰分≤1.5%的乳清粉,或灰分≤5.5%的乳清蛋白粉。
(三)建立原料貯存管理制度。食品原料、食品添加物和食品相關產品應當在規定的貯存條件下保存,避免太陽直射、雨淋以及強烈的溫度、濕度變化與撞擊等,並標明相關物料資訊和質素狀態。驗收合格的食品原料、食品添加物標識應具有唯一性,並與進貨查驗(或檢驗)資訊相對應,確保其使用情況可進行有效追溯。應定期檢查和及時清理變質或超過保質期的食品原料、食品添加物和食品相關產品;驗收不合格的食品原料、食品添加物和食品相關產品應當在指定區域與合格品分開放置並明顯標記。含有過敏原的食品原料、食品添加物應分區域或分庫貯存,明確標識,避免交叉汙染與誤用。食品添加物(包括營養強化劑)應由專人管理,專庫或專區存放,並使用專用登記冊(或倉庫管理軟件)記錄其進貨查驗和使用情況。
(四)制定領料控制要求。應當建立食品原料、食品添加物和食品相關產品領用記錄,領用時應遵照「先進先出」或「效期先出」的原則。貯存時間較長、質素安全狀況有可能發生變化的原料,應定期或在使用前抽樣確認其質素安全狀況。
(五)保存食品原料、食品添加物和食品相關產品的采購、驗收、貯存和運輸記錄。如采用電腦管理系統替代物理隔離對物料進行管控,則該方法應具有等同的安全(可控性)性,並參考GB 29923附錄A的要求提供相應的評估報告。
(六)制定生產用水控制要求。與食品直接接觸的生產用水、器材清洗用水、制冰和蒸汽用水等應符合【生活飲用水衛生標準】(GB 5749)的相關規定。生產液體產品時,與產品直接接觸的生產用水應根據產品的特點制得(如去離子法、離子交換法、反滲透法或其他適當的加工方法),以確保滿足產品質素和工藝的要求。
第三十二條 企業應當設立下列生產關鍵環節控制要求:
(一)控制生產加工的時間和溫度。物料從投料至殺菌之間的時間應控制在工藝規定的安全範圍內;應根據產品的特點制定有效殺滅微生物或抑制微生物生長繁殖的方法(如熱處理,冷凍或冷藏保存等);無菌灌裝器材與UHT滅菌器材的連線、無菌灌裝的環境應確保符合無菌灌裝要求;需要灌裝後滅菌的液態產品,從灌封到滅菌的時間應控制在工藝規程要求的時間限度內。
(二)控制空氣的潔凈度和濕度。應定期對清潔作業區、準清潔作業區的空氣潔凈度進行監測並保存監測記錄,確保其空氣潔凈度符合本細則要求。應根據產品和工藝特點,控制相應生產區域的空氣濕度,制定空氣濕度關鍵限值,以減少有害微生物的繁殖。
(三)制定微生物監控計劃。應參照【食品安全國家標準食品生產通用衛生規範】(GB 14881)附錄A的要求,結合生產工藝及相關產品標準要求,制定生產過程的微生物監控計劃。采用商業無菌操作進行最終滅菌的液態產品,應確定滅菌前產品微生物汙染水平的監控標準,並定期監控。粉狀特殊醫學用途配方食品應根據GB 29923附錄B的要求,對清潔作業區環境中沙門氏菌、阪崎腸桿菌和其他腸桿菌制定環境監控計劃,並制定發現陽性監控結果時的評估及相關批次產品的處置措施,確保放行產品符合食品安全標準的要求。
(四)制定人員衛生控制要求。進入食品生產區的人員應整理個人衛生,進入清潔作業區的人員應定期或非週期性進行體表微生物檢查。進入生產區應規範穿著相應區域的工作服,並按要求洗手、消毒;頭發應藏於工作帽內或使用發網約束。進入生產區不應配戴飾物、手表,不應化妝、染指甲、噴灑香水;不得攜帶或存放與食品生產無關的個人用品。使用衛生間、接觸可能汙染食品的物品、或從事與食品生產無關的其他活動後,再次從事接觸食品、食品工器具、食品器材等與食品生產相關的活動前應洗手消毒。清潔作業區和準清潔作業區使用的工作服和工作鞋不能在指定區域以外的地方穿著。
(五)制定原料衛生控制要求。食品原料、食品添加物和食品相關產品進入清潔作業區前應除去外包裝或對外包裝進行消毒,采取適當的物料凈化措施(如經過緩沖間、隧道殺菌、風淋室或其他衛生控制措施)。直接用於幹混合工序(無後續滅菌/殺菌工藝的)的原料的外包裝應當完整且無蟲害及其他汙染的痕跡。拆包、投料過程中應檢查直接接觸物料的包裝物有無破損,發現破損或其他異常情況,不得使用。
(六)制定稱量配料控制要求。稱量、配料過程應保證物料種類、數量與產品配方的要求一致,並由他人獨立進行覆核和記錄。采用電腦資訊系統實作稱量、配料、混合、覆核等自動化控制的,可以不采用人工覆核,但電腦資訊系統應有防錯設計並定期校驗。稱量前應當采取適當方式檢查稱量器材,確定其效能和精度符合稱量的需求。稱量前應當檢查並記錄原料的名稱、規格、生產日期(或批號)、保質期和供貨者的名稱等內容,稱量結束後應對物料名稱、規格、數量、生產日期、稱量日期等進行標識。投料前應對物料名稱、數量等資訊進行核對,並按工藝檔規定的投料順序進行投料。建立稱量、配料相關記錄,記錄、核算每批產品的投料量、產量及物料平衡情況,確保物料平衡情況符合設定的限度以及生產相關資訊的可追溯。發現物料平衡情況異常時應查明原因,采取措施,防範食品安全風險。
(七)制定生產工藝控制要求。生產過程中的生產工藝及工藝控制參數應符合產品註冊時的技術要求,並有相關生產工藝控制記錄。液態特殊醫學用途配方食品采用商業無菌操作的,應參照GB 29923附錄C的要求,制定相關生產工藝控制要求。
(八)制定產品防護管理要求。混合、溶解後的半成品應采用密閉暫存器材儲存,不得裸露存放;冷卻後的產品應采用密閉暫存器材儲存。生產粉狀產品過程中,從熱處理到幹燥前的輸送管道和器材應保持密閉,並按規定進行清潔、消毒;無後續滅菌/殺菌工藝的粉狀產品不得采用將半成品裸露在清潔作業區的作業方式(如人工篩粉、粉車晾粉等)。應制定器材故障、停電停水等特殊原因中斷生產時的產品處置辦法,保證對不符合標準的產品按不合格產品處置。當進行現場維修、維護及施工等工作時,應采取適當措施避免汙染食品。
(九)制定產品包裝控制要求。產品包裝前應再次核對即將投入使用的包裝材料的標識,確保包裝材料正確使用,並做好記錄。產品包裝過程中應當檢查有無金屬或者異物混入、是否符合包裝要求(如凈含量、密封性等),確保包裝後的產品合格。包裝材料應清潔、無毒且符合國家相關規定。正常情況下包裝材料不得重復使用,特殊情況下需重復使用的(如玻璃瓶、不銹鋼容器等),應符合產品批準註冊時的相關要求,並在使用前徹底清洗、消毒。
(十)制定產品共線生產與風險管控要求。不同品種的產品在同一條生產線上生產時,應經充分的食品安全風險分析(包括但不限於食物蛋白過敏風險),制定有效清潔措施且經有效驗證,防止交叉汙染,確保產品切換不對下一批產品產生影響,並應符合產品批準註冊時的相應要求。
(十一)建立清場管理制度。應明確所生產產品的批次定義。不同批次、不同品種的產品在同一條生產線上生產時,各生產工序在生產結束後、更換品種或批次前,應對現場進行有效清潔並保存清場記錄。清場負責人及覆核人應在記錄上簽名。
(十二)建立清潔消毒制度。應根據原料、產品和工藝的特點,選擇適合的清潔劑、消毒劑,並針對生產器材和環境制定有效的清潔消毒制度(包括清潔和消毒計劃、操作規程及監督流程),並做好相關記錄,保證生產場所、器材和設施等的清潔衛生。清潔劑、消毒劑的配制、使用方法應符合相關規定。
(十三)建立生產器材管理制度。器材使用前應進行驗證或確認,生產前應檢查器材是否處於正常狀態,出現故障應及時排除,確保各項效能滿足工藝要求。維修後的器材應進行再次驗證或確認。制定器材使用、清潔、維護和維修的操作規程,並保存相應記錄。器材台賬、說明書、檔案等應齊全、完整。
第三十三條 企業應當制定檢驗管理制度,規定原料檢驗、半成品檢驗、成品出廠檢驗的管理要求:
(一)建立原料檢驗管理制度。根據生產需求和保證質素安全的需要,制定原料檢驗(或驗收)管理制度,規定食品原料、食品添加物和食品相關產品的進貨檢驗(或驗收)標準、程式和判定準則。對無法提供合格證明檔的食品原料,應當按照食品安全標準透過自行檢驗或委托具備相應資質的食品檢驗機構進行檢驗。購入的含乳原料批批檢驗國家標準要求的專案及限制成分(如三聚氰胺)等專案。
(二)建立半成品檢驗管理制度。根據生產過程控制需求,設立監控半成品質素安全的檢驗管理制度,對半成品的質素安全情況進行監控。
(三)建立成品出廠檢驗管理制度。按照產品執行的食品安全國家標準和產品批準註冊的技術要求,對出廠成品進行逐批全專案檢驗。成品出廠檢驗應當按照食品安全國家標準和(或)有關規定進行。
生產特殊醫學用途嬰兒配方食品的,成品出廠應當自行逐批全專案檢驗,且每年至少1次對全部出廠檢驗專案的檢驗能力進行驗證。生產其他特殊醫學用途配方食品的,可以委托有資質的第三方檢驗機構進行成品出廠檢驗,委托檢驗專案所需的檢驗器材設施,企業可以不再配備。
第三十四條 企業應當設立產品貯存和運輸要求。產品的貯存和運輸應符合產品標簽所標識的貯存條件。應定期檢查庫存產品,必要時應有溫度記錄和(或)濕度記錄。經檢驗後的產品應標識其質素狀態。產品不得與有毒、有害或有異味的物品一同貯存運輸。
第三十五條 企業應當建立出廠檢驗記錄制度。食品出廠時,應當查驗出廠食品的檢驗合格證和安全狀況,記錄食品的名稱、規格、數量、生產日期或者生產批號、保質期、檢驗合格證號、銷售日期以及購貨者名稱、地址、聯系方式等資訊,保存相關記錄和憑證。
第三十六條 企業應當按照【審查通則】的相關要求建立不安全食品召回制度及不合格品管理制度:
(一)應當建立不安全食品召回制度,規定發現不安全食品時的停止生產、召回和處置不安全食品的相關要求。
(二)應當建立不合格品管理制度,對發現的食品原料、食品添加物、食品相關產品以及半成品、成品中的不合格品進行標識、貯存、管理和處置。出廠檢驗不合格的成品不得作為原料生產食品。
第三十七條 企業應當按照【審查通則】的相關要求建立食品安全自查制度和食品安全事故處置方案,定期檢查生產質素管理體系的執行情況,並向所在地縣級市場監督管理部門送出自查報告。
第三十八條 企業應當根據食品安全法律、法規、規章、標準和有關規定建立生產質素管理體系,建立且不限於下列管理制度和要求:
(一)建立生產驗證方案。應建立生產驗證方案,對包括廠房和器材設施的安裝、執行、效能以及生產工藝、質素控制方法等進行確認和產品驗證。當影響產品質素(包括營養成分)的主要因素,如工藝、質素控制方法、主要原輔料、主要生產器材等發生改變時,以及生產一定周期後,應進行再驗證,評估變化情況是否符合食品安全的要求。
(二)建立衛生監控制度。應制定針對生產環境、食品加工人員、器材及設施等的衛生監控制度,確立監控的範圍、物件和頻率,定期對衛生狀況進行監控,記錄並保存監控結果,發現問題及時整改。
(三)建立蟲害控制制度。應準確繪制蟲害控制平面圖,標明捕鼠器、粘鼠板、滅蠅燈、室外誘餌投放點、生化資訊素捕殺裝置等放置的位置,定期檢查蟲害控制情況。發現有蟲害痕跡時,應追查來源,消除隱患。
(四)建立清潔劑、消毒劑等化學品的管理制度。除清潔消毒必需和工藝需要,不應在生產場所使用和存放可能汙染食品的化學品。清潔劑、消毒劑等應采用適宜的容器妥善保存,並明顯標示、分類貯存,領用時應準確計量,做好使用記錄。
(五)建立清潔消毒用具管理制度。清潔消毒前後的器材和工器具應分開放置,妥善保管,避免交叉汙染。用於不同潔凈級別作業區的清潔工具應有明確標識,不得混用。
(六)建立產品留樣制度。每批產品均應留樣,留樣數量應滿足復檢要求。貯存產品留樣的場所應滿足產品貯存條件要求。產品留樣應保存至保質期滿,並有記錄。
(七)建立檔、記錄管理制度。建立檔管理制度,規定檔的批準、分發和使用要求,確保各相關場所使用的檔均為有效版本。建立記錄管理制度,對從原料采購、生產加工、出廠檢驗直至產品銷售的所有環節應詳細記錄,記錄保存期限不得少於產品保質期滿後六個月。
(八)建立工作服清洗保潔制度。準清潔作業區、清潔作業區工作服應及時更換並清洗,必要時應消毒。生產中應註意保持工作服幹凈完好,如受到汙染,應及時更換。
(九)建立產品追溯制度。應確定產品分批原則和批號編制方式,合理劃分生產批次,采用產品批號等方式進行標識,建立從原料采購、生產加工、出廠檢驗直至產品銷售的所有環節的記錄系統,確保對產品進行有效追溯。
(十)建立客戶投訴處理管理制度。對客戶提出的書面或口頭意見、投訴,企業相關管理部門應作記錄並尋找原因,妥善處理。
第七章 附 則
第三十九條 特殊醫學用途配方食品產品註冊時已抽樣檢驗合格,生產特許現場核查時不再重覆核查試制產品檢驗合格報告。
第四十條 本細則應與【審查通則】結合使用。特殊醫學用途配方食品生產特許現場核查時應當按照本細則要求以及產品批準註冊的相關內容進行核查。特殊醫學用途配方食品的產品類別、產品配方、生產工藝以及產品標簽、說明書等應當與產品批準註冊的相關內容保持一致。
第四十一條 本細則由國家市場監督管理總局負責解釋。
第四十二條 本細則自釋出之日起施行。











