
隨著生命科學的不斷進步,CRISPR基因編輯技術已經成為近年來最受矚目的科學突破之一。其獨特的機制、高效的編輯能力以及廣泛的套用前景,使其在全球範圍內受到了研究人員和研究機構的高度關註。
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) 技術,是一種利用RNA引導的DNA內切酶在特定位置切割DNA,從而實作基因編輯的方法。自2007年首次發現CRISPR-Cas系統在細菌中的自然免疫機制以來,研究人員經過不懈努力,逐步揭示了其工作原理,並將其轉化為一種高效的基因編輯工具。
CRISPR技術的出現,為生命科學研究提供了前所未有的編輯精度和靈活性。它不僅能夠在細胞層面上精確地修改遺傳資訊,還能在整個生物體級別上進行基因編輯,這對於疾病模型的構建、遺傳病的治療以及農業生物技術的發展等領域具有深遠的影響。CRISPR技術能夠精確地定位並修改生物基因組中的特定序列,為研究遺傳病提供了強大的工具;透過精確修復或修改病理性基因突變,CRISPR技術為遺傳性疾病治療提供了新的可能;CRISPR技術的套用,能夠提高作物的產量、抗性及營養價值,對全球食品安全產生積極影響。
隨著CRISPR技術研究的深入,其在生物醫藥、農業、環境保護等領域的套用潛力不斷被挖掘,對人類社會的發展產生了深刻的影響。而科學界對於其精確性、安全性和倫理性的持續探討,也為CRISPR技術的健康發展提供了重要的指導。2月29日Cell雜誌也對此發表了一篇綜述「Past, present, and future of CRISPR genome editing technologies」。

撰文 | K
CRISPR基因編輯的過去
CRISPR技術的起源與發展
CRISPR技術的發現和發展是現代生命科學領域的一項裏程碑,它不僅開辟了基因編輯的新紀元,也為未來的生物醫藥研究和套用提供了無限可能。
CRISPR技術的早期研究始於20世紀90年代,當時研究人員在一些細菌和古菌的基因組中發現了一些重復序列,這些序列之間由非重復的間隔序列分隔 。這些重復序列和間隔序列的結構特征,後來被稱為CRISPR。2005年,研究人員發現 這些間隔序列與細菌感染的病毒DNA相匹配,揭示了CRISPR序列與細菌抵抗病毒感染之間的關系 。2007年,Danisco的研究人員首次演示了CRISPR系統可以作為細菌的一種後天性免疫機制,防禦外來遺傳物質的侵入。
CRISPR-Cas9系統的辨識與功能解析
CRISPR-Cas9系統的功能機制在2012年被Jennifer Doudna和Emmanuelle Charpentier等研究人員揭示。他們發現, Cas9蛋白可以利用RNA分子作為引導,辨識並切割特定的DNA序列 。這項發現標誌著CRISPR技術在精確基因編輯方面的巨大潛力。隨後,CRISPR-Cas9系統因其簡便、高效的特性迅速成為科學研究中的熱門工具,被廣泛套用於基因功能研究、遺傳病治療、農業生物技術改良等多個領域。
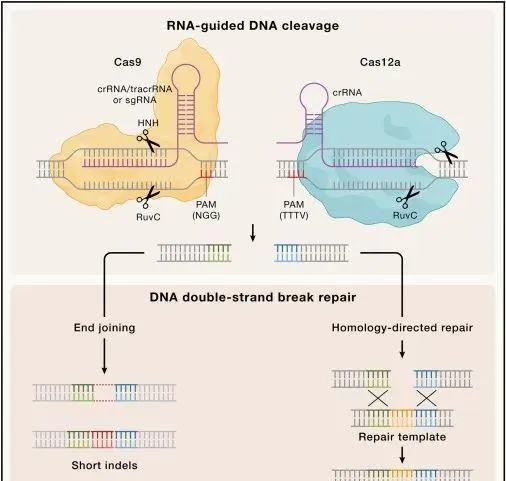
CRISPR基因組編輯的原理(Credit: Cell )
CRISPR技術的局限性
CRISPR技術雖然被譽為基因編輯領域的革命性工具,但其套用過程中依然存在一些不可忽視的局限性。這些局限性不僅影響了CRISPR技術的編輯精確性和特異性,也對編輯效率和遞送系統提出了挑戰。
精確性與特異性的挑戰
CRISPR-Cas9系統在特定DNA序列上的切割能力雖然精確,但在實際操作中,仍有可能發生非特異性切割,即「脫靶效應」。這種現象可能導致非目標基因的意外編輯,進而引發細胞功能的異常甚至突變。
脫靶效應的成因: 主要與引導RNA (gRNA) 設計有關。gRNA與DNA的互補不完全可能導致Cas9錯誤辨識目標,從而切割錯誤的DNA序列。
影響因素: 脫靶效應的發生率受多種因素影響,包括gRNA的序列特異性、Cas9蛋白的表達水平以及細胞類別等。
為了減少脫靶效應,研究人員已經開發出多種策略和工具,如最佳化gRNA設計、使用高保真Cas9變體、采用脫靶檢測技術等,以提高CRISPR技術的精確性和特異性。
編輯效率與遞送系統的限制
CRISPR技術的編輯效率受到多種因素的限制,其中遞送系統的選擇和最佳化是關鍵因素之一。有效、安全地將CRISPR元件遞送到目標細胞中,是實作高效基因編輯的前提。
遞送方法: 目前常用的CRISPR元件遞送方法包括病毒載體遞送、脂質體介導的遞送和納米粒子遞送等。每種方法都有其優勢和局限性,如病毒載體的遞送效率高但可能引發免疫反應,而非病毒遞送方法則安全性更高但遞送效率較低。
細胞類別的限制: 不同的細胞類別對CRISPR元件的接收能力不同,這也影響了編輯效率。例如,某些細胞類別對病毒載體的感受性較低,可能需要采用其他遞送策略。
為了克服這些局限性,研究人員正致力於開發新的遞送技術和改進現有方法,目標是實作更高效、更安全的CRISPR元件遞送。
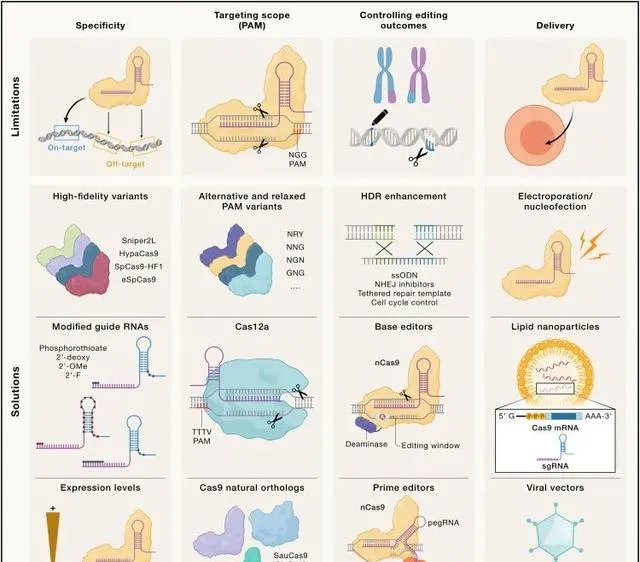
CRISPR基因編輯的局限性(Credit: Cell )
CRISPR基因編輯的現狀
當前技術與套用
CRISPR技術自誕生以來,其在基因編輯領域的套用迅速拓展,特別是在基因治療和農業生物技術研究中展現了巨大的潛力和實際價值。
CRISPR-Cas9在基因治療中的套用
隨著CRISPR-Cas9技術的不斷成熟,其在基因治療領域的套用逐步展現。透過精確修改或修復病理性基因,CRISPR-Cas9為遺傳性疾病的治療提供了新的可能。
遺傳疾病的靶向修復: CRISPR-Cas9技術能夠針對特定的遺傳缺陷進行精確編輯,實作疾病相關基因的修復或功能性調控,為遺傳病患者帶來了新的希望。例如,針對β-地中海貧血和鐮狀細胞貧血等血液疾病的基因治療已進入臨床試驗階段。
癌癥治療的研究: 利用CRISPR-Cas9技術靶向癌基因或腫瘤抑制基因,研究人員能夠更深入地理解癌癥的發生機制,並探索新的治療方法。
CRISPR技術在農業和生物研究中的套用
在農業生物技術領域,CRISPR技術的套用正在重新定義作物改良和遺傳研究的邊界。
作物品種改良: 透過CRISPR技術,研究人員可以精確編輯作物基因組,提高作物的產量、耐病性和營養價值。例如,透過編輯水稻和小麥中的特定基因,提高了其抗旱和抗病效能。
功能基因的研究: CRISPR技術在植物和動物模型中被廣泛用於功能基因的鑒定和驗證,加速了生物學基礎研究的進展。
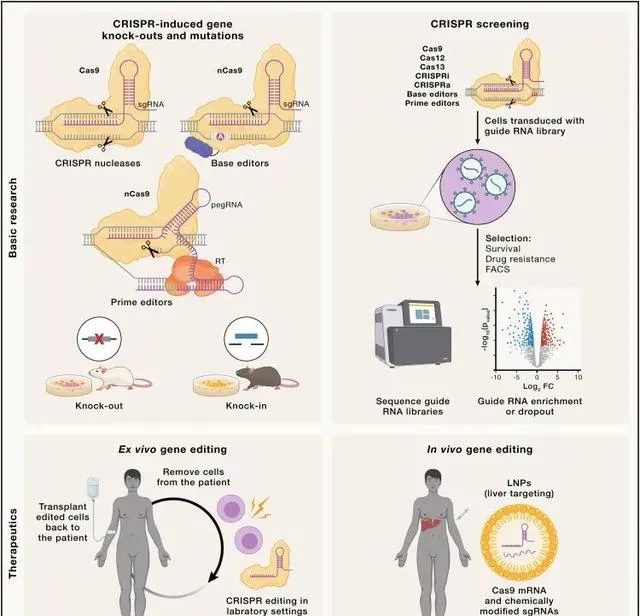
CRISPR基因編輯在人類健康領域的套用(Credit: Cell )
技術創新與最佳化
隨著CRISPR基因編輯技術的快速發展,技術創新與最佳化成為推動該領域進步的關鍵因素。
高保真CRISPR系統的開發
為解決CRISPR-Cas9系統可能引發的脫靶效應問題,研究人員透過蛋白工程技術開發了高保真 (Hi-Fi) CRISPR系統。這些高保真版本透過改良Cas9蛋白結構,顯著降低了非目標DNA位點的切割,從而提高了基因編輯的特異性。
Cas9蛋白的改良: 透過對Cas9蛋白的關鍵胺基酸進行突變,改變其與DNA的相互作用方式,從而減少對非目標序列的辨識和切割。
編輯效率與特異性的平衡: 高保真CRISPR系統在降低脫靶風險的同時,仍保持了較高的編輯效率,使其在臨床研究和治療套用中更加安全可靠。
CRISPR基因編輯技術的自動化與精密化
隨著基因編輯技術的廣泛套用,實驗流程的自動化和精密化成為提高實驗效率和準確性的關鍵。CRISPR技術的自動化不僅可以加速基因編輯專案的進展,還可以提高編輯的一致性和重復性。
自動化編輯平台: 開發整合化的CRISPR編輯平台,透過軟件控制實作高通量的樣本處理、gRNA設計和篩選,以及基因編輯效果的評估,顯著提升實驗的效率和準確度。
精密化編輯工具: 結合生物資訊學工具和深度學習演算法,最佳化gRNA的設計和選擇,提高特定基因靶點的編輯精確度,減少脫靶效應的發生。
近年來的主要進展
CRISPR-Cas9和Cas12a系統的開發: 這兩種系統是CRISPR技術中的核心,它們透過簡化的RNA引導機制使得基因組編輯變得高效和精確。CRISPR-Cas9主要來自於鏈球菌 (Streptococcus pyogenes, SpCas9) ,而Cas12a (以前稱為Cpf1) 提供了不同的PAM (Protospacer Adjacent Motif) 辨識和切割模式,擴充套件了CRISPR技術的套用範圍。
堿基編輯技術(Base Editors, BEs): 透過將Cas9變體 (缺少切割能力) 與細胞色素脫氨酶 (如APOBEC1) 融合,開發出能夠實作C到T (或G到A) 編輯的基礎編輯技術,避免了雙鏈斷裂 (DSB) 的產生,從而減少了可能引起的基因組不穩定性。
Prime Editors (PEs): 透過融合改造後的Cas9 (nickase) 和逆轉錄酶,能夠引導更復雜的DNA修飾,如小範圍插入、刪除和單堿基替換,無需DSB或供體DNA樣版,大大擴充套件了CRISPR技術的編輯能力。
CRISPR引導的重組酶和轉座子技術: 為了實作大片段DNA的精確插入,研究人員開始探索將CRISPR系統與重組酶或轉座子結合的方法,這種方法不依賴於DSB,從而在細胞中插入大片段DNA時減少了基因組不穩定風險。
CRISPRi(CRISPR幹擾)和CRISPRa(CRISPR啟用): 兩種利用CRISPR-Cas系統進行基因表現調控的技術。這兩種方法都依賴於催化活性被阻斷 (失活) 的Cas9蛋白 (稱為dCas9) ,它能夠特異性地結合到DNA,但不會切割DNA。透過將dCas9與不同的效應分子融合,可以對目標基因的表達進行上調或下調,而不改變DNA序列。 CRISPRi 透過將dCas9融合到諸如KRAB (Krüppel-associated box) 這樣的轉錄抑制域,然後將這種構建物定向到基因啟動子區域,從而阻止RNA聚合酶的結合和啟動轉錄過程,達到抑制基因表現的目的。CRISPRi技術可以用來有效地降低特定基因的活性,用於功能基因組學研究和疾病模型的建立。 CRISPRa 則是透過將dCas9融合到轉錄啟用因子,如VP64等,然後定向到特定基因的啟動子或強化子區域,從而增強該基因的轉錄和表達。CRISPRa可以用於研究基因過表達對細胞功能的影響,以及開發潛在的治療策略,特別是在需要增強某個保護性基因表現的情況下。
靶向RNA的沈默和修飾(Targeted RNA silencing and modifications): 透過特定的CRISPR-Cas系統,例如Cas13酶,針對RNA進行靶向沈默或修改的技術。這類技術的開發,為RNA層面的精確編輯提供了新的可能性,特別是在那些DNA編輯不是最佳選擇的情況下。透過定向編輯mRNA,這種方法能夠以可逆的方式調整基因表現,而不改變基因組DNA序列,從而在一定程度上降低了基因編輯的風險。此外,利用dCas13蛋白融合體進行的目標RNA修飾,還拓展了對RNA的編輯能力,包括但不限於增加m6A等表觀遺傳修飾。這些技術在基礎研究、疾病模型構建以及未來的治療策略中,展現了巨大的套用潛力。
人工智能(Artificial Intelligence, AI)在CRISPR中的套用: AI和深度學習技術正在被用於預測CRISPR編輯的結果,包括提高目標特異性和減少非目標編輯 (off-target effects) 。這些計算工具可以幫助研究者設計更有效、更安全的CRISPR編輯策略。
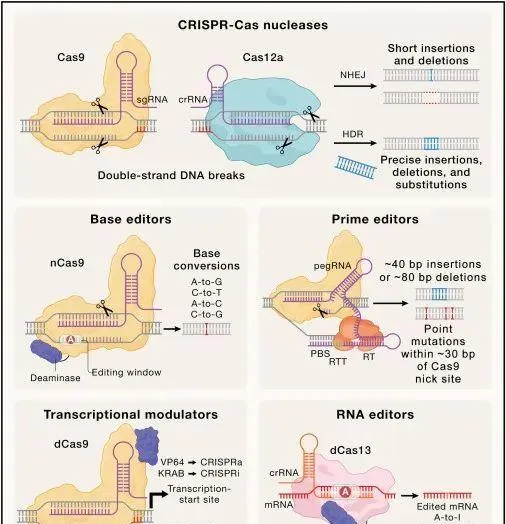
當前的CRISPR基因編輯技術(Credit: Cell )
CRISPR基因編輯的未來
新興技術與方法
在CRISPR基因編輯技術快速發展的今天,新興技術與方法的探索從未停止。
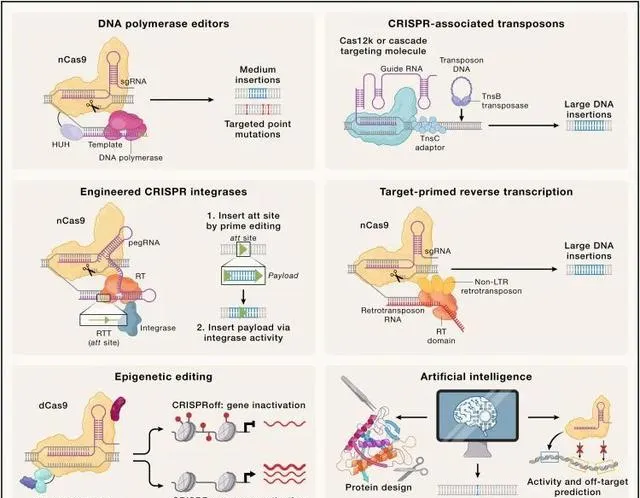
基因組編輯中的新興技術(Credit: Cell )
更精確的基因編輯技術: 隨著對CRISPR技術了解的深入,研究人員正在研發更精確和高效的基因編輯工具。這包括針對更長或更復雜DNA序列的編輯技術,以及能夠在非分裂細胞中高效工作的技術。
CRISPR引導的重組酶和轉座酶: 為了實作在分裂活動較少的細胞 (如神經細胞) 中進行高效的基因插入,研究人員正在開發新型的CRISPR引導的重組酶和轉座酶系統。這些系統有望實作大片段DNA的精準插入。
基於逆轉錄過程的基因編輯技術: 新型的基因編輯方法利用逆轉錄過程,允許更長的DNA片段插入目標基因組中。這為疾病模型的構建和遺傳治療提供了新的可能性。
表觀基因組編輯: 表觀基因組編輯技術不改變DNA序列,而是透過修改基因表現的調控來達到治療效果。這類技術對遺傳治療的安全性和倫理問題提出了新的解決方案。
RNA編輯技術: RNA編輯是一種相對較新的技術,它可以直接修改細胞內的mRNA分子,而無需改變DNA本身。這為治療基因疾病提供了一種更安全、更可逆的方法。
人工智能在基因編輯中的套用: 人工智能和深度學習演算法在基因編輯領域的套用日益增多,它們有助於預測基因編輯的結果,提高編輯的精確度和效率,尤其是在治療套用中的安全性和有效性。
CRISPR技術面臨的挑戰與機遇
隨著CRISPR基因編輯技術的快速發展和廣泛套用,其所面臨的倫理、社會及法律監管挑戰也日益凸顯。
倫理與社會接受度的考量
倫理爭議
CRISPR技術在基因療法和基因改良方面的潛力巨大,但其可能引發的倫理爭議也不容忽視。例如,基因編輯技術用於胚胎、生殖細胞的修改可能會對人類遺傳基因產生永久性影響,引起廣泛的倫理和道德討論。社會對基因編輯技術的接受程度不一,不同文化和宗教背景下,人們對於基因編輯的態度和看法各異,這對技術的推廣和套用構成了挑戰。
遺傳公平性
基因編輯技術的套用還引發了遺傳公平性的問題,即技術可能加劇社會不平等,使得基因編輯成為富裕階層的專利,而忽略了對廣大弱勢群體的影響。
法律與監管框架的發展
法律監管
隨著CRISPR技術的飛速發展,各國政府和國際組織正努力建立相應的法律和監管框架,以確保技術的安全、有效和倫理套用。監管框架的建立涉及到技術使用的範圍、研究資格的限制以及審批流程的嚴格規定。在全球範圍內,對CRISPR技術的法律監管還需要國際間的合作和標準化,以促進科學研究的同時,防止技術濫用和倫理風險。
監管挑戰
制定與CRISPR技術發展相適應的法律監管政策是一項挑戰,需要在促進科技創新與保障公眾利益之間找到平衡點。同時,監管機制需要具有一定的靈活性,以適應技術進步帶來的新情況和新挑戰。
CRISPR技術的未來發展不僅需要研究人員的不懈探索和創新,還需要倫理學家、法律專家、政策制定者以及公眾的共同參與。透過全面考慮倫理和法律問題,制定合理的監管措施,CRISPR技術才能在確保安全和倫理的基礎上,為人類帶來更多福祉。
對未來研究方向的建議
提高編輯效率和精確性: 繼續最佳化CRISPR系統,降低脫靶效應,提升基因編輯的準確度和安全性。
擴充套件CRISPR系統的多樣性: 研究和開發新的CRISPR系統,如Cas12、Cas13等,拓展基因編輯的可能性和套用範圍。
增強遞送系統的有效性: 改進CRISPR組分的遞送方法,確保其能夠更有效、更安全地到達目標細胞。
促進倫理和法律研究: 與倫理學家、法律專家合作,研究和制定適應技術發展的倫理指導原則和法律規範。
加強跨學科合作: 推動生物學、醫學、倫理學、法律和社會科學等領域的合作,促進CRISPR技術全面、均衡的發展。
Q&A
CRISPR基因編輯技術是如何工作的?
CRISPR-Cas9技術基於一種天然存在於細菌中的免疫機制,用於辨識並切割外來的遺傳物質,如病毒DNA。在實驗室設定中,研究人員可以設計特定的RNA序列 (引導RNA) ,使其與目標DNA序列精確配對,並指導Cas9酶到達並切割這個DNA位點。這一過程允許研究人員在基因組特定位置進行添加、刪除或替換基因片段,從而實作對遺傳物質的精確編輯。
CRISPR技術能治療哪些疾病?
CRISPR技術在治療多種遺傳性疾病方面展現出巨大潛力,包括但不限於:
- 遺傳性血液疾病,如鐮狀細胞病和β-地中海貧血;
- 遺傳性視網膜疾病,可能恢復或改善患者視力;
- 某些類別的腫瘤,透過編輯免疫細胞以更有效地辨識和攻擊癌細胞;
- 遺傳性肌肉疾病,如杜氏肌營養不良癥。
使用CRISPR技術進行基因編輯有哪些風險?
盡管CRISPR技術具有革命性的潛力,但其套用也伴隨著一定的風險和挑戰,包括:
- 脫靶效應:編輯工具可能會錯誤地辨識並切割非目標DNA序列,可能導致意外的基因突變;
- 遺傳物質的非預期變化:即使在目標位點成功編輯,也可能引發復雜的基因互動作用,導致不可預測的後果;
- 倫理和社會問題:特別是涉及人類胚胎編輯的套用,可能引起廣泛的倫理和社會擔憂。
CRISPR技術在未來的套用前景如何?
未來,CRISPR技術的套用前景廣闊,不僅限於醫學領域,還將擴充套件到農業、生物研究甚至生物計算等多個領域。在醫學上,隨著編輯精度的提高和遞送系統的改進,CRISPR有望為更多的遺傳性疾病提供治療方案。在農業上,透過改良作物的遺傳特性,可以增強作物的耐病性、產量和營養價值。此外,CRISPR技術的進一步研究和創新,將不斷拓寬人類對生命科學的認知和套用能力,為人類社會帶來更廣泛的福祉。
本文經授權轉載自微信公眾號「生物探索」,原文連結:https://doi.org/10.1016/j.cell.2024.01.042,Pacesa M, Pelea O, Jinek M. Past, present, and future of CRISPR genome editing technologies. Cell. 2024;187(5):1076-1100. doi:10.1016/j.cell.2024.01.042。
特 別 提 示
1. 進入『返樸』微信公眾號底部選單「精品專欄「,可查閱不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關註公眾號,回復四位陣列成的年份+月份,如「1903」,可獲取2019年3月的文章索引,以此類推。











