编译:微科盟coco,编辑:微科盟Tracy、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源【代谢组metabolome】公众号。
导读
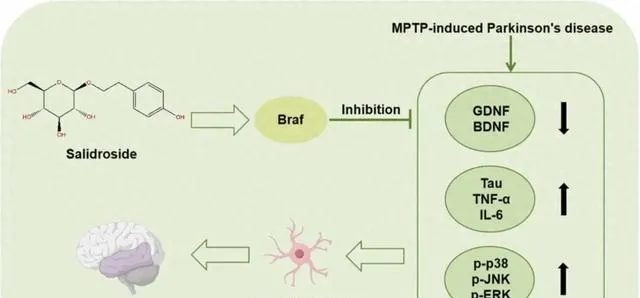
目的: 探讨红景天苷(Sal)改善帕金森病(PD)认知功能的潜在机制。
方法: 实验小鼠分为对照组、模型组[注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)]和模型+Sal(低浓度、高浓度)组。我们提取小鼠海马组织进行RNA测序,获得核心通路和核心基因。我们制备了小鼠血浆并用LC-MS分析以获得差异代谢物,通过免疫荧光和慢病毒转导验证体外实验。
结果: ELISA显示Sal有助于减少小鼠的神经元损伤和炎症反应。MPTP_Sal_Low和MPTP_Sal_High组的胶质细胞源性神经营养因子(GDNF)表达水平较高。转录组学鉴定出对照组、MPTP组和MPTP_Sal_High组的差异表达基因(DEG),归类于丝裂原活化蛋白激酶(MAPK)信号通路,获得核心基因Braf。代谢组学显示差异代谢物涉及DL-酪氨酸、腺苷、磷酸烯醇丙酮酸和L-色氨酸。体外实验验证Sal处理抑制了p-p38、p-c-Jun N末端激酶(JNK)和p-细胞外信号调节激酶(ERK)表达的上调,以及神经元突起的生长。Braf过表达(OE-Braf)组GDNF表达显著上调,p-p38、p-JNK和p-ERK表达降低,神经元突起显著生长。
结论: Sal可能通过Braf介导的MAPK信号通路发挥对PD的作用,从而增加GDNF的表达,促进神经元突起的生长,保护神经功能,改善认知功能。
亮点:
1.红景天苷有利于减轻神经元损伤,改善认知功能。
2.红景天苷有利于减轻炎症反应。
3.红景天苷增加海马GDNF和BDNF的表达。
4.红景天苷促进神经元突起的生长。
5.红景天苷可能通过抑制Braf介导的MAPK信号通路来改善PD。
论文ID
原名: Salidroside improves cognitive function in Parkinson’s disease via Braf-mediated mitogen‑activated protein kinase signaling pathway
译名: 红景天苷通过Braf介导的丝裂原活化蛋白激酶信号通路改善帕金森病的认知功能
期刊: Biomedicine & Pharmacotherapy
IF: 6.9
发表时间: 2024.06
通讯作者: 耿德勤,高殿帅
通讯作者单位: 南京医科大学
实验设计
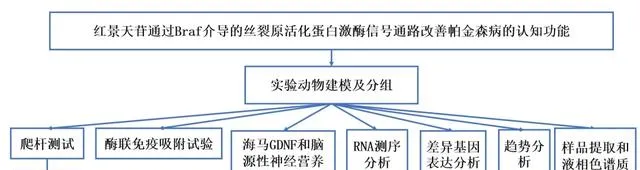
实验结果
1. Sal改善小鼠运动协调性
本研究使用的样品梯度洗脱程序如表1所示。整个分析过程中,样品均置于4℃的自动进样器中。21d杆测试显示,模型组转身时间和爬下时间明显高于对照组(P < 0.05)。与模型组相比,MPTP_Sal_Low组和MPTP_Sal_High组的转身时间和爬下时间明显缩短(P < 0.05)(图1A-B)。
表1 梯度洗脱程序
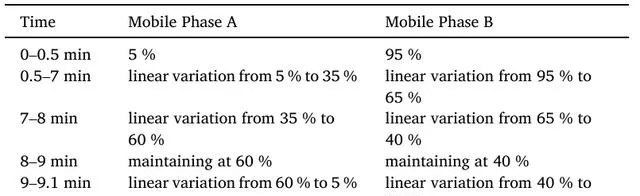

图1 爬杆实验评估小鼠运动协调能力。(A)转身时间;(B)爬下时间。注:#代表与对照组相比,P < 0.05;*代表与模型组相比,P < 0.05。
2. Sal促进小鼠学习记忆能力
Morris水迷宫测试显示,与对照组相比,模型组的路径长度和逃逸潜伏期明显延长(P < 0.05)。与模型组相比,MPTP_Sal_Low和MPTP_Sal_High组的路径长度明显缩短(P < 0.05)(图2A-B)。对照组和MPTP_Sal_High组小鼠到达平台的路径最短,而Model组小鼠到达平台的路径最长且最复杂(图2C)。
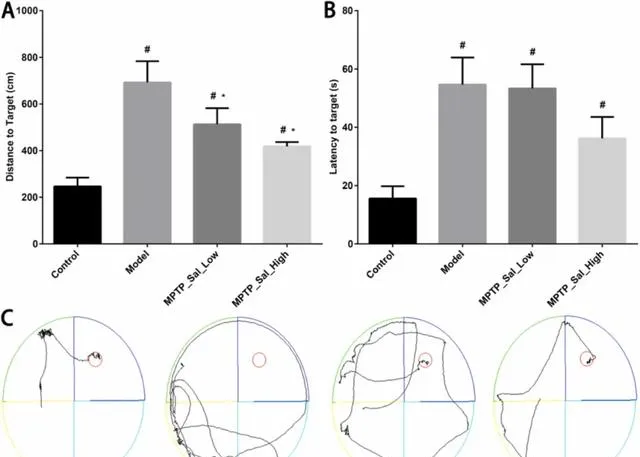
图2 Morris水迷宫测试对小鼠学习记忆能力的评估。(A)路径长度;(B)逃逸潜伏期;(C)小鼠游泳路径。注:#表示与对照组比较,P < 0.05;*表示与模型组比较,P < 0.05。
3. Sal改善小鼠神经元损伤和炎症反应
与对照组相比,模型组的Tau、TNF-α和IL-6水平显著升高(P < 0.05)。与模型组相比,MPTP_Sal_Low和MPTP_Sal_High组的Tau、TNF-α和IL-6水平显著降低(P < 0.05)。四组Syn水平比较无统计学差异(P > 0.05)(图3A-D)。
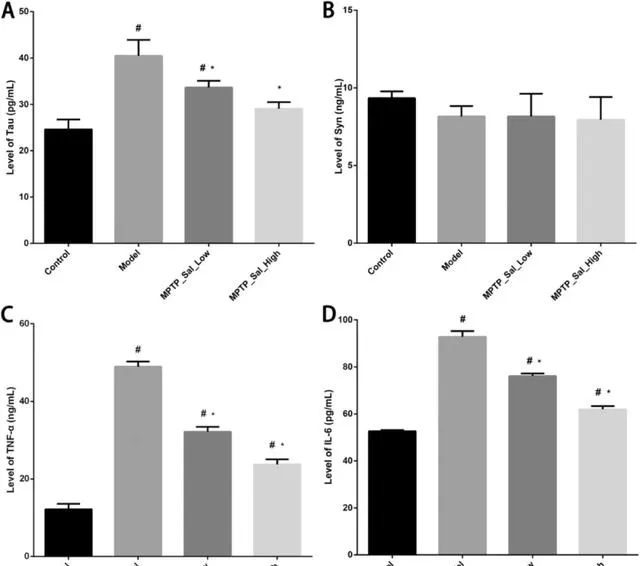
图3 ELISA检测小鼠海马神经退行性疾病指标及炎症因子。(A)Tau;(B)Syn;(C)TNF-α;(D)IL-6。注:#表示与对照组比较,P < 0.05;*表示与Model组比较,P < 0.05。
4. Sal增加海马GDNF和BDNF表达
免疫荧光结果显示,模型组与对照组相比,GDNF和BDNF表达明显降低。与Model组相比,MPTP_Sal_Low和MPTP_Sal_High组具有较高的GDNF和BDNF表达水平。(图4A-B)。
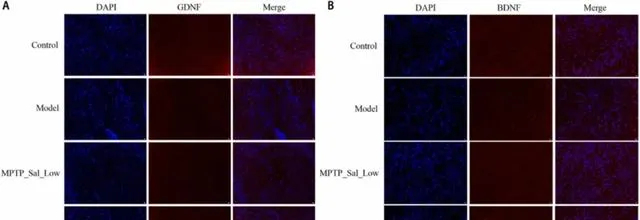
图4 免疫荧光检测海马GDNF和BDNF表达。(A)GDNF(10×40,20μm);(B)BDNF(10×40,20μm)。
5. 生物信息学分析后得到核心通路和核心基因
我们分析对照组和MPTP组之间的差异,得到177个上调基因和612个下调基因(图5A);分析对照组和MPTP_Sal_High组之间的差异,得到491个上调基因和2301个下调基因(图5B);分析MPTP组和MPTP_Sal_High组之间的差异,得到379个上调基因和830个下调基因(图5C)。
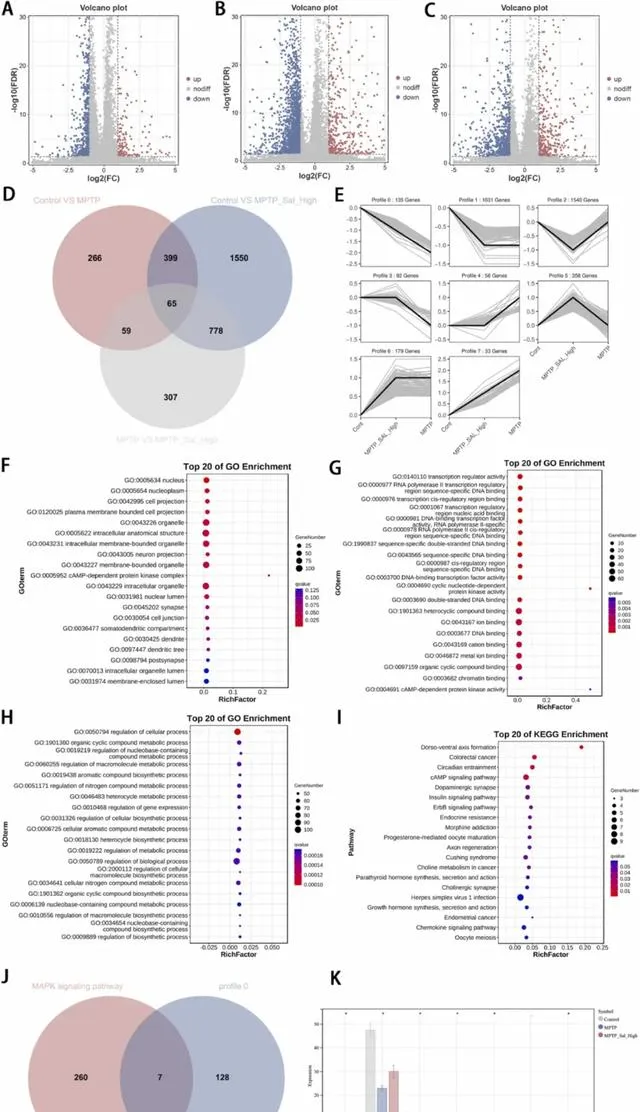
图5 通过生物信息学分析识别核心通路和核心基因。(A) 火山图显示对照组和MPTP组的DEGs;(B) 火山图显示对照组和MPTP_Sal_High组的DEGs;(C) 火山图显示MPTP组和MPTP_Sal_High组的DEGs;(D)通过各比较组DEGs并集得到3424个动态基因;(E) 动态布局和基因数量;(F) GO term富集分析的细胞成分;(G) GO term富集分析的分子功能;(H) GO term富集分析的生物学过程;(I) DEGs显著富集的信号通路;(J) 通过MAPK信号通路基因与关键模块基因交集得到7个核心基因;(K) 组间基因表达。
随后,我们对各比较组的DEGs的并集进行趋势分析,动态基因总数为3424个(图5D)。DEGs被分为8个不同的动态模块,由于本研究更关注那些经Sal处理后表现出连续变化的基因,因此重点关注了profile 0,共有135个基因(图5E)。对该动态中的DEGs进行了GO term富集分析。DEGs在神经元投射、细胞核和核质等细胞成分中富集(图5F);分子功能的变化主要集中在转录调控活性和转录顺式调控区结合上(图5G)。GO term富集分析表明DEGs与生物过程有关,例如调节细胞过程和细胞生物合成过程(图5H)。随后我们对核心模块进行KEGG富集分析,筛选出DEGs显著富集的信号通路,发现DEGs与MAPK信号通路、多巴胺能突触、轴突再生、胆碱能突触相关(图5I)。
本研究筛选出与神经系统疾病相关的核心通路:MAPK信号通路,通过KEGG数据库获得MAPK信号通路内267个基因。我们将MAPK信号通路基因与核心模块基因进行交集,得到7个核心基因(图5J)。对比不同实验组间目的基因表达差异,我们发现Control组、MPTP组和MPTP_Sal_High组Braf、Prkacb、Srf、Cacnb4、Fos、Prkx基因表达存在差异(P < 0.05)(图5K)。在此基础上,Braf被选定为后续研究的核心基因。
6. 代谢组学鉴定核心代谢物
正离子模式下,与对照组相比,MPTP组有36种代谢物表达上调,255种代谢物表达下调(图6A)。与对照组相比,MPTP_Sal_High组有63种代谢物表达上调,233种代谢物表达下调(图6B)。与MPTP组相比,MPTP_Sal_High组有140种代谢物表达上调,53种代谢物表达下调(图6C)。负离子模式下,与对照组相比,MPTP组有49种代谢物表达上调,277种代谢物表达下调(图6D)。与对照组相比,MPTP_Sal_High组有65种代谢物表达上调,269种代谢物表达下调(图6E);与MPTP组相比,MPTP_Sal_High组有130种代谢物表达上调,90种代谢物表达下调(图6F)。
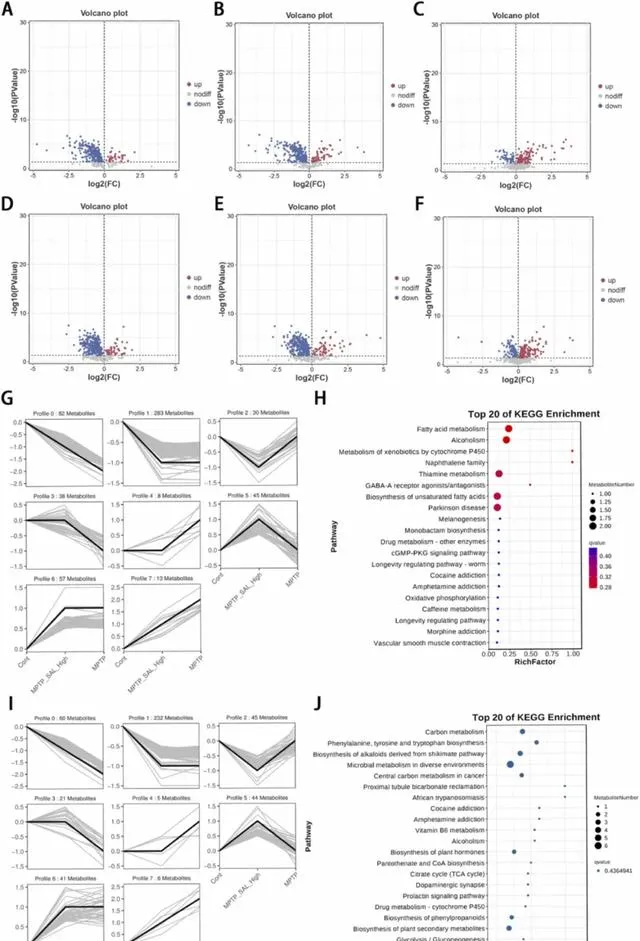
图6 通过代谢组学鉴定核心代谢物。(A) 正离子模式下对照组和MPTP组之间的 DM 火山图;(B) 正离子模式下对照组和MPTP_Sal_High组之间的DM火山图;(C) 负离子模式下MPTP组和MPTP_Sal_High组之间的DM火山图;(D) 负离子模式下对照组和 MPTP 组之间的 DM 火山图;(E) 负离子模式下对照组和 MPTP_Sal_High 组之间的 DM 火山图;(F) 负离子模式下MPTP 组和 MPTP_Sal_High 组之间的 DM 火山图;(G) 正离子模式下的动态布局和基因数量;(H) 正离子模式下 DM 显著富集的途径;(I)负离子模式下基因的动态布局和数量;(J)负离子模式下DMs显著富集的途径。
正离子模式下Trend_Cont_MPTP_SAL_High_MPTP分析结果显示,动态代谢物总数为2129种,我们筛选出1573种代谢物,得到556种DM。DM被分为8个不同的趋势模块(图6G),由于本研究更关注Sal处理后具有连续变化的代谢物,因此重点关注profile 0,共计82个代谢物。DM显著富集的通路共有8条(表2)。本研究筛选出了与神经系统疾病相关的核心通路:帕金森病,该通路的DM涉及DL-酪氨酸和腺苷(图6H)。
表2 正离子模式下DM显著富集的通路
负离子模式下Trend_Cont_MPTP_SAL_High_MPTP分析结果显示趋势代谢物总数为1850个,筛选出1396种代谢物,得到454种DM。DM被分为8个不同的趋势模块(图6I),由于本研究更关注Sal处理后代谢物连续动态变化的情况,因此重点关注profile 0,共60种代谢物。有4条通路显著富集DM(表3)。本研究筛选出了与神经系统疾病相关的核心通路:苯丙氨酸、酪氨酸和色氨酸的生物合成,该通路的DM涉及磷酸烯醇式丙酮酸和L-色氨酸(图6J)。
表3 负离子模式下DM显著富集的通路

7. 转录组学和代谢组学的关联分析
将DEGs和DMs富集通路进行交集得到一条信号通路,即酒精中毒(图7A)。该通路的DEGs包括Braf、Prkacb、Gnb3和Sos1,DMs包括腺苷和DL-酪氨酸。热图展示了转录组的基因表达以及代谢组学的代谢物丰度(图7B)。与对照组相比,MPTP组的Braf、Prkacb、Gnb3和Sos1下调,而与MPTP组相比,MPTP_Sal_High组的Braf、Prkacb、Gnb3和Sos1上调。此外,与MPTP组相比,MPTP_Sal_High组的腺苷和DL-酪氨酸积累较多。
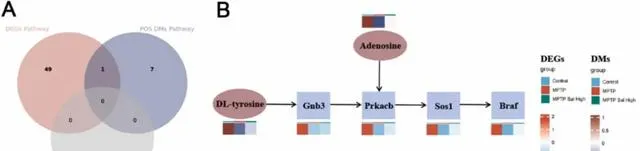
图7 转录组学和代谢组学的关联分析。(A)DEGs富集通路和DMs富集通路Venn图;(B)基因表达与代谢物含量的整合图。
8. 体外实验验证Sal对神经元突起生长的影响
免疫荧光检测显示大部分培养细胞呈GFAP阳性,说明培养细胞为星形胶质细胞。绿色代表GFAP阳性细胞,蓝色代表DAPI与细胞核结合。细胞爬片时,星形胶质细胞明显,呈梭形,GFAP表达主要位于胞浆和突起处。本实验中95%以上的星形胶质细胞为阳性反应,符合实验要求(图8A)。
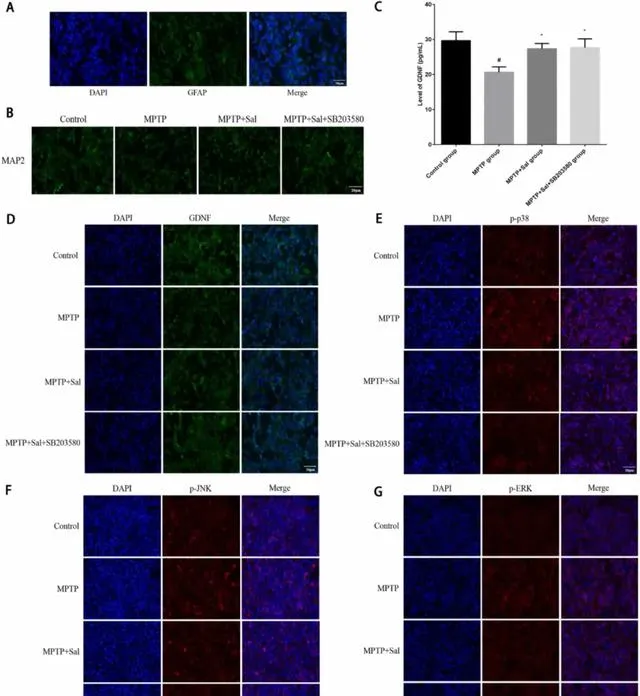
图8 体外实验鉴定Sal对神经元突起生长的影响。(A)免疫荧光检测GFAP表达(10×40,20μm);(B)免疫荧光检测神经元突起长度(10×40,20μm);(C)ELISA检测GDNF表达;(D)免疫荧光检测GDNF表达(10×40,20μm);(E)免疫荧光检测p-p38表达(10×40,20μm);(F)免疫荧光检测p-JNK表达(10×40,20μm);(G)免疫荧光检测p-ERK表达(10×40,20μm)。注:#表示与对照组比较,P < 0.05;*表示与MPTP组比较,P < 0.05。
免疫荧光检测结果显示,MAP2在免疫荧光下被染成绿色,可见神经元胞体和突起,MPTP组突起长度较对照组短,MPTP+Sal组和MPTP+Sal+SB203580组神经元突起较MPTP组明显增多(图8B)。
ELISA检测结果显示,与对照组相比,MPTP组GDNF水平明显降低(P < 0.05),与MPTP组相比,MPTP+Sal组和MPTP+Sal+SB203580组GDNF水平明显升高(P < 0.05)(图8C)。
免疫荧光检测显示MPTP组与对照组相比GDNF水平降低,而MPTP+Sal组和MPTP+Sal+SB203580组与MPTP组相比GDNF水平升高(图8D)。
MPTP激活星形胶质细胞MAPK信号通路,p-p38、p-JNK、p-ERK表达上调。此外,SB203580处理降低了p-p38、p-JNK、p-ERK表达,Sal处理抑制了p-p38、p-JNK、p-ERK表达上调(图8E-G)。
另外,我们构建了慢病毒载体,慢病毒过表达载体转导后Braf mRNA表达明显增强,Braf表达明显高于NC组(图9A-B);免疫荧光结果显示OE-Braf组较NC组神经元突起明显增多(图9C);免疫荧光结果显示OE-Braf组GDNF表达明显上调(图9D);与NC组相比,OE-Braf组p-p38、p-JNK、p-ERK表达降低(图9E-G)。
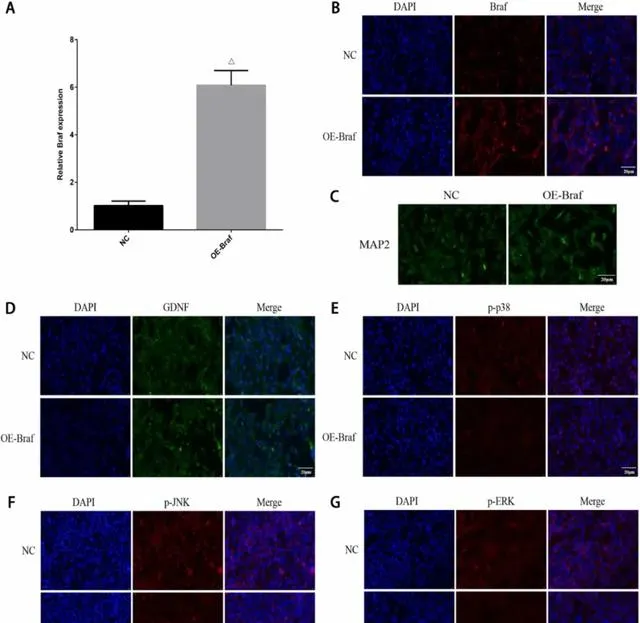
图9 Braf 过表达对神经元突起生长的影响。(A)qPCR检测NC和OE-Braf组Braf mRNA表达;(B)免疫荧光检测NC和OE-Braf组Braf表达(10×40,20 μm);(C)免疫荧光检测NC和OE-Braf组神经元突起长度(10×40,20 μm);(D)NC和OE-Braf组GDNF表达(10×40,20 μm);(E)免疫荧光检测NC和OE-Braf组p-p38表达(10×40,20 μm);(F)免疫荧光检测NC和OE-Braf组p-JNK表达(10×40,20 μm);(G)免疫荧光检测NC组和OE-Braf组p-ERK表达(10×40,20μm)。注:△表示与NC组比较,P<0.05。
讨论
PD在中老年人中较为常见,但在50岁以下人群中相对少见,其主要病理改变为黑质致密部多巴胺能(DA)神经元变性丢失,黑质-纹状体DA含量降低,路易氏体大量聚集,胆碱能系统相对亢进。目前,PD的发病机制尚不明确,临床上普遍认为与氧化应激、线粒体衰竭、神经炎症、神经老化等有关。PD患者出现认知功能障碍的风险随着年龄增长而增加。研究证实,PD患者轻度认知障碍的患病率约为20%–40%,且PD患者发生痴呆的概率随病程延长而增加,发病早期约为3%–30%,发病20年后可达80%以上。目前,采用有效的方案缓解PD患者的认知障碍已成为研究热点。
Sal是从中药红景天中提取的苯乙醇化合物,不仅能促进血脑屏障的修复、抑制炎症因子的释放,还有很强的神经保护作用。Wu等研究发现Sal通过影响6-羟基多巴胺在帕金森病大鼠的神经毒性来对抗氧化应激损伤,这种作用可能与Wnt/β-catenin信号通路有关。Li等研究发现Sal对帕金森病具有重要的神经保护作用,其主要通过调控与氧化应激相关的线粒体MEF2D-ND6通路来保护DA神经元。Liang等从大鼠获取海马组织发现Sal有利于乙酰胆碱含量和丙二醛活性的增加,能够抑制过度的炎症反应,减轻氧化应激,调节胆碱能系统,从而改善大鼠的认知功能。本研究构建了PD小鼠模型,并通过行为学实验进行观察,发现MPTP诱导的小鼠模型对爬杆能力有不良影响,降低空间学习记忆功能,而不同浓度的Sal可改善小鼠的运动协调能力,有利于提高其学习记忆能力。此外,Tau和Syn参与了细胞骨架组织破坏、轴突运输缺陷、神经元功能障碍等过程,Tau和Syn水平的变化被认为是PD患者认知功能下降的病理基础。炎症在PD的发病过程中也起着一定的作用,Sal已被用于干预脓毒症性脑病小鼠,我们发现其TNF-α、IL-1β、IL-6水平明显降低,丙二醛含量降低,LPS诱导的海马自噬增强,从而起到神经保护作用。本研究发现,与对照组相比,模型组Tau、TNF-α、IL-6水平明显升高,提示帕金森病小鼠神经元受损,炎症反应加重,而Sal有利于减轻小鼠神经元损伤,降低炎症反应,改善认知功能。本研究阐明Sal对帕金森病小鼠行为障碍有改善作用,对多巴胺能神经元有保护作用,其可能机制之一是Sal促进Tau及炎症因子的清除。
当大脑的认知功能受损时,海马、大脑皮层等前脑结构通常会受到损害。海马形成功能障碍与多种神经退行性疾病密切相关。神经营养因子包括神经生长因子、BDNF和GDNF。其中,GDNF在基底神经节、嗅结节等DA神经元投射区域,Meynert基底核、三叉神经运动核等与某些运动有关的神经结构,以及丘脑、三叉神经感觉核等与某些感觉有关的结构都有相当多的mRNA表达。有研究已证实GDNF可对PD小鼠发挥神经营养作用,促进DA能神经元的正常发育和功能。Conway等人的研究表明,GDNF 可以特异性地促进 DA 能神经元的存活,促进 DA 能神经元的形态分化,促进神经元对DA的摄取,推测GDNF/RET 信号可作为治疗PD的一种方法。血清GDNF可能与PD合并认知障碍患者的注意力、记忆力和执行功能受损有关,无论是通过其单独作用还是与神经递质(HVA、5-HT、GABA 和 Ach)联合作用。本研究的免疫荧光结果显示,模型组的GDNF和BDNF表达明显低于对照组。与模型组相比,MPTP_Sal_Low 组和 MPTP_Sal_High 组的GDNF和 BDNF 表达水平较高。这一发现与Liu等人的研究结果基本一致。研究发现,Sal 可能通过调节细胞生长并与轴突再生相关的神经营养因子 (BDNF、GDNF) 发挥治疗作用。
本研究采用生物信息学技术探讨Sal治疗帕金森病的作用机制,有效识别了Sal干预所调控的基因。我们对对照组、MPTP组、MPTP_Sal_High组的DEGs并集进行趋势分析,将DEGs分为8个不同的趋势模块。KEGG富集分析显示,DEGs主要富集在MAPK信号通路、多巴胺能突触、轴突再生、胆碱能突触等通路。其中,MAPK信号通路是与神经系统疾病相关的核心通路,MAPK是一组丝氨酸/苏氨酸蛋白激酶,是信号转导网络的重要组成部分,MAPK信号通路参与神经元的存活与凋亡,与神经损伤、神经可塑性调控密切相关。有研究者构建了PD和DAergic神经元损伤模型,发现抑制p38 MAPK信号通路可降低炎症介质水平,体外实验也证实特异性p38抑制剂SB203580可增强抗炎作用。BDNF通过与原肌球蛋白相关激酶B(TrkB)受体结合,使TrkB磷酸化,从而激活MAPK/ERK通路,进而对精神分裂症、阿尔茨海默病、PD等疾病产生影响。Ahmed等已得出结论,ERK1/2、JNK和p38作为MAPK信号通路的关键组成部分,在细胞增殖、分化和凋亡中发挥关键作用,参与神经生长、神经保护和神经营养等神经活动,从而影响与年龄相关的神经退行性疾病的发病率。随后,本研究从MAPK信号通路基因与关键模块基因的交集出发,获得与神经功能相关的核心基因Braf。Braf编码一种参与MAPK信号通路组成的丝氨酸/苏氨酸蛋白激酶。研究证实,在帕金森病患者中,Braf在该通路中富集,Braf在神经元中的失调及其对神经胶质细胞的影响可能促使神经退行性疾病的发生。因此,本研究推测Sal治疗帕金森病的作用机制可能通过调控MAPK信号通路和神经功能相关基因的表达来促进神经元生长。
代谢组学的特点对中医药治疗机制分析具有良好的作用。本研究在正负离子模式下,筛选出了与神经系统疾病、帕金森病及苯丙氨酸、酪氨酸和色氨酸生物合成相关的核心通路,以及该通路的调控因子DL-酪氨酸、腺苷、磷酸烯醇丙酮酸和L-色氨酸。代谢组学结果显示,Sal可能通过调节能量代谢和氨基酸代谢发挥帕金森病的治疗作用。研究表明,苯丙氨酸、酪氨酸和色氨酸作为芳香族氨基酸,可引起神经系统改变,芳香族氨基酸代谢异常可能是帕金森病发病的重要机制。有学者发现帕金森病患者血浆或脑脊液中的代谢物谱发生改变,其中酪氨酸和色氨酸等氨基酸可作为潜在的生物标志物。在帕金森病的发生过程中,线粒体功能障碍,代谢模式发生改变。腺苷是ATP的主要代谢产物,来源于ATP的去磷酸化,在中枢神经系统中起神经递质的作用,具有神经保护和抗炎信号传导作用。磷酸烯醇丙酮酸是糖酵解和糖原生成的中间产物。Bergau等人已证明,阿尔茨海默病患者和非阿尔茨海默病患者脑脊液中的糖酵解代谢产物存在差异,阿尔茨海默病患者的磷酸烯醇丙酮酸显著降低。为了研究Sal对疾病相关基因和代谢物的影响,本研究进行了转录组学和代谢组学的关联分析。结果显示,与MPTP组相比,MPTP_Sal_High组中Braf、Prkacb、Gnb3、Sos1表达上调,腺苷和DL-酪氨酸在MPTP_Sal_High组中积累。我们推断Sal治疗可能通过影响PD相关DEGs的表达和DMs的含量发挥作用。腺苷已被证实与PD的发病有关,由于腺苷在突触后分布较多,在突触前分布较少,因此可以减少突触前各种神经递质刺激的释放,调节神经元活动,从而起到负反馈调节的作用。腺苷A2A受体(A2AR)可以调控苍白球和内侧前额叶皮质神经元的工作记忆。苯丙氨酸在苯丙氨酸羟化酶的作用下转化为L-酪氨酸,酪氨酸在酪氨酸羟化酶(TH)的作用下转化为左旋多巴,左旋多巴在芳香族氨基酸脱羧酶的作用下脱羧为DA。帕金森病患者中苯丙氨酸代谢的改变会影响酪氨酸代谢物的合成,并伴有TH失活,从而产生一系列的异常改变。此外,Braf与神经系统疾病核心通路的代谢物存在相关性。Luebker等人报道,Braf抑制剂耐药的LM-MEL-28细胞的KEGG通路基因集富集检测到糖酵解/糖异生、脂肪酸代谢、缬氨酸/亮氨酸/异亮氨酸降解、丙酮酸代谢和色氨酸代谢的下降。有研究人员建议通过使用 3-巯基丙酸靶向抑制磷酸烯醇丙酮酸羧激酶 1 来克服黑色素瘤对 b-raf 抑制剂的化学耐药性。Young的研究结果表明,抑制 BRAF 和 MEK 与 A2A 腺苷受体相结合,可显著防止小鼠肿瘤发生和转移形成,靶向腺苷可增强接受靶向或免疫治疗的 Braf 突变黑色素瘤患者的治疗反应。
此外,本研究还通过体外实验验证了Sal对神经元突起生长的影响。首先我们分离了小鼠皮质星形胶质细胞,并用GFAP免疫荧光进行鉴定。结果发现,与模型组相比,Sal治疗能够提高GDNF水平,SB203580治疗后GDNF水平也显著升高。这一发现表明Sal通过促进GDNF的神经营养支持对多巴胺能神经元发挥保护作用,而p38 MAPK信号通路的抑制有助于GDNF水平的升高。MAPK信号通路通常由p38、JNK和ERK检测。当脊髓神经元和星形胶质细胞受损时,p38、JNK和ERK表达增加,进而激活一系列与炎症相关的下游信号通路。在本研究中,MPTP激活了星形胶质细胞MAPK信号通路,p-p38、p-JNK和p-ERK表达上调。SB203580 治疗能够降低 p-p38、p-JNK 和 p-ERK 表达,而Sal 治疗可抑制 p-p38、p-JNK 和 p-ERK 表达的上调。人们认为 Sal 可能通过促进 GDNF 表达和抑制 MPTP 激活的星形胶质细胞中的 MAPK 信号通路发挥神经保护作用。Qi 等人已证实 Sal 浓度依赖性地抑制 pO2 诱导的 PC12 细胞凋亡,减弱 p38、JNK和 ERK 的磷酸化,并抑制活性氧的释放,从而发挥神经保护作用。Zhang等人有报道指出Sal通过下调促凋亡蛋白Bax、上调抗凋亡蛋白Bcl-X(L)来保护神经元免受氧化应激,并能抑制JNK和p38 MAPK的磷酸化,但不能显著抑制ERK1/2,由于本研究样本量小,组内样本差异大,与本研究结果略有不同。需要说明的是,我们的研究仅关注MAPK信号通路,而Sal可能有多种调控机制,本研究不能排除Sal通过其他通路或机制影响神经元。Sal参与的信号通路在PD中的作用已被许多学者报道。Zhang等对PD细胞焦亡的机制及Sal的神经保护作用进行了研究,发现Sal通过抑制TXNIP/NLRP3/caspase-1信号通路直接抑制细胞焦亡,保护多巴胺能神经元。Chen等报道称,Sal 诱导的对 PD模型神经元的保护的潜在机制可能涉及自噬的保留,自噬主要通过 mTOR/p70S6K 信号传导减弱神经元中 α-syn 的磷酸化。Shen 等人报道,在体内,Sal 治疗可以降低 PD 小鼠黑质中丙二醛和铁的含量;在体外,SAL治疗可以增加TH、GPX4和Nrf2的表达和线粒体膜电位,同时通过 Nrf2/GPX4通路减轻PD中的铁死亡。Zhang等人得出结论,Sal可以部分调节 PI3K/Akt/GSK3β 通路,以防止 MPTP 诱导的细胞凋亡和多巴胺能神经元的丢失。以上研究证实Sal可能通过不同的信号通路调控细胞焦亡、自噬、铁死亡和凋亡,从而在帕金森病的发生发展中发挥作用。与以往报道不同,本研究表明Sal通过MAPK信号通路调控GDNF表达,影响神经元突起生长,从而表现出减轻帕金森病的作用,但具体机制还有待进一步探讨。此外,神经元突起的缩短或缺失是导致神经退行性疾病的基本病理特征,突触可塑性是中枢神经系统再生的重要组成部分,在认知功能的调控中起着不可替代的作用。我们通过MAP2免疫荧光染色探讨了Sal对神经元轴突生长的影响,结果表明在Sal干预的同时加入MAPK信号通路抑制剂可以显著增加神经元突起。为了观察Sal对神经元突起生长的作用,我们在Sal干预的同时加入了p38 MAPK抑制剂,结果发现与单独使用Sal相比,Sal与Sb203580联合使用对GDNF表达和神经元突起生长的增加有更好的正向作用,这说明MAPK信号通路是Sal发挥神经保护作用的靶点。最后,我们对Braf慢病毒感染星形胶质细胞后GDNF表达和神经元突起生长的变化进行了初步探讨。结果发现,OE-Braf组GDNF表达水平明显上调,p-p38、p-JNK、p-ERK表达降低,神经元突起明显增多。结果提示,星形胶质细胞感染Braf慢病毒后,其内在生物学行为发生了改变。Braf上调可能诱导星形胶质细胞分泌GDNF,从而促进神经元生长,这与MAPK信号通路活性下调有关。本实验为后续研究Braf过表达星形胶质细胞在PD中的作用奠定了基础,但其详细的调控机制仍需进一步研究。
综上所述,Sal可能通过Braf介导的MAPK信号通路对PD产生影响,增加GDNF的表达,促进神经元突起的生长,从而保护神经功能,改善认知功能。本研究的局限性在于我们只对profile 0中包含的DEGs和代谢物感兴趣,但在未来的研究中,还需要关注profile 7中的其他DEGs和代谢物。此外,作者初步讨论了Braf慢病毒感染星形胶质细胞后GDNF表达和神经元突起生长的变化。由于研究范围较窄等因素,本研究未对MPTP和MPTP+Sal样品进行Braf慢病毒感染。因此,可以考虑扩大研究范围以获得更准确的结果。未来还需要更多的实验来进一步探究Sal对PD的治疗机制。











