
2024 年 6 月 11 日至 16 日,北京大学消化肿瘤论坛暨中国胃肠肿瘤临床研究协作组(CGOG)第十四届年会在北京盛大举行,本次大会以「创新、共赢、卓越」为宗旨,立足消化系统肿瘤的精准诊疗和转化研究,聚焦最新的研究进展和方向,汇集临床实践的难点与热点,极大地推动了我国消化系统肿瘤的规范化诊治。
大会上,来自北京大学肿瘤医院的 周军教授 对 胰腺癌新型免疫疗法研究进展 做了详细汇报,「丁香园肿瘤时间」将内容整理如下,以飨读者。
Claudin18.2(CLDN18.2)
CLDN18.2 是一种泛癌靶点,主要参与肿瘤细胞的增殖分化和迁移。在正常组织中,CLDN18.2 仅在胃上皮细胞高表达,而在肿瘤中,CLDN18.2 在包括胃癌、胰腺癌、胆囊及胆道癌、食管癌以及肺癌等多种肿瘤中广泛高表达,因此是一种理想的治疗靶点。
目前,国内外多家药企已经开发了针对 CLDN18.2 靶点的多项免疫治疗策略,包括单克隆抗体(mAB)、双特异性抗体(BsAbs)、抗体偶联药物(ADCs)以及嵌合抗原受体 T 细胞(CAR-T)疗法等。同时已有多种药物处于临床研究阶段,如单克隆抗体 Zolbetuximab,靶向 CLDN18.2 和 CD3 的双特异性抗体 Gresonitamab、ASP2138、AZD5863、QLS31905,靶向 CLDN18.2 和 PD-L1 的双特异性抗体 Q-1802,靶向 CLDN18.2 和 4-1BB 的双特异性抗体 Givastomig,ADC 药物 SYSA1801、CMG901,以及 CAR-T 细胞疗法 CT041、LB1908 等等。
EMINYN18.2 研究
今年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上报道了一项靶向 CLDN18.2 的 CAR-T 产品 CT041(satri-cel)用于治疗晚期胃癌和胰腺导管腺癌的 Ⅰb 期 EMINYN18.2 研究 [1] 。结果显示,所有患者(7 例胃癌和 12 例胰腺癌)的客观缓解率(ORR)为 26.3%,中位缓解持续时间(DOR)为 3.7 个月,临床获益率(CBR)为 42.1%。其中在胰腺癌中的 ORR 为 16.7%(2/12),中位 DOR 为 3.4 个月,CBR 为 33.3%。该研究初步证实了 CT041 在既往经过多线治疗的 CLDN18.2 阳性晚期胃癌和胰腺癌中的有效性。CG4006 和 ST-01 研究的汇总分析
近日,北京大学肿瘤医院沈琳教授团队在 Journal of Clinical Oncology 杂志上发表了一篇题为 Safety and Efficacy of CT041 in Patients With Refractory Metastatic Pancreatic Cancer: A Pooled Analysis of Two Early-Phase Trials 的文章 [2] 。该汇总分析纳入两项关于 CT041 的 Ⅰ 期研究(CG4006 和 ST-01 研究)共 24 例晚期胰腺癌患者,其中 5 例(20.8%)患者既往接受过一线治疗,而 19 例(79.2%)患者接受过 ≥2 线治疗,研究的主要终点为首次输注 CT041 后 4 周的安全性和耐受性。结果显示,24 例患者中 4 例获得部分缓解(PR),总体 ORR 为 16.7%;13 例(54.2%)患者疾病稳定(SD),疾病控制率(DCR)为 70.8%。24 例患者中有 17 例(70.8%)患者的 CA19-9 水平下降了至少 30%,CA19-9 的中位下降水平为 73.0%。CT041 回输后的中位无进展生存期(PFS)为 3.3 个月,中位总生存期(OS)为 10.0 个月,中位 DOR 为 9.5 个月。与疗效评估为疾病进展(PD)的患者相比,获得 PR/CR 患者的中位 PFS(6.0 vs 1.0 个月)和 OS(17.6 个月 vs 4.0 个月)显著延长。由此可见,靶向 CLDN18.2 的 CAR-T 细胞疗法在晚期胰腺癌中展现出了显著疗效及良好的应用前景,目前已有多款产品布局晚期胰腺癌治疗。
MSLN 是一种细胞表面肿瘤分化抗原,在正常组织中表达量很低,但在间皮瘤、肺癌、胰腺癌、乳腺癌、卵巢癌等多种肿瘤中高表达。超过 80% 的胰腺癌存在 MSLN 高表达,且其表达与患者预后呈负相关,是胰腺癌治疗的潜在靶点之一。
一项 Ⅰ 期研究 [3] 使用 MLSN CAR-T 治疗了 6 例胰腺癌患者,结果 3 例患者达到 SD,1 例患者肿瘤活性下降 69.2%,2 例患者 PFS 分别延长了 3.8 个月和 5.4 个月。同时,一项临床前研究 [4] 发现,靶向 MSLN 的 CAR-T 细胞可以通过分泌抗 FAP 和 CD3 分子来调节肿瘤基质微环境,进一步产生更强的抗胰腺癌活性。癌胚抗原相关细胞黏附分子(CEACAMs)
CEACAMs 是一类细胞表面糖蛋白家族,存在于上皮组织、内皮细胞和血细胞中,在多种上皮性肿瘤中广泛高表达,包括结直肠癌、胃癌、胰腺癌、卵巢癌和肺癌等。其中 CEA、CEACAM1、CEACAM5、CEACAM6、CEACAM7 亚家族与肿瘤发生发展最为密切,如 CEA 是临床常用的肿瘤标志物,也是治疗的潜在靶点之一。
早期临床前研究显示,CEACAM7 在胰腺癌组织中高表达,并且在临床前肿瘤模型中针对 CEACAM7 的 CAR-T 细胞显示出良好的抗肿瘤活性 [5] 。也有研究正在探索靶向 CEACAM5/6 和 CD3 的双特异性抗体并已观察到其较强的抗肿瘤活性 [6] 。T 细胞受体工程 T 细胞治疗(TCR-T)
除了 CAR-T 细胞疗法外,T 细胞受体工程 T 细胞治疗(TCR-T)是近年来抗肿瘤治疗领域备受关注的新手段,它将外源性 TCR 引入患者的 T 细胞中,能够显著提高 T 细胞对肿瘤抗原的特异性识别能力,精准识别和杀伤肿瘤细胞。
早在 2022 年,NEJM 发表的一种新型免疫疗法 TCR-T 在业界引起广泛轰动。一例携带 KRAS G12D 突变的晚期转移性胰腺癌患者单次输注了 16.2×10 9 个 TCR-T 细胞,一个月后患者的内脏转移逐渐消退,总体疗效为 62%;随后反应持续 6 个月,总体疗效达 72% [7] 。可见 TCR-T 疗法治疗胰腺癌的疗效非常显著。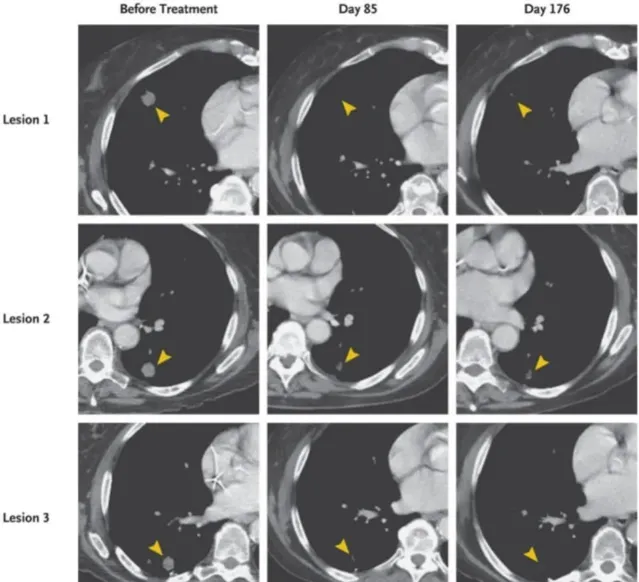
ELI-002 2P 疫苗
ELI-002 2P 是美国研发的一种新型的淋巴结靶向癌症疫苗,可特异性识别 KRAS G12D 和 G12R 双突变,主要用于经局部治疗后仍存在分子残留病灶(MRD)的高复发风险胰腺癌和结直肠癌,以降低肿瘤复发的可能性。
其 I 期 AMPLIFY201 研究 [9] 共纳入 20 例胰腺癌和 5 例结直肠癌患者,均为经过手术或化疗后仍有 MRD 残留的高复发风险者。结果显示,使用 ELI-002 2P 疫苗 6 个月后,21 例(84%)患者观察到 T 细胞应答,中位无复发生存期(RFS)为 16.33 个月。高于中位 T 细胞应答水平的患者显示出更好的肿瘤生物标志物反应和 RFS。特别是在肿瘤生物标志物反应方面,84% 的患者(21/25)观察到肿瘤生物标志物下降,其中 44%(11/25)下降 ≥30%,32%(8/25)下降 ≥50%;更重要的是,24%(6/25,胰腺癌和结直肠癌各 3 例)患者通过 ctDNA 检测观察到肿瘤生物标志物被完全清除。由于 AMPLIFY201 研究的惊人结果,目前相关 Ⅱ 期研究正在进行中。
mRNA 疫苗
mRNA 疫苗的作用机制是将 RNA 在体外进行相关修饰后传递至机体细胞内表达并产生蛋白抗原,从而激活机体的免疫系统,识别和攻击肿瘤细胞。新冠疫苗正是典型的 mRNA 疫苗,促进了抗肿瘤 mRNA 疫苗的研发。
2023 年 5 月发表在 Nature 杂志上的一篇题为 Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer [10] 的文章介绍了一种个性化的 mRNA 新抗原疫苗(autogene cevumeran)及其在胰腺癌中的疗效。该疫苗通过 mRNA 表达从胰腺癌患者肿瘤中识别出的至多 20 个独特的新抗原,在本研究中通过与 mFOLFIRINOX 标准化疗及阿替利珠单抗联合使用治疗经手术切除后的胰腺癌患者。在纳入的 16 例患者中,8 例(50%)患者观察到了明显的 T 细胞反应。中位随访 18 个月后,与无应答者相比,应答者的中位 RFS 更长(未达到 vs 13.4 个月)。双抗免疫治疗
由于胰腺癌特殊的免疫抑制微环境,当前各类以 PD-1/PD-L1、CTLA-4 为靶点的免疫检查点抑制剂单药治疗均在胰腺癌中响应不佳,而近年来免疫联合治疗表现出独特的优势。
卡度尼利单抗是全球首个 PD-1/CTLA-4 双特异性抗体,在多种肿瘤中疗效显著,目前已获批适用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗,同时也在全球范围内开展了针对多个瘤种的多项研究,如卡度尼利单抗联合化疗一线治疗不可手术切除的局部晚期或转移性胰腺癌的Ⅱ期研究(CTR20230810)。
由于趋化因子受体 2 和趋化因子受体 5(CCR2 和 CCR5)是骨髓细胞迁移到非造血器官和组织中的重要介质。近年来,靶向 CCR2/CCR5 的双重抑制剂可显著抑制肿瘤相关巨噬细胞活性,在胶质瘤免疫治疗中展现出巨大潜力。而胰腺癌由于独特的免疫抑制微环境,存在大量的调节性 T 细胞(Tregs)、前肿瘤 M2 样巨噬细胞和骨髓细胞等免疫抑制细胞。目前也有研究正在探索纳武利尤单抗和 CCR2/CCR5 双抗(BMS-813160)联合或不联合 GVAX 疫苗治疗局部晚期胰腺癌的 I 期研究,初步显示出抗肿瘤活性。
小结
尽管目前的免疫检查点抑制剂在胰腺癌中的疗效欠佳,但是基于肿瘤免疫治疗的新策略,如新靶点、新型免疫检查点抑制剂、mRNA 疫苗以及免疫联合疗法均显示出巨大的潜力,有望为胰腺癌患者提供新的治疗选择。
专家简介

周军 教授
北京大学肿瘤医院
● 北京大学肿瘤医院消化内科 主任医师
参考文献
[1] Gregory P Botta, et al. CLDN18.2 chimeric antigen receptor T cell therapy for patients with advanced gastric and pancreatic adenocarcinoma: Results of ELIMYN18.2 phase 1b clinical trial. 2024, ASCO GI, Abstract 356.
[2] Qi C, Zhang P, Liu C, et al. Safety and Efficacy of CT041 in Patients With Refractory Metastatic Pancreatic Cancer: A Pooled Analysis of Two Early-Phase Trials. J Clin Oncol. 2024 May 24:JCO2302314.
[3] Beatty GL, O'Hara MH, Lacey SF, et al. Activity of Mesothelin-Specific Chimeric Antigen Receptor T Cells Against Pancreatic Carcinoma Metastases in a Phase 1 Trial. Gastroenterology. 2018 Jul;155(1):29-32.
[4] Wehrli M, Guinn S, Birocchi F, et al. Mesothelin CAR T Cells Secreting Anti-FAP/Anti-CD3 Molecules Efficiently Target Pancreatic Adenocarcinoma and its Stroma. Clin Cancer Res. 2024 May 1;30(9):1859-1877.
[5] Raj D, Nikolaidi M, Garces I, et al. CEACAM7 Is an Effective Target for CAR T-cell Therapy of Pancreatic Ductal Adenocarcinoma. Clin Cancer Res. 2021 Mar 1;27(5):1538-1552.
[6] Liand Chen, et al. A bispecific T cell engager targeting CEACAM-5/6 exhibits strong anti-tumor efficacy in pre-clinical studies. 2022, AACR, Abstract 5554.
[7] Leidner R, Sanjuan Silva N, Huang H, et al. Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer. N Engl J Med. 2022 Jun 2;386(22):2112-2119.
[8] Ivics Z, Hackett PB, Plasterk RH, et al. Molecular reconstruction of Sleeping Beauty, a Tc1-like transposon from fish, and its transposition in human cells. Cell. 1997 Nov 14;91(4):501-10.
[9] Pant S, Wainberg ZA, Weekes CD, et al. Lymph-node-targeted, mKRAS-specific amphiphile vaccine in pancreatic and colorectal cancer: the phase 1 AMPLIFY-201 trial. Nat Med. 2024 Feb;30(2):531-542.
[10] Rojas LA, Sethna Z, Soares KC, et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature. 2023 Jun;618(7963):144-150.
编辑:lsh;题图:丁香园创意团队











