代谢异常是肿瘤细胞的重要特征之一,与肿瘤发生发展密切相关,是肿瘤治疗的潜在靶点。其中, 丝氨酸 从头合成途径 是糖酵解代谢的关键代谢旁路,通过磷酸甘油脱氢酶(PHGDH)等数个代谢酶的催化作用将糖酵解中间产物3-磷酸甘油酸转化为丝氨酸和甘氨酸,进而介导一碳代谢,为肿瘤细胞快速增殖提供物质和能量基础,同时产生还原力维持肿瘤细胞内氧化还原稳态。
2023年2月, 四川大学华西基础医学与法医学院黄灿华教授 (第一作者为同单位王魁研究员)和 四川大学生物治疗国家重点实验室魏霞蔚研究员团队 证实了PHGDH在肝癌中显著下调,但其酶活却由于蛋白精氨酸甲基转移酶1 (PRMT1)介导的精氨酸甲基化而代偿性增强,通过加速丝氨酸代谢缓解氧化应激压力,促进肝癌生长。 景杰生物为该研究提供了IP-MS技术支持 。该成果发表于 Nature Communications (IF=14.7)上。然而,PRMT1的上调机制以及PRMT1- PHGDH轴的调控机制尚不清楚[1]。
在上述研究基础上,2024年6月5日, 四川大学华西基础医学与法医学院王魁研究员 和 华西公共卫生学院/华西第四医院蒋静文副研究员 团队在 Nature Communications (IF=14.7)发表了题为「 FBXO7 ubiquitinates PRMT1 to suppress serine synthesis and tumor growth in hepatocellular carcinoma 」的研究论文。该研究运用 蛋白质组学技术 、 泛素化修饰位点鉴定技术 发现E3泛素连接酶FBXO7通过泛素化促进PRMT1降解,从而削弱PHGDH精氨酸甲基化和激活,导致丝氨酸合成受损,活性氧(ROS)积累,最终抑制HCC细胞生长。本研究为FBXO7-PRMT1-PHGDH轴对癌症丝氨酸合成的调控提供了新的机制见解,并促进了丝氨酸靶向癌症治疗策略的发展。 景杰生物为该研究提供了蛋白质组学技术、泛素化修饰位点鉴定以及泛素化抗体支持 。

1. FBXO7通过泛素化修饰下调了肝癌细胞中PRMT1的蛋白水平
已有研究表明,PRMT1的蛋白水平在肝细胞癌中显著上调。然而,肝细胞癌组织PRMT1的mRNA水平并没有显著变化,因此作者推测PRMT1的上调可能是由其泛素化修饰水平变化来介导的。接着,作者通过公共数据库筛选出了与PRMT1蛋白互作并且与HCC患者预后良好相关的E3泛素连接酶FBXO7。此外,作者也利用 蛋白质组学 进一步确定PRMT1的互作蛋白, 发现FBXO7是前10个与PRMT1相互作用的候选蛋白中唯一的E3泛素连接酶 。接下来作者通过免疫共沉淀、GST-pulldown等实验证实了FBXO7与PRMT1的直接相互作用,且 FBXO7在肝癌细胞中是通过泛素依赖的降解途径来调控PRMT1的蛋白水平 。
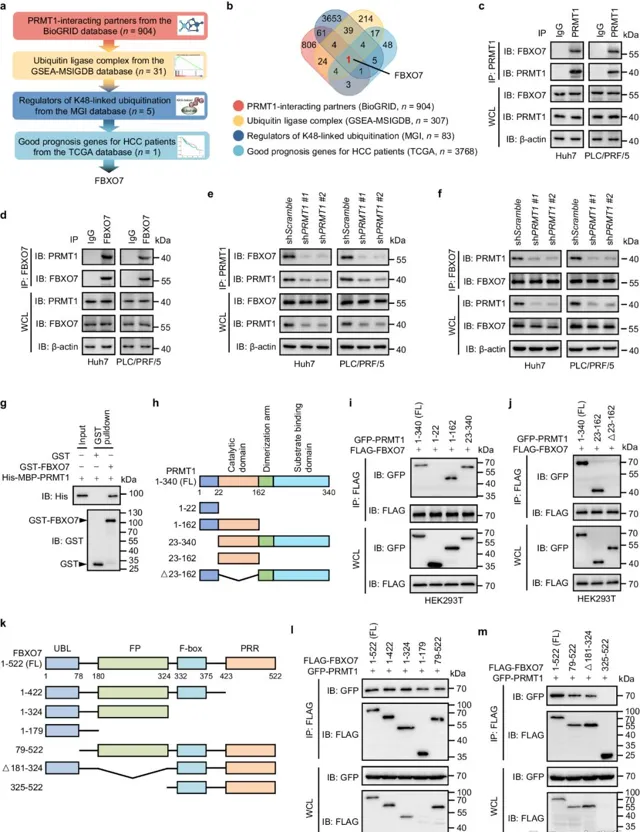
图1 PRMT1与E3泛素连接酶Fbxo7相互作用
2. Fbxo7介导肝癌细胞中PRMT1赖氨酸37位发生泛素化修饰
接下来作者利用 基于质谱的泛素化位点鉴定技术 手段确定了PRMT1的四个潜在泛素化位点(K37、K82、K202、K325),然后利用点突变 (将这些赖氨酸残基突变为精氨酸)和蛋白质稳定性检测,确定了 FBXO7主要是通过催化PRMT1的K37位点泛素化修饰来调节PRMT1蛋白的稳定性 。
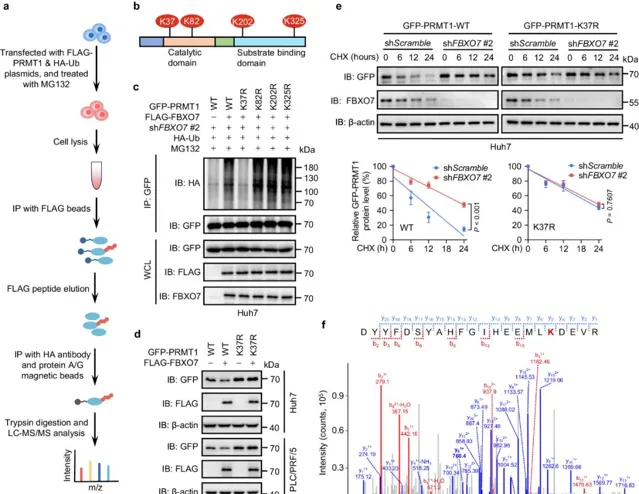
图2 FBXO7 介导 HCC 细胞中PRMT1的K37发生泛素化修饰
3. FBXO7通过参与PRMT1- PHGDH轴来影响肝癌细胞丝氨酸合成以及氧化应激
该团队前期研究表明,肝癌中PRMT1上调导致PHGDH的R236甲基化水平上调并导致PRMT1被过度激活,以促进丝氨酸的合成并维持肝癌生长的氧化还原动态平衡。为了确定FBXO7是否在其中发挥关键作用,作者进行了细胞敲除/过表达等一系列分子实验,发现 肝癌细胞中FBXO7能够通过下调PRMT1表达来抑制PHGDH R236 的甲基化修饰以及其催化活性 。此外,作者还发现 FBXO7下调PRMT1后能进一步抑制肝癌细胞丝氨酸合成并诱导氧化应激 。

图3 FBXO7通过下调PRMT1蛋白水平来抑制PHGDH甲基化和活性
4. FBXO7的表型验证及其临床相关性
接下来,作者利用细胞实验和异种移植小鼠模型验证了FBXO7能够通过下调PRMT1来抑制PHGDH甲基化和HCC细胞的生长。此外,为了研究FBXO7的临床相关性,作者通过免疫组化实验分析了45对人类HCC样本,发现与正常相邻组织相比,HCC组织中FBXO7蛋白水平下调,而PRMT1蛋白水平和PHGDH R236单甲基化水平上调,且FBXO7蛋白水平与PRMT1蛋白水平和PHGDH R236甲基化水平呈负相关;免疫共沉淀分析显示,FBXO7与PRMT1在六个人类HCC组织中相互作用,且这种相互作用水平与PRMT1的泛素化水平呈正相关;此外,使用KM plotter数据库分析HCC患者的生存率,发现FBXO7水平较高的患者其总体生存期和进展无病生存期更长。这些发现表明, FBXO7在人肝癌中的下调是PRMT1介导的PHGDH R236单甲基化和活性上调的主要机制 。
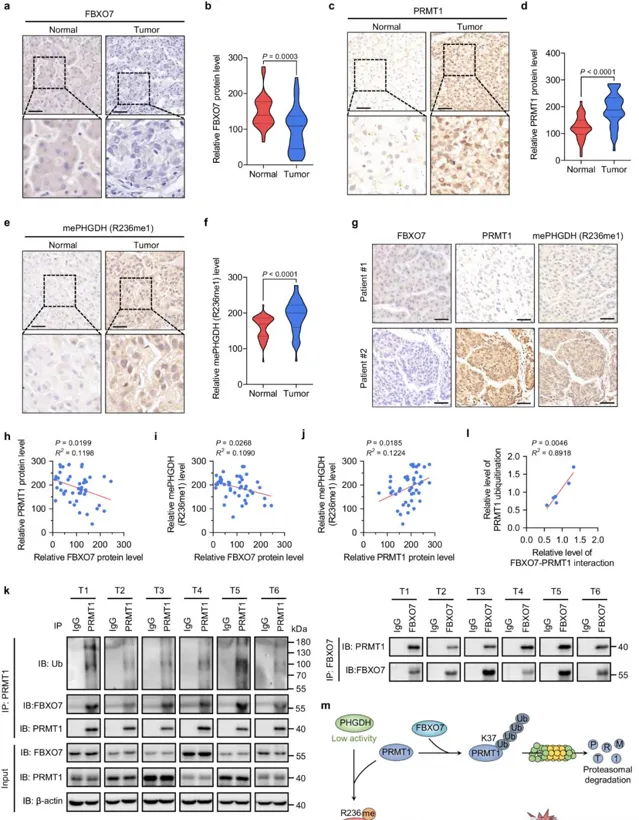
图4 FBXO7蛋白水平与HCC组织中的PRMT1蛋白水平及PHGDH精氨酸甲基化呈负相关
综上所述,该研究运用 蛋白组学 和 泛素化修饰位点鉴定技术 , 揭示了FBXO7-PRMT1-PHGDH轴在肝细胞癌丝氨酸代谢调节中的关键机制 。作为一种E3泛素连接酶,FBXO7直接与PRMT1相互作用,导致PRMT1 的K37位发生泛素化,进而导致其发生泛素-蛋白酶体途径的降解。FBXO7介导的PRMT1降解阻止了PHGDH甲基化和激活,从而抑制丝氨酸合成,加剧氧化应激,并抑制肝癌在体外和体内的生长。
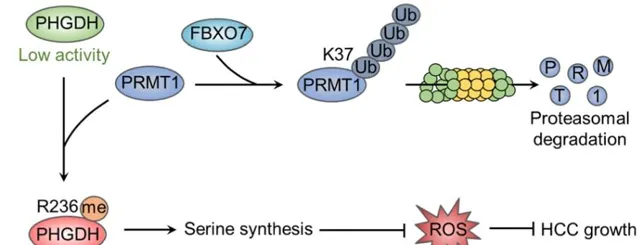
图5 FBXO7-PRMT1-PHGDH轴调控丝氨酸合成、氧化应激和肝细胞癌生长机制示意图
景杰评述
由此可见, 本研究是对2023年王魁研究员(一作)[1] 揭示PRMT1介导的PHGDH精氨酸甲基化促进了丝氨酸合成的又一延续性工作 ,运用 蛋白组 鉴定并验证了PRMT1上游调控因子FBXO7与其的互作,并运用 泛素化修 饰位点鉴定技术 及分子验证等实验,证实了FBXO7介导PRMT1 的K37位发生泛素化,进而导致其泛素化降解,最终串联了FBXO7-PRMT1-PHGDH轴在肝细胞癌丝氨酸代谢调节中的机制。这提示我们,蛋白质组学和翻译后修饰组学在解码复杂生物学和实现精准医学方面提供了更强大的能力。同时二者的结合,为深入探索生物学的复杂性提供了强有力的工具。不仅能够揭示蛋白质的表达模式,还能细致地分析蛋白质功能的变化,有助于识别疾病标志物、理解病理机制,并为个性化治疗方案的设计提供依据。总之,这种串联的研究思路和策略值得我们借鉴。











