作者:朱桂军
来源:重症学习
导读:
ARDS全球新定义已经发布,增加了敏感性,但特异性进一步下降。如果我们需要重新定义ARDS,我们应该知道些什么?本文给你提示和思考。
重新定义ARDS:范式转变
摘要
尽管「急性呼吸窘迫综合症」(ARDS)的定义要素已被认识了一个多世纪,但该综合征首次被描述是在1967年。此后,尽管对其概念定义进行了几次修订,但ARDS是否为一种离散的疾病分类学实体仍存在争议。经过近60年的发展,现在有必要研究重症治疗如何模拟这一令人着迷的综合征并影响患者结局。鉴于ARDS的诊断标准(如肺血管通透性增加和弥漫性肺泡损伤)在临床实践中难以确定,我们认为,将ARDS肺内和肺外受累的评估标准化将是向前迈出的一步,以确保每个患者都能得到最适当和有效的治疗。基于任意范围的PaO 2 /FiO 2 选择治疗方案对个体化患者监护缺乏足够的敏感性。
关键词: 急性呼吸窘迫综合症,定义,急性低氧性呼吸衰竭,机械通气,标准化,分层,预后,临床试验
ARDS定义的问题
临床简介
患者因继发于尿路感染的脓毒症恶化而住院,出现呼吸困难、低氧血症和呼吸努力增加,影像学证据显示新的弥漫性肺浸润。患者被转至重症监护病房(ICU),临床医师开始给予经鼻高流量氧疗(HFNO)。几小时后,尽管HFNO为50 L/min,呼吸功仍然升高,SpO 2 仍为90%。因此,患者插管并连接机械通气(MV),潮气量(VT)为7 ml/kg预计体重(PBW),呼气末正压(PEEP)为12 cmH 2 O。当FiO 2 为0.5 (PaO 2 /FiO 2 比值为320 mmHg)时,患者的PaO 2 升至160 mmHg。给予抗生素、补液和浅镇静后,病情迅速好转。患者MV 50 h后成功拔管,几天后出院。
病例讨论
该患者是否患有急性呼吸窘迫综合症(ARDS)?根据目前的柏林定义 [1] ,该患者符合中/重度ARDS的标准,这是基于症状的急性程度、双肺浸润的影像学证据和接受HFNO治疗时的初始SpO 2 /FiO 2 比值。然而,患者在MV仅几小时后就不再符合诊断性气体交换标准。如此快速的恢复与ARDS的自然史在概念上不一致。 本病例强调了目前ARDS定义及其管理的几个主要问题。首先,PaO 2 /FiO 2 比值在很大程度上是呼吸机设置的函数 [2] 。其次,如果临床医师选择PEEP<12 cmH 2 O, MV时的PaO 2 /FiO 2 比值可能会低于150 mmHg。这一比例可能促使临床医师增加呼吸支持,从而使用神经肌肉阻断剂或采用俯卧位。使用这些技术的明显「需要」可能会延迟患者的脱机和拔管,同时增加医源性并发症的风险。入院时,在任何治疗优化之前,尤其是在PEEP相对较低的情况下(如柏林定义 [1] ),单次测定PaO 2 /FiO 2 对预测ARDS严重程度的性能较差 [3] (表1)。

背景
随后被确定为ARDS的疾病在一个多世纪前已为人所知,但对这种异质性肺疾病的第一个概要描述发表于1967年 [4] 。临床特征包括严重呼吸困难,低氧血症,肺顺应性下降,胸片上弥漫性肺泡浸润,心源性肺水肿已被排除。自第一次描述以来,ARDS的定义被多次修订,而许多研究者和临床医师质疑其是否作为一个独立的实体存在 [1,5 - 7] 。每次修订 [1,6,7] 的作者通过指出以前定义中的缺陷来证明他们选择的标准,并保证「新」定义将能够解决过去的缺点。
每种定义均使用PaO 2 /FiO 2 比值作为建立综合征诊断和严重程度的主要定义标准。PaO 2 是衡量ARDS氧合状态最直接的指标,但AECC和柏林定义均以PaO 2 /FiO 2 比值表示 [1,7] 。目前尚无数据将FiO 2 与各种通气设置和模式下的PaO 2 与诊断为ARDS时可预测的肺泡-毛细血管膜结构变化或弥漫性肺泡损伤(DAD)的程度相关联。相反,最近有证据表明,在标准化通气设置下测定PaO 2 时,肺损伤的严重程度与预后相关。其他影响PaO 2 / FiO 2 比值的因素包括心输出量、肺内分流率、代谢率和血红蛋白浓度 [9] 。因此,如果PaO 2 /FiO 2 比值对ARDS的定义及其管理至关重要,那么应该主张,应拒绝将临床决策停留在一个明确标准设定之外的单一数值上。基于标准的定义有如此重大的局限性,其基本问题是,将其应用于临床可能会影响患者接受的治疗,或如果把他们被纳入临床试验 [11] ,特别是许多在标准重症监护24小时后改善的低氧血症患者 [3,10] 。
伪ARDS场景
各种类型的肺和全身损伤可导致共同的病理生理反应 [12] 。无论确切机制如何,ARDS的典型解剖病理特征是DAD [13] 。一般而言,将发病机制视为两种不同途径的结果是有益的:肺泡细胞的直接损伤和内皮细胞的间接损伤(急性全身性炎症反应)。DAD早期渗出期的特征是炎症和富含蛋白质的水肿 [13] ,如果炎症持续存在,可导致肺不张和结构破坏。最终,这些变化演变为毛细血管血栓形成、肺纤维化和新生血管形成的纤维增殖期。尽管有通气和体外器官支持,大多数ARDS患者仍在这一阶段死亡。
尽管没有典型的ARDS患者,但很可能在所有患者中都存在DAD,尽管有报告显示,在符合ARDS柏林标准的患者中,有相当比例的尸体解剖中没有DAD [14] 。这可能是分类错误的结果,如在这些报告中,肺活检是在ARDS发病和/或治疗开始后数天或数周进行,而病理学研究缺乏随机化,因此难以确定临床和病理学结果之间的相关性。此外,我们还采集了与DAD [15] 进行临床病理比较的肺组织样本,这些肺组织样本来自于具有损伤性MV设置的患者,VT高达16 ml/kg实际体重 [16] 或PEEP为0 ~ 5 cmH 2 O(大多数患者 [17] )。明确诊断ARDS(肺血管通透性增加和DAD)所需的标准难以纳入临床实践。 在未来的ARDS定义中,可能需要床旁血管通透性的简单测量方法,如血管外肺水,以识别ARDS,但在预测DAD出现之前肺血管通透性必须异常到何种程度尚不清楚 [8] 。
如果考虑到ICU中液体超负荷、双侧胸腔积液和双侧肺不张的普遍情况,许多形式的急性低氧血症性呼吸衰竭与ARDS相似,但无DAD [18] 。有这些特征的患者可能符合柏林定义,但其总体结局通常优于真正的ARDS。纳入快速改善的ARDS或假性ARDS患者可能导致治疗性临床试验的失败 [19] ,这为利用生理富集来克服这一问题的研究铺平了道路 [2] 。肺叶实变引起的严重低氧血症常被作为ARDS治疗,而特定的治疗方案可能会使这些患者获益,而他们的未患病肺可能不会发生呼吸机相关性肺损伤(VILI) [20] 。
低氧血症问题
ARDS支持性治疗的一个组成部分是呼吸支持的应用,其目的是在不进一步损害肺的情况下实现充分的气体交换和组织氧合[20]。MV的使用对大多数ARDS患者至关重要,但在过去10年中,有轻或中度肺损伤的ARDS患者已在不进行气管插管的情况下得到成功治疗,柏林定义 [1] 和最近的指南 [1 1 ] 都承认了这一点。
我们猜测PaO 2 /FiO 2 比值将不会从未来的ARDS定义中去除。值得注意的是, 标准化的FiO 2 和PEEP水平从来都不是MV下定义低氧血症的条件。 在符合ARDS标准的患者中,在PEEP≥10 cmH 2 O、FiO 2 ≥0.5持续30 min的24 h评估可使PaO 2 /FiO 2 比值升高,超过1 / 3的患者不再符合ARDS标准 [3] 。此外,对于接受无创通气或HFNO的患者,即使有可能,也很难确定确切的FiO 2 。我们怀疑, 除非使用标准化通气设置进行评估或计算,否则任何用于ARDS分类和预后预测的氧合指数都不能用于临床决策 [21,22] 。 在该定义的最新迭代中,一些作者提出使用SpO 2 /FiO 2 比值,主要考虑到资源受限的环境,动脉血气分析可能难以或不可能实施 [11] 。遗憾的是,SpO 2 受几个变量的影响 [23] ,如温度、pH值、PaCO 2 、2,3二磷酸甘油酸浓度和碳氧血红蛋白的变化,其测量受种族的影响 [24] ,但这些变量均不影响PaO 2 。SpO 2 / FiO 2 比值包含了PaO 2 /FiO 2 比值的所有问题,增加了患者去饱和时SpO 2 与SaO 2 的95%可信区间为±5%,PaO 2 值可能出现波动的问题,当SpO 2 ≥97%时PaO 2 /FiO 2 为300 mmHg。
在欧洲合作研究 [25] 中,PaO 2 /FiO 2 <150 mmHg患者的24 h死亡率几乎是PaO 2 /FiO 2 ≥150 mmHg患者的2倍。最近的三项临床试验使用了在PEEP≥5 [26,27] 或≥8 cmH 2 O [28] 时,PaO 2 /FiO 2 <150 mmHg的数值来纳入诊断ARDS的第一个24-48小时内的患者。在最近的临床试验中,相当一部分患者的肺损伤严重程度是中等的,这似乎是合理的。如果患者需要预防的疾病风险低,任何试验都不会验证研究中的干预措施的价值 [29] 。在一项对1303例的中/重度ARDS患者的研究 [2] 中,近一半的患者在24 h时PaO 2 /FiO 2 ≥150 mmHg,其ICU病死率约为20%,而PaO 2 /FiO 2 <150 mmHg的ICU病死率大于45%。在新的更新的ARDS分类中,可能会纳入新的PaO 2 /FiO 2 阈值(表2)。

未来的发展方向
我们认为应更加谨慎地使用ARDS这一术语。正如重症领域专家建议的那样,我们认为当前基于ARDS的疾病框架应该重新考虑 [30] 。临床医师应该对操作性定义标准感兴趣,这些标准可以触发使用具有高概率改善结局的治疗(表2)。为了准确量化ARDS的严重程度,理想情况下我们需要两个严重程度指数:一个衡量肺损伤本身的严重程度,另一个衡量患者整体疾病的总体严重程度,然后量化ARDS发生的环境 [8,31] 。如果没有这些指标,也没有了解特定病因对结局的影响(图1),任何新的ARDS更新定义都将是对相同缺点的不断重复,自第一次描述 [32] 以来没有实质性进展。将ARDS患者细分为不同严重程度或可改变的病理生理过程代表了ARDS精准医学的最关键进展。它为确定哪些患者对治疗不敏感,哪些患者应该成为积极和创新疗法的靶点,哪些患者可以避免气管插管和MV,哪些患者应该从一些临床试验中去除提供了理论依据 [33 - 35] 。迄今为止,大多数关于ARDS亚表型的研究都是基于回顾性分析 [36] ,目前尚不清楚这些患者的亚型代表了病因学基础疾病的分类还是ARDS本身的分类 [30,37] 。即使有这一警告,仍有可能结合从肺部影像学和肺/全身生物标志物获得的信息,对ARDS进行个体化管理 [38] 。
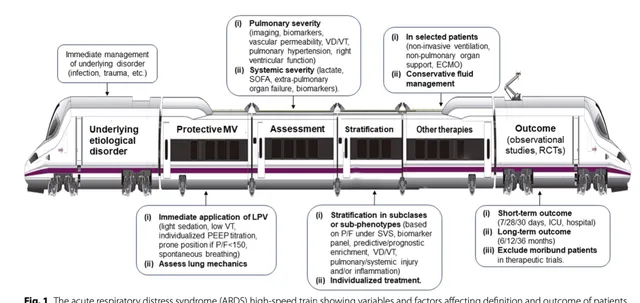
ARDS常伴有血流动力学不稳定,是死亡的主要决定因素之一。对于需要准确评估心血管状况的患者,有创血流动力学监测有其应用价值,但具体监测应个体化。ARDS的血管改变包括肺血管收缩和血管扩张,导致血流分布不良、肺动脉高压和右心室功能障碍 [39,40] 。ARDS患者的静脉补液和血管加压药管理是一项关键挑战和首要研究重点。应考虑ARDS各阶段的风险和获益,并促进液体清除。如最近的一项研究所报告,与机器学习(ML)模型 [41] 的建议相比,临床医师施用的液体剂量较大,血管升压药剂量较小。值得注意的是,接受与ML模型推荐剂量相似的剂量的患者死亡率最低。
应更加重视二氧化碳(CO2)和死腔(VD/VT)在判断疾病严重程度中的作用[42]。VD/VT或通气浪费(VT中不参与气体交换的部分)不包括在任何ARDS定义中(表1)。VD/VT升高与存活出院的概率较低相关 [43,44] 。由于缺乏关于肺血管循环解剖状态的精确信息,因此难以建立合理的ARDS分层标准和启动特异性治疗。呼出气CO 2 动力学分析为临床评估、监测和管理机械通气ARDS患者提供了重要的无创心肺信息。VD/VT概念在临床上不仅可以评估和调整MV期间的肺泡通气,还可以检测肺泡过度扩张 [42] 。
我们尚不清楚与控制性MV加镇静和俯卧位相比,ARDS患者早期采用自主通气是否能改善预后 [445,46] 。在治疗ARDS时,基础疾病会导致高呼吸驱动,因此应在插管后立即处理。一旦出现一些改善,尽早允许自主呼吸可缩短MV持续时间。早期自主呼吸允许使用高水平的PEEP来预防肺不张损伤和炎症,从而促进肺的愈合。
最后,未来的研究应关注ARDS的精准医疗,借鉴可治疗特征的概念 [30] 。我们需要临床试验来比较当前的管理与精准医学衍生的管理。目前还没有工具可以实现ARDS的个性化治疗,并在床旁实时协助临床医师做出决策。ML模型预测ICU死亡率的特征表明,它们在临床上是可解释的,主要依赖于敏感的临床和生物学参数 [31] 。
参考文献:
1.Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. Acute respiratory distress syndrome: the Berlin definition. JAMA. 2012;307:2526–33.
2.Villar J, Fernández C, González‐Martín JM, Ferrando C, Añón JM, del Saz‐ Ortiz AM, Díaz‐Lamas A, Bueno‐González A, Fernández L, Domínguez‐ Berrot AM, et al. Respiratory subsets in patients with moderate‐to‐severe acute respiratory distress syndrome from early prediction of death. J Clin Med. 2022;11:5724.
3.Villar J, Blanco J, del Campo R, Andaluz‐Ojeda D, Díaz –Domínguez FJ, Muriel A, Córcoles V, Suárez‐Sipman F, Tarancón C, González‐Higueras E, et al. Assessment of PaO2/FiO2 for stratification of patients with moderate and severe acute respiratory distress syndrome. BMJ Open; 5: e006812.
4.Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress syndrome in adults. Lancet. 1967;2:319–23.
5.Effros RM, Mason GR. An end to 「ARDS.」 Chest. 1986;89:162–3.
6.Murray JF, Matthay MA, Luce JM, Flick MR. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1988;138:720–3.
7.Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, Lamy M, Legall JR, Morris A, Spragg R. The American‐European consensus confer‐ ence on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994;149:818–24.
8.Schuster DP. What is acute lung injury? What is ARDS? Chest. 1995;107:1721–6.
9.Gattinoni L, Vassalli F, Romitti F. Benefits and risks of the P/F approach. Intensive Care Med. 2018;44:2245–7.
10.Villar J, Pérez‐Méndez L, Kacmarek RM. The Berlin definition met our needs: no. Intensive Care Med. 2015;42:648–50.
11.Grasselli G, Calfee CS, Camporota L, Poole D, Amato MBP, Antonelli M, Arabi YM. Baroncelli F, Beitler JR, Bellani G, et al; European Society of Intensive Care Medicine taskforce on ARDS ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies. Intensive Care Med 2023; 49:727–59.
12.Petty TL. The adult respiratory distress syndrome. Confessions of a 「lumper.」 Am Rev Respir Dis. 1975;111:713–5.
13.Tomashefsky JF Jr. Pulmonary pathology of acute respiratory distress syndrome. Clin Chest Med. 2000;21:435–66.
14.Thille AW, Esteban A, Fernández‐Segoviano P, Rodríguez JM, Aramburu JA, Peñuelas O, Cortés‐Puch I, Cardinal‐Fernández P, Lorente JA, Frutos‐ Vivar F. Comparison of the Berlin definition for acute respiratory distress syndrome with autopsy. Am J Respir Crit Care Med. 2013;187:761–7.
15.De Hemptinne Q, Remmelink M, Brimioulle S, Salmon I, Vincent JL. ARDS: a clinicopathological confrontation. Chest. 2009;135:944–9.
16.Suter PM, Fairley HB, Isenberg MD. Optimum end‐expiratory pressure in patients with acute pulmonary failure. N Engl J Med. 1975;292:284–9.
17.Esteban A, Anzueto A, Alia I, Gordo F, Apezteguía C, Palizas F, Cide D, Goldwaser R, Soto L, Bugedo G, Rodrigo C, Pimentel J, Raimondi G, Tobin MJ. How is mechanical ventilation employed in the intensive care unit? An international utilization review. Am J Respir Crit Care Med. 2000;161:1450–8.
18.Villar J, Mora‐Ordoñez JM, Soler JA, Mosteiro F, Vidal A, Ambros A, Fernández L, Murcia I, Civantos B, Romera MA, et al. The PANDORA study: prevalence and outcome of acute hypoxemic respiratory failure in the pre‐COVID era. Crit Care Expl. 2022;4: e0684.
19.Schenck EJ, Oromendia C, Torres LK, Berlin DA, Choi AMK, Siempos II. Rap‐ idly improving ARDS in therapeutic randomized controlled trials. Chest. 2019;155:474–82.
20.Slutsky AS. History of mechanical ventilation. From Vesalius to ventilator‐ induced lung injury. Am J Respir Crit Care Med. 2015;191:1106–15.
21.Kacmarek RM, Berra L. Prediction of ARDS outcome: what tool should I use? Lancet Respir Med. 2018;6:253–4.
22.Morris AH, Stagg B, Lanspa M, Orme J, Clemmer TP, Weaver LK, Thomas
F, Grissom CK, Hirshberg E, East TD, et al. Enabling a learning healthcare system with automated computer protocols that produce replicable and personalized clinical actions. J Am Med Inform Assoc. 2021;28:1330–44.
23.Severinghaus JW. Simple, accurate equations for human blood O2 dis‐ sociation computations. J Appl Physiol. 1979;46:599–602.
24.Cabanas AM, Fuentes‐Guajardo M, Latorre K, León D, Martín‐Escudero P. Skin pigmentation influence on pulse oximetry accuracy: a systematic review and bibliometric analysis. Sensors. 2022;22:3402.
25.Artigas A, Carlet J, LeGall JR, Chastang C, Blanch L, Fernández R. Clinical presentation, prognostic factors and outcome of ARDS in the European Collaborative Study (1985–1987). A preliminary report. In: Adult respira‐ tory distress syndrome. Zapol WM, Lemaire F (Eds.). New York, Dekker, 1991, pp 37–64.
26.Guérin C, Reignier J, Richard JC, Beuret P, Gacouin A, Boulain T, Mercier E, Badet M, Mercat A, Baudin O, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368:2159–68.
27.Papazian L, Forel JM, Gacouin A, Penot‐Ragon C, Perrin G, Loundou A, Jaber S, Arnal JM, Pérez D, Seghboyan JM, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363:1107–16.
28.The National Heart, Lung, and Blood Institute Petal Clinical Trials Network, Moss M, Huang D, Brower RG, Ferguson ND, Ginde AA, Gong MN, Grissom CK, Gundel S, Hayden D, Hite RD, et al. Early neuromuscular blockade in the acute respiratory distress syndrome. N Engl J Med 2019; 380:1997–2008.
29.Villar J, Pérez‐Méndez L, Aguirre‐Jaime A, Kacmarek RM. Why are physi‐ cians so skeptical about positive randomized controlled trials in critical care medicine? Intensive Care Med. 2005;31:196–204.
30.Maslove DM, Tang B, Shankar‐Hari M, Lawler PR, Angus DC, Baillie JK, Baron RM, Bauer M, Buchman TG, Calfee CS, et al. Redefining critical ill‐ ness. Nature Med. 2022;28:1141–8.
31.Villar J, González‐Martin JM, Hernández‐González J, Armengol MA, Fernández C, Martín‐Rodríguez C, Mosteiro F, Martínez D, Sánchez‐Balles‐ teros J, Ferrando C, et al. Predicting ICU mortality in ARDS patients using machine learning: the Postcards study. Crit Care Med. 2023. https://doi. org/10.1097/CCM.0000000000006030.
32.Tobin MJ. ARDS: hidden perils of an overburdened diagnosis. Crit Care. 2022;26:392.
33.Battaglini D, Fazzini B, Leme‐Silva P, Ferreira‐Cruz F, Ball L, Robba C, Rocco PRM, Pelosi P. Challenges in ARDS definition, management, and identifi‐ cation of effective personalized therapies. J Clin Med. 2023;12:1381.
34.Cutuli SL, Grieco DL, Michi T, Cesarano M, Rosa T, Pintaudi G, Menga LS, Ruggiero E, Giammatteo V, Bello G, et al. Personalized respiratory support in ARDS: a physiology‐to‐bedside review. J Clin Med. 2023;12:4176.
35.Pelosi P, Ball L, Barbas CSV, Bellomo R, Burns KEA, Einav S, Gattinoni L, Laf‐ fey JG, Marini JJ, Myatra SN, et al. Personalized mechanical ventilation in acute respiratory distress syndrome. Crit Care. 2021;25:250.
36.Moore AR, Pienkos SM, Sinha P, Guan J, O’Kane CM, Levitt JE, Wilson JG, Shankar‐Hari M, Matthay MA, Calfee CS, et al. Elevated plasma interleu‐ kin‐18 identifies high risk acute respiratory distress syndrome patients not distinguished by prior latent class abalysis using traditional inflamma‐ tory cytokines: a retrospective analysis of two randomized clinical trials. Crit Care Med 2023. https://doi.org/10.1097/CCM.0000000000006028
37.Chotalia M, Ali M, Alderman JE, Bansal S, Patel JM, Bangash MN, Parekh D. Cardiovascular subphenotypes in acute respiratory distress syndrome. Crit Care Med. 2023;51:460–70.
38.Abbot M, Li Y, Brochard L, Zhang H. Precision medicine using simultane‐ ous monitoring and assessment with imaging and biomarkers to man‐ age mechanical ventilation in ARDS. Intensive Care Res. 2023;3:195–203.
39.Villar J, Blazquez MA, Lublillo S, Quintana J, Manzano JL. Pulmonary hyper‐ tension in acute respiratory failure. Crit Care Med. 1989;17:523–6.
40.Vieillard‐Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ. Experts’s opinion on management of hemodynamics in ARDS patients: focus on the effects of mechanical ventilation. Intensive Care Med. 2016;42:739–49.
41.Komorowski M, Celi LA, Badawi O, Gordon AC, Faisal AA. The Artificial Intelligence Clinician learns optimal treatment strategies for sepsis in intensive care. Nature Med. 2018;24:1716–20.
42.Suárez‐Sipmann F, Villar J, Ferrando C, Sánchez‐Giralt JA, Tusman G. Moni‐ toring expired CO2 kinetics to individualize lung‐protective ventilation
in patients with the acute respiratory distress syndrome. Front Physiol. 2021;12: 785014.
43.Vender RL, Betancourt MF, Lehman EB, Harrell C, Galvan D, Frankenfield DC. Prediction equation to estimate dead space to tidal volume fraction correlates with mortality in critically ill patients. J Crit Care. 2014;29:317. e1‐317.e3.
44.Graf J, Pérez R, López R. Increased dead space could associate with coagulation activation and poor outcomes in COVID‐19 ARDS. J Crit Care. 2022;71: 154095.
45.Kacmarek RM, Villar J, Blanch L. Why use anything but a standard sponta‐ neous breathing trial to determine readiness for ventilator discontinua‐ tion? Respir Care. 2015;60:1705–7.
46.Petitjeans F, Leroy S, Pichot C, Ghignone M, Quintin L, Longrois D, Constantin JM. Improved understanding of the respiratory drive patho‐ physiology could lead to earlier spontaneous breathing in severe acute respiratory distress syndrome. Eur J Anaesthesiol Intensive Care Med 2023; 2:5(e0030)
医脉通是专业的在线医生平台,「感知世界医学脉搏,助力中国临床决策」是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。












