不久前,全球首个肠道菌辅助免疫治疗的临床试验结果新鲜出炉,20名参与研究的患者整体客观缓解率达到了65%,远超以往临床试验和真实世界中PD-1单免疫治疗的有效率。
而且,研究中发现的一个现象再次证明了肠道菌移植提高免疫治疗效果的可行性:
口服粪便胶囊1周后,所有患者的肠道菌组成都接近粪便供体;
PD-1治疗有效的患者,在口服粪便胶囊1个月和3个月后,肠道菌组成会进一步接近粪便供体;
PD-1治疗无效的患者,肠道菌组成在短暂靠近供体后,很快又会恢复成自己基线时的样子。
虽然这还并非最终的III期临床试验,但也足以让期待用肠道菌提升免疫治疗效果的患者们倍感兴奋。只不过,研究中使用的单次口服粪便胶囊的肠道菌移植方法,有些让人心理上难以接受,在生物安全上也有一定的风险。
那能不能找出粪便中的有效菌种,将「吃屎」变成「吃菌」?为此,咚咚特地整理了目前观察性研究和临床前研究中,可能具有提升免疫治疗效果的肠道菌。
双歧杆菌
双歧杆菌是一类经典的益生菌。早在1899年,法国巴斯德研究所的儿科医生Henry Tissier就从健康婴儿粪便中分离出第一种双歧杆菌——短双歧杆菌,并发现其具有治疗肠道感染性疾病的作用。现在,双歧杆菌已经成为应用最多的一种益生菌,被广泛用于腹泻、便秘等消化道病症的治疗。
而在免疫治疗中,多种双歧杆菌都被发现可以在小鼠中增强免疫治疗的效果:
● 黑色素瘤小鼠中,口服市售双歧杆菌(含有短双歧杆菌和长双歧杆菌)可使肿瘤缩小40%左右,与单独使用PD-L1抑制剂的抗肿瘤效果类似,而双歧杆菌和PD-L1联合使用能让肿瘤缩小80%[1];
● 结直肠小鼠中,移植假长双歧杆菌联合CTLA-4抑制剂相比单独使用CTLA-4抑制剂,可使肿瘤体积缩小85%[2]。
在人类患者中,也存在双歧杆菌丰度与免疫治疗效果相关的现象:
● 黑色素瘤患者中,免疫治疗有效的患者粪便富集长双歧杆菌等益生菌,将其移植给小鼠也能提高小鼠的免疫治疗效果[3];
● 接受免疫治疗的中国非小细胞肺癌患者中,短双歧杆菌阳性者客观缓解率40%,疾病控制率90%,中位无进展生存期超500天;而短双歧杆菌阴性者客观缓解率0%,疾病控制率12.5%,中位无进展生存期只有106天[4]。
双歧杆菌给免疫治疗增效的作用可能和树突状细胞 (DC) 有关 [5]。双歧杆菌的刺激可以使DC相关趋化因子CCL20的表达上调,募集更多的DC细胞,使其分泌抗癌细胞因子IL-12,增强淋巴细胞的免疫应答。
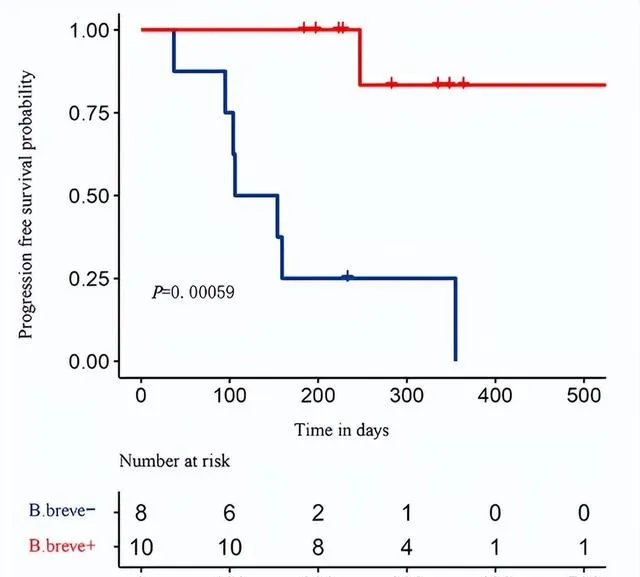
接受免疫治疗的中国NSCLC患者中,短双歧杆菌阳性与较好的预后相关
乳杆菌
乳杆菌 (也叫乳酸菌) 也是十分常见的一类益生菌,还被广泛用于酸奶、奶酪、泡菜、腐乳等多种发酵食物的生产。乳杆菌被认为有调节肠道菌群、促进消化、保护消化道黏膜、改善便秘等作用。
肿瘤治疗中,乳杆菌也是十分重要的一类益生菌。比如,罗伊氏乳杆菌就被发现可以从肠道异位到肿瘤之中,并在肿瘤中分泌芳香受体激动剂吲哚-3-醛 (I3A) ,激活CD8+T细胞,增强免疫治疗效果 [6]:
● 黑色素瘤小鼠中,移植罗伊氏乳杆菌可以让PD-L1抑制剂治疗后的肿瘤体积进一步减小60%;
● 人类晚期黑色素瘤患者中,罗伊氏乳杆菌代谢产物I3A的血液浓度也和免疫治疗效果明显相关,高I3A水平的患者中位无进展生存期在50个月以上,而低I3A水平的患者只有不到10个月。
另一种乳杆菌——约氏乳杆菌则可以代谢产生次黄嘌呤,通过腺苷受体刺激免疫 [2] 。在结直肠癌小鼠中,移植约氏乳杆菌联合CTLA-4抑制剂相比单独使用CTLA-4抑制剂,也能让治疗后的肿瘤体积缩小85%。
此外,干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌等多种乳杆菌也被发现具有免疫调节作用,可能有助于肿瘤的免疫治疗 [7] 。
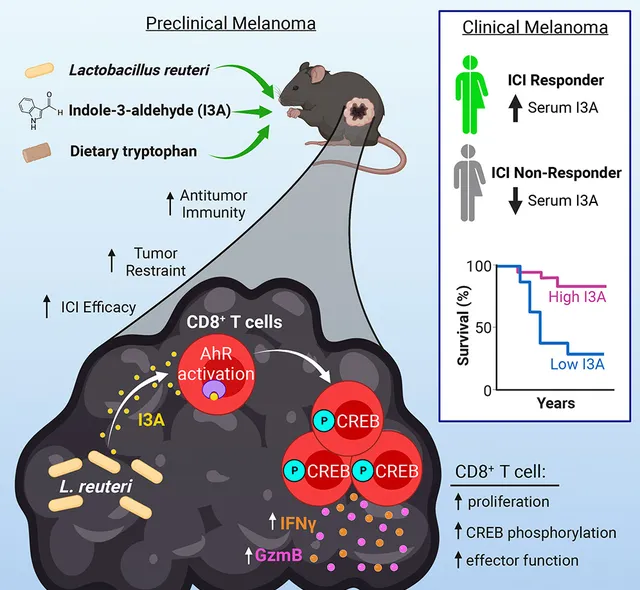
罗伊氏乳杆菌代谢物I3A促进免疫治疗,血浆I3A水平和黑色素瘤患者生存期相关
Akk
嗜黏蛋白阿克曼菌 (Akkermansia muciniphila,以下简称Akk) 算得上是益生菌领域的一个「新晋网红」,减肥、改善糖尿病、抗衰老,甚至还能延缓肌萎缩侧索硬化症 (渐冻人) 的进展,简直没什么它做不了的。
在肿瘤免疫治疗中,Akk也延续了它无所不能的表现。2017年法国国家健康与研究中心的一项研究就发现,PD-1治疗无效的肺癌和肾癌患者体内,Akk的丰度明显较低,无菌小鼠中移植Akk也能明显改善PD-1治疗的效果 [8] 。
但是Akk的补充可能并非越多越好。在另一项大规模前瞻性研究中 [9] ,Akk可以很好的预测NSCLC患者的免疫治疗效果,甚至在接受一线单免疫治疗的患者中,有Akk和无Akk的客观缓解率能达到41%vs19%的悬殊比分,但Akk丰度最高的一群患者却是生存期最短的:
Akk丰度正常 (<4.8%) 的患者总生存期最长,中位OS 27.2个月;
缺乏Akk的患者,中位OS 15.5个月;
Akk过多 (>4.8%) 的患者,总生存期最短,中位OS只有7.8个月;
不过,出现这一现象的原因,也可能是过高的Akk丰度代表了存在肠道损伤的患者, Akk过多和免疫治疗效果下降之间不一定存在因果关系。
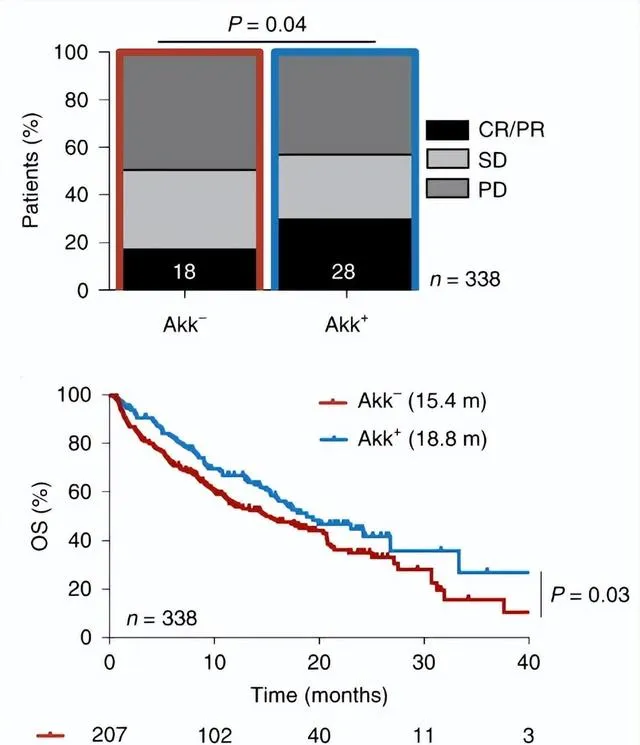
Akk阳性NSCLC患者接受免疫治疗,缓解率较高,生存期较长
瘤胃球菌
瘤胃球菌这个名字可能对肿瘤患者来说听起来不太讨喜,但它名字里的这个「瘤」并非是指肿瘤,而是指反刍动物4个胃之一的瘤胃,或者叫做毛肚。瘤胃球菌最早就是在瘤胃中发现的。
在各种益生菌产品中,瘤胃球菌的出现比较少,但它其实是肠道菌的基石之一,但中国人常见的三大类肠型中就有一个瘤胃球菌型 (或者叫第三肠型) ,这类人通常习惯倾向于高碳水化合物饮食。
在接受免疫治疗的多种实体瘤患者中,瘤胃球菌都被发现与治疗有效相关 [10] 。而在小鼠模型里,口服补充瘤胃球菌还被发现能够逆转抗生素治疗引起的免疫治疗抑制作用 [11] 。
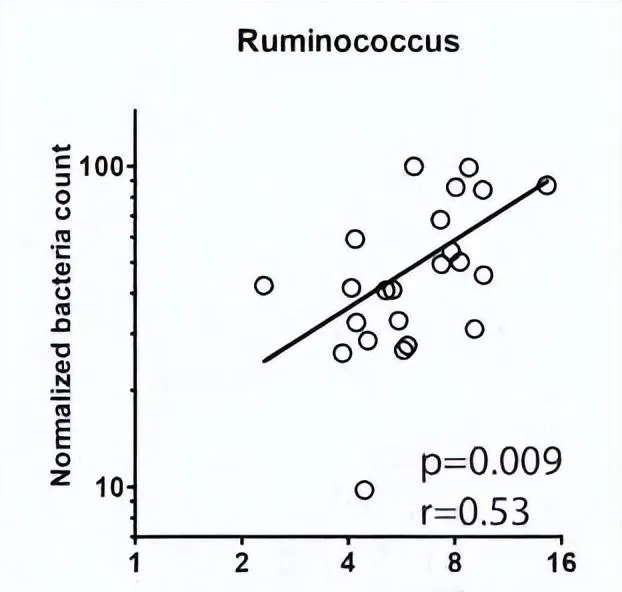
抗生素治疗后,瘤胃球菌的恢复与抗肿瘤免疫的恢复同步
当然,跟免疫治疗相关的肠道菌除了上述4类之外还有很多,如拟杆菌、产气柯林斯菌、屎肠球菌、粪杆菌等。特定种类的细菌或可改善肿瘤的免疫治疗疗效,并且用于预防肿瘤复发已经在临床上得到了越来越多的验证。
参考文献:
[1]. Sivan A, Corrales L, Hubert N, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti–PD-L1 efficacy[J]. Science, 2015, 350(6264): 1084-1089.
[2]. Mager L F, Burkhard R, Pett N, et al. Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy[J]. Science, 2020, 369(6510): 1481-1489.
[3]. Matson V, Fessler J, Bao R, et al. The commensal microbiome is associated with anti–PD-1 efficacy in metastatic melanoma patients[J]. Science, 2018, 359(6371): 104-108.
[4]. Zhao H, Li D, Liu J, et al. Bifidobacterium breve predicts the efficacy of anti‐PD‐1 immunotherapy combined with chemotherapy in Chinese NSCLC patients[J]. Cancer Medicine, 2023, 12(5): 6325-6336.
[5]. Li Q, Li Y, Wang Y, et al. Oral administration of Bifidobacterium breve promotes antitumor efficacy via dendritic cells-derived interleukin 12[J]. Oncoimmunology, 2021, 10(1): 1868122.
[6]. Bender M J, McPherson A C, Phelps C M, et al. Dietary tryptophan metabolite released by intratumoral Lactobacillus reuteri facilitates immune checkpoint inhibitor treatment[J]. Cell, 2023, 186(9): 1846-1862. e26.
[7]. Abedin-Do A, Taherian-Esfahani Z, Ghafouri-Fard S, et al. Immunomodulatory effects of Lactobacillus strains: emphasis on their effects on cancer cells[J]. Immunotherapy, 2015, 7(12): 1307-1329.
[8]. Routy B, Le Chatelier E, Derosa L, et al. Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors[J]. Science, 2018, 359(6371): 91-97.
[9]. Derosa L, Routy B, Thomas A M, et al. Intestinal Akkermansia muciniphila predicts clinical response to PD-1 blockade in patients with advanced non-small-cell lung cancer[J]. Nature medicine, 2022, 28(2): 315-324.
[10]. Gopalakrishnan V, Spencer C N, Nezi L, et al. Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients[J]. Science, 2018, 359(6371): 97-103.
[11]. Iida N, Dzutsev A, Stewart C A, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment[J]. science, 2013, 342(6161): 967-970.











