美国中部时间3月12日,2024年美国皮肤病学会(AAD)年会圆满落幕。银屑病是一种遗传与环境共同作用诱发的免疫介导的慢性、复发性的炎症性皮肤疾病,除了引起皮损症状外,还会严重影响患者的生活质量,本次AAD会议上,银屑病治疗的相关研究获得了各国学者的广泛关注。
重点一览:
瑞莎珠单抗治疗中重度银屑病患者有效清除皮损且维持长期疗效可达2年
佩索利单抗每4周一次皮下注射预防泛发性脓疱型银屑病(GPP)的发作
氘可来昔替尼治疗中重度斑块状银屑病的疗效可维持148周
研究设计
该研究共纳入255名患者, 按照1:1:1:1:1:1随机分组接受JNJ-77242113(25mg QD、50mg QD、100mg QD、25mg BID、100mg BID)治疗或安慰剂治疗,为期16周。
入组标准:1.年龄≥18岁;2.PASI≥12,研究者整体评估(IGA)≥3,银屑病皮损体表面积(BSA)≥10%;3.确诊银屑病(PsO),伴或不伴银屑病关节炎(PsA),持续≥6个月;4.接受光疗或系统治疗者。
研究结果
与安慰剂组相比,每个JNJ-77242113治疗组在第16周时银屑病皮损面积与严重程度指数(PASI)较基线改善的平均百分比明显更大(P均<0.001)(图1)。
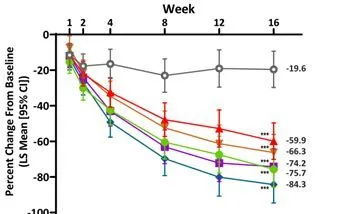
图1治疗16周,PASI的平均百分比变化
注:***:与安慰剂相比,P<0.001。
与安慰剂组相比,每个JNJ-77242113治疗组在第16周达到绝对PASI评分 =0、≤1、≤2、≤3和≤5的患者比例明显更高#(图2)。
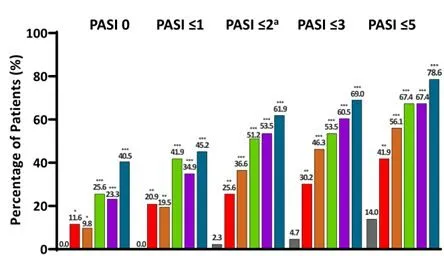
图2第16周内达到绝对PASI评分的患者比例
注:与安慰剂相比,*、**、***分别为P<0.05、P<0.01、P<0.001。
#:与安慰剂组相比, 25mg QD组PASI =0(P<0.05),PASI≤1/PASI≤2/PASI≤3/ PASI≤5的P均<0.01;
25mg BID组PASI =0(P<0.05),PASI≤1(P<0.01),PASI≤2/ PASI≤3/ PASI≤5的P均<0.001;
50mg QD、100mg QD、100mg BID组PASI =0/PASI≤1/PASI≤2/ PASI≤3/ PASI≤5的P均<0.001
与安慰剂组相比,每个JNJ-77242113治疗组在第12周达到BSA≤3%和≤1%的患者比例明显更高。从第12周到第16周,所有JNJ-77242113治疗组患者的应答率均有所增加(图3)。
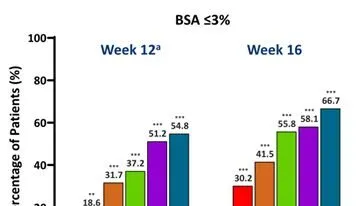
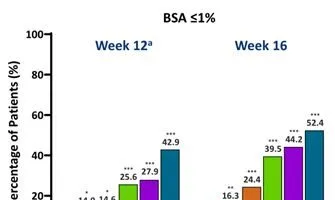
图3第12周和第16周时达到BSA的患者比例
注:与安慰剂相比,*、**、***分别为P<0.05、P<0.01、P<0.001。
研究结论
瑞莎珠单抗治疗中重度银屑病实现皮损清除且维持长期疗效可达2年
瑞莎珠单抗是一种IL-23抑制剂,已于2019年获美国食品药品监督管理局(FDA)批准用于治疗中重度斑块状银屑病。但其治疗斑块型银屑病的长期真实有效性数据仍然缺乏。这项研究旨在评估接受瑞莎珠单抗治疗患者达到美国国家银屑病基金会(NPF)定义的治疗目标以及在真实世界中维持临床应答方面的长期疗效。
研究设计
纳入的297名患者均为中重度斑块状银屑病成人(研究者总体评估≥3),他们在基线访问时开始使用瑞莎珠单抗,并在24(±3)个月后持续使用。在24个月时评估是否达到NPF定义的理想目标(BSA≤1%)或可接受目标(BSA≤3%或BSA较基线改善≥75%)。在第6个月和第12个月时PASI均为90%(PASI90)的患者中,评估第24个月时的维持情况(图1)。
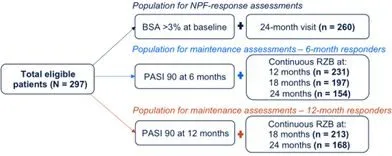
图1评估的患者群体
注:BSA:银屑病皮损体表面积;NPF:国家PsO基金会;PASI:银屑病面积和严重程度指数;RZB:瑞莎珠单抗(Risankizumab)。
研究结果
在符合条件的297名患者中,260名基线时BSA>3%,并在24个月时评估了达到治疗目标的情况。治疗24个月后,260名基线BSA>3%的患者中,90.4%(235/260)和77.3%(201/260)分别达到了NPF定义的可接受目标(BSA≤3%或BSA较基线改善≥75%)和理想目标(BSA≤1%)(图2)。

图2连续使用RZB24个月后达到BSA≤3%或NPF定义的可接受目标和理想目标的患者百分比a
注:a:24个月时缺失结果信息或基线时BSA≤3%的患者被排除在分析外;b:BSA≤3%或BSA改善75%;c:BSA≤1%。
在第6个月时达到PASI90且仍继续使用RZB治疗12、18和/或24个月的患者中,≥85%的患者维持临床应答。在第12个月时达到PASI90且仍继续使用RZB的患者中经过18和/或24个月的治疗,≥86%的患者维持临床应答。在第6个月和第12个月均达到PASI90并在第18和/或24月进行随访的患者中,133/144(92.4%)在18月内维持临床应答,100/110(90.9%)的患者在24个月内可以维持PASI 90临床应答(图3)。
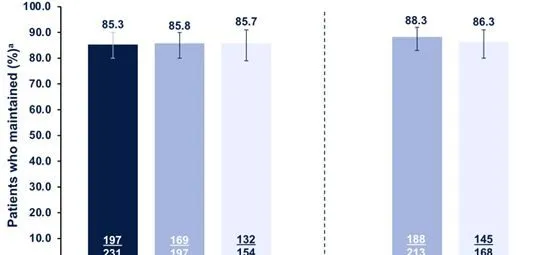
图3 在第6或12个月达到PASI 90的患者中,连续使用RZB治疗12、18和/或24个月时维持PASI90应答
注:a(%):是在可用于分析的患者中观察到的(例如,在第6或12个月时达到PASI90应答率,并且在每次随访期间持续接受RZB治疗)。
研究结论
在使用瑞莎珠单抗持续治疗2年后,该真实世界研究中的大多数患者均达到了NPF定义的治疗目标,并在24个月内维持了较高的皮损清除率。
每4周一次皮下注射佩索利单抗预防泛发性脓疱型银屑病(GPP)的发作:Effisayil 2和Effisayil ON试验
佩索利单抗是一种靶向作用于IL-36R的单克隆抗体,已获中国国家药品监督管理局(NPMA)和美国食品药品监督管理局(FDA)批准用于治疗成人GPP急性发作。Effisayil 2和Effisayil ON 开放标签扩展(OLE)试验分别评估了佩索利单抗在预防GPP发作和治疗GPP方面的疗效与安全性。本研究通过Effisayil 2和Effisayil ON OLE试验的数据,比较佩索利单抗皮下注射每4周一次与每12周一次的剂量方案预防GPP发作的相对疗效。
研究设计
Effisayil 2试验纳入有GPP病史且既往至少发生过2次GPP复发,并在筛查期/随机分组时GPP医师总体评估(GPPGA)评分为 0 或 1的患者。患者随机分配到佩索利单抗三个不同剂量组和一个安慰剂组:高剂量组为皮下注射600mg负荷剂量,随后每4周注射300mg;其次是中剂量组,为皮下注射600mg负荷剂量,随后每12周注射300mg;然后是低剂量组,皮下注射300mg负荷剂量,随后每12周注射150mg;第四组为安慰剂对照组(图1)。
研究主要终点:第48周内患者首次GPP发作的时间;关键次要终点:第48周内至少有一次GPP发作的发生率。GPP发作定义为GPPGA总分相较于基线增加≥2分,GPPGA脓疱单项评分≥2分。
Effisayil ON试验纳入的患者是在之前佩索利单抗的试验(包括 Effisayil 2)中已完成治疗,且没有停药。患者非随机分配接受安慰剂和佩索利单抗皮下注射:根据先前试验中的治疗反应选择剂量,既往试验中不需要静脉注射900mg 或接受安慰剂的患者每12周皮下注射300mg ;在先前试验中需要静脉注射900mg的患者每4周皮下注射300mg进行强化治疗,剂量方案可根据GPPGA总分和脓疱评分变化、既往试验中GPP发作史等相关的具体标准进行递增或递减(图1)。
研究主要终点:至第252周的TEAE;次要终点:GPP复发以及接受佩索利单抗静脉注射900mg治疗的受试者达到GPPGA分数0或1的时间。GPP复发定义为GPPGA总分增加≥2分同时脓疱单项评分≥2(筛选时GPPGA得分0或1),或GPPGA总分增加≥1分且存在新鲜脓疱形成(筛查时GPPGA评分2分)。
图1研究设计
注:DB:双盲法;OL:开放标签;SC:皮下注射;IV:静脉注射;q4w:每4周;q12w:每12周;*:在DB治疗期间,针对GPP发作给予900mg IV治疗;†:治疗期间针对GPP发作给予900mg IV治疗。*GPPGA分数为0或1表示干净或几乎干净的皮肤。
研究结果
Effisayil 2结果:佩索利单抗皮下注射600mg负荷剂量后,随后每4周注射300mg与每12周注射300mg相比,每4周注射300mg疗效更好,减少了近2/3的受试者经历GPP复发(q4w组10.0%[3/30] vs q12w组29.0%[9/31]),使受试者的GPP发作降低了84%。
表1 截至第48周GPP发作时间
注:†Cox回归模型通过随机分组时所使用的GPP药物进行分层。‡按随机化使用系统性GPP药物进行分层的对数秩检验。§Cochran-Mantel-Haenszel检验(多重推算后),按随机化使用系统性GPP药物进行分层。CI:置信区间;HR:风险比;LD:负荷剂量。
Effisayil ON结果:患者接受佩索利单抗每12周皮下注射300mg和每4周皮下注射300mg强化治疗,结果进一步表明每4周皮下注射300mg预防GPP发作疗效更好。
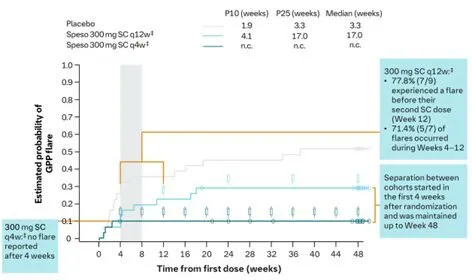
图2Effisayil2研究,随访至第一次GPP发作或第48周
注:*EM,本研究对于随机治疗期间GPP发作的定义为,静注佩索利单抗等挽救药物或医生起始标准治疗;PM,即审查的主要方法,定义为如果没有并发事件,则会在研究结束时(第351天)进行审查。†事件概率通过Kaplan-Meier方法估计。‡600mg SC负荷剂量后。
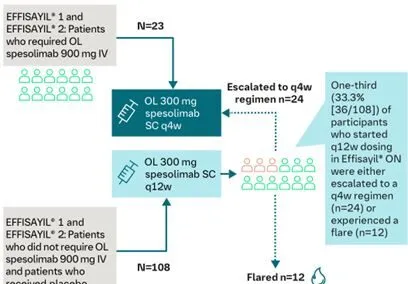
图3Effisayil ON的研究情况
注:静注佩索利单抗等挽救药物或医生起始标准治疗被视为事件或治疗失败;nc,不可计算;PM,审查的主要方法。
研究结论
Effisayil 2和Effisayil ON试验表明,佩索利单抗每4周皮下注射300mg是预防GPP发作的最佳给药方案,仍需要进一步的研究了解其预防GPP发作的机制。
氘可来昔替尼治疗中重度斑块状银屑病的PASI结果:3年的POETYK长期扩展(LTE)试验
氘可来昔替尼是全球首个口服选择性变构TYK2抑制剂,已在美国、欧盟和其他国家获批用于适合系统治疗或光疗的成年中重度斑块状银屑病患者。目前两项全球多中心、随机、双盲III期研究POETYK PSO-1和POETYK PSO-2已证实氘可来昔替尼的有效性和耐受性。本研究是对氘可来昔替尼治疗的患者进行的POETYK LTE试验,旨在评估氘可来昔替尼连续治疗148周的长期疗效。
研究设计
POETYK PSO-1(NCT03624127)和POETYK PSO-2(NCT03611751)是为期52周的全球3期双盲试验,将中重度斑块型银屑病患者按1:2:1随机分配至口服安慰剂、氘可来昔替尼6mg 每日一次(QD),或阿普米司特30mg每日两次(BID)。在第52周,入组POETYK LTE试验的患者接受氘可来昔替尼6mg QD治疗。
疗效评估终点:PASI 评分相对于基线的平均变化;PASI 评分在以下范围内较基线有所下降的患者比例:75%至<80%,80%至<85%、85%至<90%、90%至<95%、95%至≤100%,每个范围或条带、不重叠;达到达标治疗绝对PASI阈值≤1、≤2、≤3、≤4和≤5的患者比例;达到PASI评分范围>1至≤3和>3至≤5的患者比例。
研究结果
在完成为期52周的POETYK PSO-1和POETYK PSO-2临床研究之后,患者可参加正在进行中的POETYK PSO-LTE试验,以开放标签形式继续接受氘可来昔替尼(6 mg,每日一次)治疗。结果发现,从第16周到第52周以及148周,达到PASI 75至<80、80至<85、85至<90、90至<95和95至≤100的患者比例增加或维持不变(图1)。
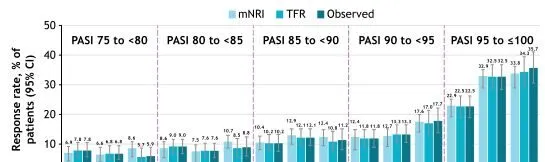
图1持续接受氘可来昔替尼治疗随时间达到目标PASI的患者比例
注:mNRI:第16周,n=456;第52周,n=456;第148周,n=456。TFR:第16周,n=510;第52周,n=511;第148周,n=353。观察:第16周,n=510;第52周,n=511;第148周,n=339。CI,置信区间;mNRI,修正的无应答插补;TFR,治疗失败规则。
基线PASI分数的平均值(标准差[SD])为21.1(7.9):从第一周开始就观察到了改善(-3.2);从第16周(-15.7)到第52周(-17.6),应答率保持不变或增加;从第52周到第148周患者出现持续应答(-16.4)(图2)。
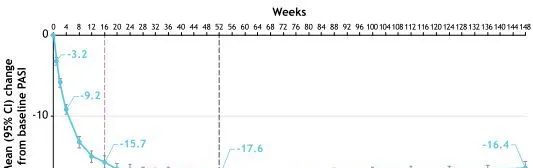
图2持续氘可来昔替尼治疗后PASI评分(mBOCF)相对于基线的平均变化(平均值[SD],21.1[7.9])(n=513)
注:CI,置信区间;LTE,长期延伸;mBOCF,修正基线观察结转;SD,标准差。
此外,绝对 PASI 阈值从第16周到第52周,应答率增加或总体保持不变(图3)。应答率从第52周持续到第148周;第148周与第52周相比,PASI>3至≤5内的应答率稍低,可能是由于第148周时转向更高的分数(PASI≤3)(图4)。无论是使用观察值还是使用mNRI和TFR数据估算方法,达到PASI阈值和PASI范围的患者比例都相似。
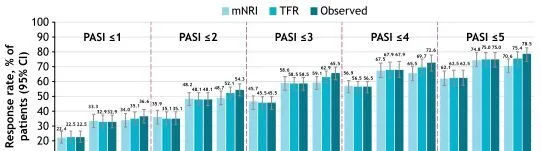
图3 随时间变化达到绝对PASI阈值的患者比例
注:mNRI:第16周,n=456;第52周,n=456;第148周,n=456。TFR:第16周,n=510;第52周,n=511;第148周,n=353。观察:第16周,n=510;第52周,n=511:第148周,n=339。CI,置信区间;mNRI,修正的无应答插补;TFR,治疗失败规则。
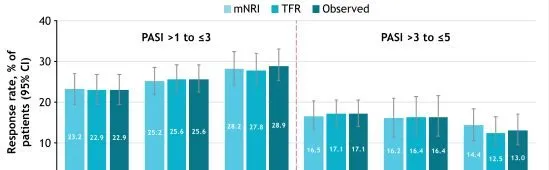
图4随时间变化达到PASI改善的患者比例
注:mNRI:第16周,n=456;第52周,n=456;第148周,n=456。TFR:第16周,n=510;第52周,n=511;第148周,n=353。观察:第16周,n=510;第52周,n=511:第148周,n=339。CI,置信区间;mNRI,修正的无应答插补;TFR,治疗失败规则。
研究结论
接受氘可来昔替尼治疗3年的患者,从第16周到第148周达到目标PASI评分和绝对PASI阈值的患者比例有所增加或维持不变。氘可来昔替尼每日口服一次,有望成为中重度斑块状银屑病患者的首选治疗方法。
参考文献:
[1]. Kim A, et al. AAD 2024. #54112.
[2]. Diamant Thaçi, et al. AAD 2024. #51342.
[3]. April W, et al. AAD 2024. #51447.
[4]. Linda Stein Gold MD, et al. AAD 2024. #51091.











