被誉为「液态黄金」的母乳,不仅有适合婴儿生长发育所需的各种营养素如蛋白质、脂类、碳水化合物、维生素,还含有丰富的抗体、活性细胞等各种生物活性成分,是有助于初生儿生长发育的理想食物来源[1][2]。
母乳低聚糖(HMOs) ,是母乳中仅次于乳糖和脂肪的第三大固体成分[3]。它由糖基转移酶将五种不同的单糖可变结合形成,包括N-乙酰氨基葡萄糖、D-葡萄糖、L-岩藻糖、 唾液酸 [4]。其中,约12%~14%的HMOs会进行唾液酸化[5],成为初生婴儿健康的重要守护者。
唾液酸,不是酸?
唾液酸(Sialic acids,SA)又称神经氨酸,是一类含有 9 碳的酸性氨基糖[6],最早由Blix[7]从牛下颌唾液腺蛋白中分离得到,故命名为唾液酸。Neu5Ac(N-乙酰神经氨酸,N - acetylneuraminic acid)是唾液酸家族中最常见的一种[8],也是母乳中唾液酸的主要代表形式[9]。

在生命早期阶段,婴儿大脑发育较快而肝脏发育还未成熟,由肝脏合成的唾液酸难以满足其大脑发育的需要。因此, 外源性的唾液酸补充在婴儿期显得尤为重要 [10]。研究数据显示, 母乳中的总唾液酸含量明显高于牛乳和婴儿配方粉 ,尤其在初乳中唾液酸含量高达约1 669.51mg/L[11]。
在成熟的母乳中, 大多数唾液酸(Sia)会与低聚糖结合(69 ~76%) ,小部分与蛋白质结合(21~28%),3%则以自由形式存在并与神经节苷脂结合[12],而唾液酸不同的存在位置和结合形式也赋予了其不同的生理功能[11]。
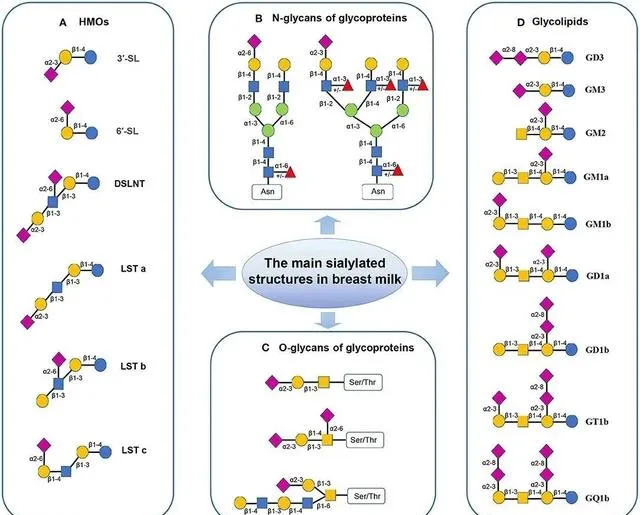
母乳中化合物的唾液酸化结构[13]
唾液酸:妈妈给予的营养「超能力」
- 助力神经系统发育
新生儿出生后的前6个月大脑快速增长,对神经认知发育所需营养素产生较高需求[14]。而大脑发育和认知在一定程度上依赖于含唾液酸的神经节苷脂和含聚唾液酸的糖蛋白[15][16]。
唾液酸在大脑中含量较高, 神经细胞膜的唾液酸含量是其他细胞的20倍 [17]。神经细胞中唾液酸能够参与神经递质的运动、释放和改变突触形状,促进神经细胞的分化、发育和再生[11]。因此, 末端黏附了高浓度唾液酸的母乳低聚糖在增强神经突触发生和促进婴儿神经系统发育上发挥积极作用 。
2、调节免疫力
母乳喂养,在降低婴儿肠道疾病、呼吸道感染等疾病风险方面具有独特优势。研究表明, 母乳中的唾液酸类低聚糖可抑制致病菌与婴幼儿胃肠道上皮细胞的黏附 [18],从而实现对婴幼儿免疫力的调节作用。
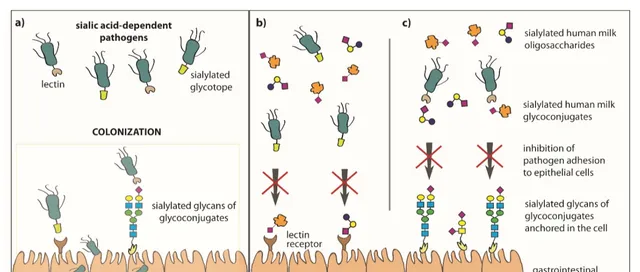
唾液酸类低聚糖对新生儿、婴儿胃肠道 病原体粘附上皮细胞的抑制作用[18]
唾液酸以糖缀合物形式存在于微生物表面和宿主细胞膜上,具有多个 替代结合位点 [19]。
得益于此,母乳中唾液酸类低聚糖及糖缀合物,可以
抑制微生物与宿主凝集素受体和/或糖缀合物的黏附
过程[18]。同时,动物实验表明,新生大鼠肠微绒毛表面的唾液酸可
增强免疫球蛋白抗体与上皮细胞的结合
[19]。
3、促进肠道有益菌生长
为了进一步完善并探究唾液酸对新生婴儿健康的潜在影响,汤臣倍健营养健康研究院此前于国际学术期刊 Frontiers in Nutrition 发表了题为「Studies and Application of Sialylated Milk Components on Regulating Neonatal Gut Microbiota and Health」的综述文章,特别提及 唾液酸类低聚糖对促进婴儿肠道有益菌生长的积极作用 [13]。

3′-唾液酸乳糖(3′-SL)、6′-唾液酸乳糖(6′-SL)是母乳中唾液酸类低聚糖的重要组成之一。一项体外研究结果显示, 6′-SL和3′-SL可促进长双歧杆菌、普通拟杆菌和多形拟杆菌的生长 ,且相关菌株表现出较高的神经氨酸酶活性并产生大量乳酸和/或短链脂肪酸(SCFAs), 对婴幼儿的肠道健康和免疫功能产生积极效应 [20][21]。相关的体内研究也表明,富含6′-SL和3′-SL的低聚糖混合物能通过调节婴儿肠道菌群为新生儿的生长发育带来重要的健康益处[22]。
结语
婴幼儿时期是生长发育的首个高峰,探究生命早期的营养奥秘对促进婴幼儿健康成长具有重要意义。作为营养代际传递的关键纽带,母乳深度参与初生儿健康屏障的建立,而唾液酸在其中扮演着重要角色。
随着唾液酸相关生物学功能研究的不断深入,唾液酸在肠道微生态领域展现出独特的巨大潜力。唾液酸、母乳低聚糖、益生菌、婴儿肠道菌群乃至免疫健康,是否将通过更深层次的联动以赋能「生命早期1000天」的营养故事,值得期待。
参考文献
1. Pediatr Clin North Am. 2013;60(1):49-74. doi:10.1016/j.pcl.2012.10.002
2. Early Hum Dev. 2015;91(11):629-635. doi:10.1016/j.earlhumdev.2015.08.013
3. Am J Clin Nutr. 2020;111(4):769-778. doi:10.1093/ajcn/nqaa010
4. Critical reviews in food science and nutrition, 61(7), 1184–1200.
5. 国际儿科学杂志,2023,50(01):38-41. DOI:10.3760/cma.j.issn.1673-4408.2023.01.008
6. Proc Natl Acad Sci U S A. 2007;104(28):11557-11561. doi:10.1073/pnas.0704404104
7. Nature. 1957;179(4569):1088. doi:10.1038/1791088b0
8. 现代预防医学,2020,47(16):2953-2957.
9. J Agric Food Chem. 2016;64(44):8333-8342. doi:10.1021/acs.jafc.6b03273
10. 食品工业科技,2014,35(03):363-368.DOI:10.13386/j.issn1002-0306.2014.03.035
11. 中国食品学报,2022,22(02):402-412.DOI:10.16429/j.1009-7848.2022.02.042
12. Annu Rev Nutr. 2009;29:177-222. doi:10.1146/annurev.nutr.28.061807.155515
13. Front Nutr. 2021;8:766606. Published 2021 Nov 10. doi:10.3389/fnut.2021.766606
14. Front Pediatr. 2018;6:385. Published 2018 Dec 4. doi:10.3389/fped.2018.00385
15. J Pediatr Gastroenterol Nutr. 2017;64(2):310-318. doi:10.1097/MPG.0000000000001276
16. Annu Rev Nutr. 2009;29:177-222. doi:10.1146/annurev.nutr.28.061807.155515
17. Am J Clin Nutr. 2001;74(4):510-515. doi:10.1093/ajcn/74.4.510
18. Nutrients. 2019;11(2):306. Published 2019 Feb 1. doi:10.3390/nu11020306
19. Nutr Rev. 2014;72(6):377-389. doi:10.1111/nure.12106
20. Glycobiology. 2013;23(11):1281-1292. doi:10.1093/glycob/cwt065
21. PLoS One. 2013;8(6):e67224. Published 2013 Jun 21. doi:10.1371/journal.pone.0067224
22. BMC Pediatr. 2014;14:306. Published 2014 Dec 20. doi:10.1186/s12887-014-0306-3











