本文来源:中华全科医师杂志, 2023,23:网络预发表.
20世纪90年代以来,随着我国居民生活方式和饮食结构的改变,以动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular diseases,ASCVD)为主的心血管疾病成为了我国城乡居民因病致死的首要原因。而研究显示近年来我国血脂异常患病率显著升高,已成为我国ASCVD疾病负担迅猛上升的关键危险因素之一。2018年我国成人血脂异常总患病率为35.6%。1997年以来我国先后发布了多个中国成人血脂异常防治与管理指南,2019年发布【血脂异常基层诊疗指南(2019年)】,给出了我国成人血脂管理的相关建议。但时至今日我国居民血脂异常的知晓率、治疗率和达标率仍不甚理想。一项关于2014至2019年全国31个省份3 041家基层医疗卫生机构管辖的社区居民的横断面研究(China-PEACE)中共纳入了35~75岁的社区居民231万余,结果显示其中血脂异常者占33.8%,ASCVD患者及其高危者分别占3.2%和10.2%,而依从指南接受降脂药物治疗者分别仅占14.1%和4.5%。
大量流行病学研究和降脂治疗的随机对照试验证实高胆固醇血症与ASCVD具有因果关系,且高胆固醇血症的暴露时长与终生ASCVD风险相关,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的绝对降幅与ASCVD发生率、致残率和死亡率的下降呈线性正相关。降脂药物,如他汀类药物、胆固醇吸收抑制剂以及前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂单用或联合应用,可使得LDL-C水平下降30%~85%,且随着LDL-C降低幅度增大ASCVD事件风险降低。因此,国内外相关指南均建议严格控制LDL-C水平,使其长期达标。20世纪90年代以来,欧美国家经年龄校正的人群缺血性心脏病的死亡率逐年下降,相较1999年,2019年降低了约52%,其中以他汀类药物为基础的降脂治疗率大幅提升是极其重要的原因。2013年时美国ASCVD患者他汀类药物的治疗率已达58.1%。而在我国血脂管理仍面临着巨大挑战,我国居民对降脂治疗的接受度、依从性均较低,降脂药物的治疗率和治疗达标率均较低。要切实提高血脂达标率,基层医疗卫生机构的作用举足轻重。基于此,海峡两岸医药卫生交流协会全科医学分会组织全国慢性病管理、全科医学和心血管病等领域的专家,参考国内外相关成人血脂管理指南及最新的循证医学证据,从临床实践角度出发,结合我国基层医疗卫生机构的实际情况制订了该共识,力求提高我国成人血脂异常的检出率、治疗率和达标率,在更广泛的人群中进行ASCVD防控。
一、血脂与脂蛋白
血脂是血清中胆固醇、甘油三酯(triglyceride,TG)和类脂等的总称。血脂以能溶于血液的脂蛋白形式从血浆被转运至组织,进行能量供应、脂质储存和激素合成等。脂蛋白由游离胆固醇和胆固醇酯、TG和磷脂、载脂蛋白(apolipoprotein,Apo)等组成。血液中主要的脂蛋白有6种,按照直径由大到小依次为乳糜微粒(chylomicron,CM)、极低密度脂蛋白(very low-density lipoprotein,VLDL)、中间密度脂蛋白(intermediate-density lipoprotein,IDL)、低密度脂蛋白(low-density lipoprotein,LDL)、脂蛋白(a)[Lp(a)]和高密度脂蛋白(high-density lipoprotein,HDL)。LDL是血液中胆固醇含量最高的脂蛋白, 由Apo B100运送到外周组织,LDL经肝细胞表面或肝外的LDL受体分解代谢。HDL是颗粒最小的脂蛋白,对应的Apo为Apo A1。
二、脂蛋白与ASCVD的关系
CM对应的Apo为Apo B48,VLDL、IDL、LDL对应的Apo均为Apo B100,HDL对应的Apo为Apo A1。Lp(a)是一种独立的由肝脏合成的脂蛋白,由LDL样颗粒和Apo(a)组成,二者以二硫键共价结合。各种脂蛋白颗粒均携带着不同比例的胆固醇、TG或磷脂等成分。LDL携带的胆固醇成分(LDL-C)约占总胆固醇(total cholesterol,TC)的70%。
所有直径<70 nm含Apo B的脂蛋白颗粒,均可穿过血管内皮细胞屏障,其所携带的胆固醇成分在动脉粥样硬化发生和进展过程中均发挥了重要作用,且含Apo B颗粒越多,动脉粥样硬化形成和进展越快。因此,动脉粥样硬化斑块负荷由循环中LDL-C和其他含Apo B的脂蛋白的水平,以及这些脂蛋白在循环中暴露的时长决定。保持健康的生活方式,使含Apo B的脂蛋白长期处于较低水平,有利于延缓动脉粥样硬化的进展。同时,积极采用降脂药物进行治疗,降低LDL-C和其他含Apo B的脂蛋白水平对ASCVD的一级预防和降低心血管事件复发风险均具有重要意义。
(一)LDL-C
大量研究证实血浆LDL-C水平与ASCVD风险呈对数线性正相关,降低LDL-C水平可显著降低ASCVD的风险,且LDL-C降幅越大ASCVD风险降低越显著。遗传流行病学研究进一步证实LDL-C暴露累积量与ASCVD风险相关。因此,LDL-C与ASCVD具有因果关系,是ASCVD防控的首要干预靶点。
(二)富含TG脂蛋白(triglyceride rich lipoproteins,TRL)
TRL包括CM、VLDL及其残粒,携带循环中的大部分TG,因此血浆中TG水平可反映循环中富含TG的Apo B水平。TRL未有效脂解产生的残粒富含胆固醇,与ASCVD风险相关,而TRL及其残粒所携带的TG本身并不直接导致动脉粥样硬化。在使用他汀类药物进行治疗的患者中,TRL是除LDL-C以外的脂质相关心血管剩余风险之一,尤其是在糖尿病等特殊人群中。
(三)HDL-C
流行病学研究显示血HDL-C水平与ASCVD发病呈负相关,即HDL-C越高ASCVD风险越低。但迄今并无提高HDL-C水平可降低心血管事件风险的随机对照试验的循证医学证据。因此,目前不把HDL-C作为治疗靶点。
(四)Lp (a)
目前,绝大多数研究支持Lp (a)升高,ASCVD风险升高。另有研究显示Lp(a)是钙化性主动脉瓣狭窄的独立危险因素。
三、临床常用血脂检测项目及其合适水平
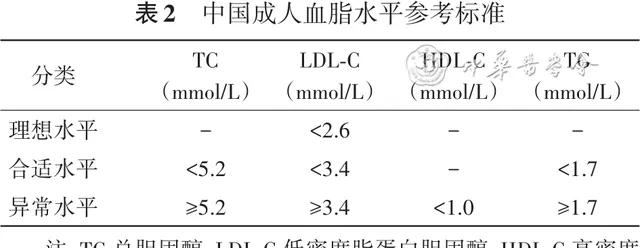
临床上常用的血脂检测项目包括TC、TG、LDL-C和HDL-C,检测注意事项见表1。中国成人血脂水平参考标准见表2,需要注意的是,该参考标准仅适用于ASCVD风险为低危的无糖尿病的人群。

其他血脂指标还有ApoB、ApoA、脂蛋白残粒胆固醇(remnant lipoprotein cholesterol,RLP-C)、低密度脂蛋白颗粒(LDL particle,LDL-P)、小而密低密度脂蛋白胆固醇(small and dense LDL,sdLDL)等,条件允许时,应给予关注。对于LDL-C控制达标的患者,上述指标可反映ASCVD的脂质剩余风险。
四、血脂异常定义及分类
血脂异常是指血TC和/或TG水平升高,亦称为高脂血症。从临床实用角度出发可将其分为高TC血症、高TG血症和混合型高脂血症,以及低HDL-C血症。按病因分类,血脂异常包括原发性(遗传性)血脂异常和继发性血脂异常,前者包括家族性高胆固醇血症、家族性高TG血症(通常TG>10 mmol/L)等;后者通常指存在导致血清脂质和脂蛋白代谢改变的潜在疾病和代谢状态,常见病因见表3。

无论原发性还是继发性血脂异常,LDL-C升高、TRL过多等因素均会促进动脉粥样硬化的发生、发展。发生血脂异常的年龄越小、持续时间越长,胆固醇累积负荷越重,ASCVD风险越高。
需注意,严重高TG血症(如TG>5.6 mmol/L)还可诱发胰腺炎。对于空腹TG≥1.7 mmol/L的患者,应间隔2周以上复查空腹TG,以除外饮食等短期因素的影响,然后再考虑是否对持续性严重高TG血症患者启动药物治疗。
五、ASCVD风险评估
血脂管理的最终目标是降低ASCVD和不良心血管事件风险,因此血脂是否异常,不能仅参考血脂合适水平,还应结合个体ASCVD发病风险进行综合判定。依据【中国血脂管理指南(2023年)】推荐,我国成人10年ASCVD发病风险可以划分为超高危、极高危、高危、中危和低危(表4)。不同ASCVD发病风险者血LDL-C控制目标不同,超过目标水平者也属于血脂异常患者。

对于年龄<55岁的ASCVD低、中危人群,需评估ASCVD的余生风险。具有以下任意2个及以上危险因素者,ASCVD余生风险为高危:①收缩压≥160 mmHg(1 mmHg=0.133 kPa)或舒张压≥100 mmHg;②非HDL-C≥5.2 mmol/L;③HDL-C<1.0 mmol/L;④体重指数≥28.0 kg/m2;⑤吸烟。余生ASCVD高危风险人群可转上级医院进一步评估。
六、血脂异常治疗
(一)干预靶点
1.LDL-C是首要干预靶点:LDL-C每降低1 mmol/L,ASCVD风险下降约20%。因此,多数国家或地区的血脂管理指南均推荐将LDL-C作为降脂治疗的首要干预靶点。不同ASCVD危险分层的人群LDL-C降低的目标值不同(表5)。

2.非HDL-C可作为ASCVD的次要干预靶点:对于高TG血症、糖尿病、代谢综合征、肥胖等患者,仅考虑LDL-C存在一定局限性,而非HDL-C代表全部致动脉粥样硬化脂蛋白颗粒中的胆固醇,受TG波动影响小,检测结果稳定,可作为上述人群ASCVD的次要干预靶点,目标值为LDL-C+0.8 mmol/L。
(二)生活方式干预
生活方式干预是降脂治疗的基础,包括合理饮食、适度锻炼、控制体重、戒烟、限酒等。无论是否采用药物进行降脂治疗,均须进行生活方式干预。饮食中须限制饱和脂肪酸及反式脂肪酸的摄入,增加全谷薯类、膳食纤维(25~40 g/d)及鱼类摄入。对于ASCVD中危及以上的人群或合并高胆固醇血症的患者,应降低胆固醇的摄入(<300 mg/d)。适度锻炼,每周5~7次,每次30 min中等强度运动。建议不饮酒或限量饮酒,尤其对于TG升高的患者。应积极戒烟。
(三)药物治疗
对于通过生活方式干预不能达到降脂目标值的患者,应考虑加用降脂药物。降脂药物主要分为降胆固醇药物和降TG药物。
1.他汀类药物是血脂异常药物治疗的基石:他汀类药物是3羟基3甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,可抑制胆固醇合成,降低血清TC、LDL-C和Apo B水平,还可轻度降低血清TG水平。他汀类药物是防治ASCVD的基础用药,研究证实他汀类药物不仅可降低ASCVD患者心血管事件的复发风险,还可降低ASCVD高危人群发生心血管事件的风险。他汀类药物剂量倍增时,LDL-C进一步降幅仅约为6%,而不良反应风险显著升高。在我国开展的CHILLAS研究结果显示,他汀类药物剂量增加1~2倍并不能进一步降低急性冠状动脉综合征患者心血管事件复发风险。结合我国人群对大剂量他汀的耐受性较差,建议采用中等强度他汀进行治疗(LDL-C降幅25%~50%),详见表6。

对于通过他汀类药物治疗LDL-C达标的患者,应维持原有他汀及剂量长期治疗,定期随访,监测血LDL-C水平。LDL-C仍未达标患的者,建议联合非他汀类药物进行治疗,以进一步降低LDL-C。血脂康的主要成分为13种天然复合他汀,系无晶体结构的洛伐他汀及其同类物,CCSPS研究等证实血脂康胶囊可降低冠心病患者总死亡率和心血管事件发生率。
他汀类药物总体安全性好,治疗获益远大于不良反应。谨慎判断「他汀不耐受」是克服我国血脂异常药物治疗率低的重要环节。他汀类药物治疗期间出现轻微不良反应时,不应轻易停药,应加强观察。若出现严重不良反应,可减量或停药(图1)。长期服用大剂量他汀可增加新发糖尿病风险,发生率为9%~12%,但由于他汀类药物长期治疗心血管总体获益远大于新发糖尿病风险,因此无论是糖尿病高危人群还是普通糖尿病患者,有他汀类药物适应证者均应坚持服药。
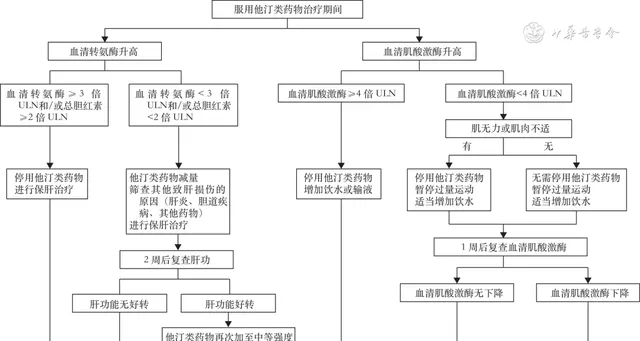
注:ULN 正常值上限
▲ 图1 他汀类药物不良反应处理流程图
需关注他汀类药物与其他药物间的相互作用。大部分他汀通过细胞色素P450(CYP450)代谢,与其他通过此通路代谢的药物联用时会增加肌病风险,如胺碘酮、钙通道拮抗剂、大环内酯类抗生素、抗真菌药物(如伊曲康唑、酮康唑等)、环孢菌素以及某些食物(如大量饮用西柚汁),因此与上述药物联用时需避免使用大剂量他汀,并加强不良反应监测。此外,他汀类药物与吉非罗齐联用也会增加肌病风险,应避免联用,但与其他贝特类药物联用时肌病风险不大。
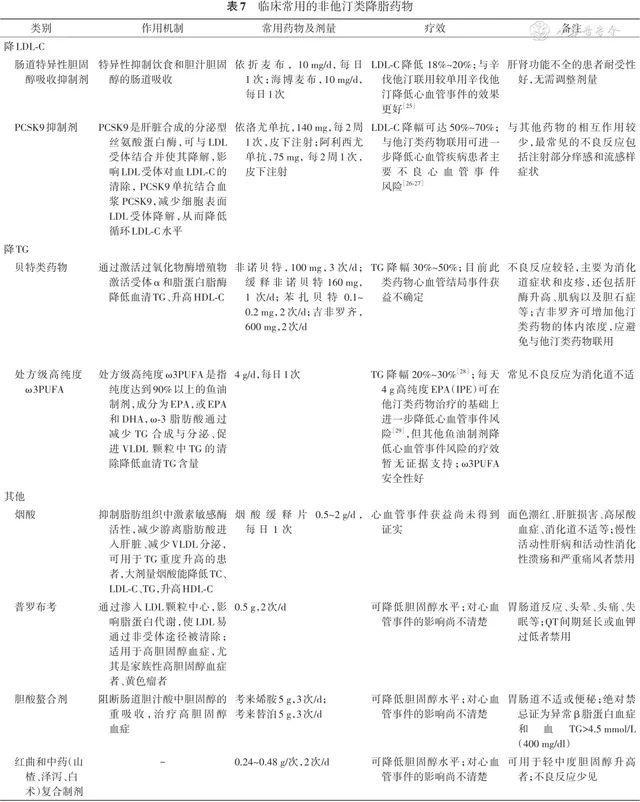
2.非他汀类降胆固醇和甘油三酯药物:除他汀类药物以外,还有多种药物能可显著降低LDL-C水平,包括肠道胆固醇吸收抑制剂、PCSK9抑制剂等。降TG药物包括贝特类、高纯度ω3多不饱和脂肪酸制剂(ω3PUFA)等。非他汀类降胆固醇和甘油三酯药物的作用机制、常用剂量及疗效等详见表7。
近年来,研发出了多种作用于新靶点的新型降脂药物,如PCSK9小干扰mRNA制剂英克西兰,其降LDL-C的效果与PCSK9单抗相当,但作用持久,每注射1次,疗效可维持6个月。英克西兰分别于2020年和2021年在欧洲和美国上市,2023年11月在中国上市,用于治疗家族性高胆固醇血症及ASCVD,但目前价格昂贵,在我国人群中的费用效益比等仍有待评估。
(四)降脂治疗策略
1.降胆固醇的策略:根据个体血LDL-C水平及ASCVD危险分层,确定LDL-C目标值和/或降低幅度,对于高危及以上的患者可考虑起始降胆固醇药物联合治疗(图2)。
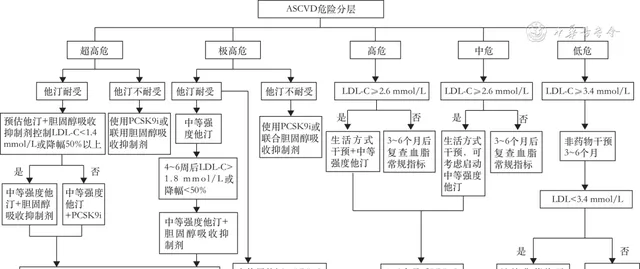
注:ASCVD 动脉粥样硬化性心血管疾病,LDL-C 低密度脂蛋白胆固醇,PCSK9i 前蛋白转化酶枯草溶菌素9抑制剂,他汀 他汀类药物
▲ 图2 不同ASCVD危险分层人群降LDL-C药物治疗流程图
2.降TG的策略:对于高TG血症患者,在查找并纠正继发原因、改善生活方式、优化降糖方案的基础上,应根据TG升高幅度和ASCVD危险分层,适时启动他汀类或贝特类等药物治疗,具体策略参见图3。
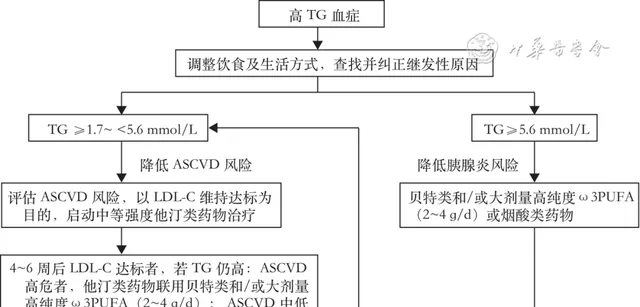
注:TG 甘油三酯,ASCVD 动脉粥样硬化性心血管疾病,LDL⁃C 低密度脂蛋白胆固醇, ω3PUFA ω3多不饱和脂肪酸制剂
▲ 图3 高TG血症患者药物治疗流程图
七、血脂筛查和随访
血脂筛查和随访,一是为了提高人群血脂异常知晓率,以便积极地进行管理,二是用于监测血脂异常的治疗效果,以便提高控制率。不同人群血脂监测频率不同,此外还需定期对安全性指标进行随访。监测随访计划可为患者长期、安全、有效的血脂管控提供保障,以期减少不良心血管事件的发生。
血脂筛查和随访计划推荐如下:
(1)18岁及以上成人每2年检测1次血脂常规指标(包括TC、TG、LDL-C、HDL-C)。
(2)ASCVD高危人群,每年至少检测1次血脂常规指标。
(3)仅进行饮食控制者,3~6个月后应复查血脂常规指标,若达标,则维持非药物治疗,保持6个月1次的随访频率。
(4)刚启动降脂药物治疗或调整治疗剂量的患者,建议4~6周复查血脂常规指标及肝酶、肌酸激酶。
(5)降脂达标的患者,建议每3~6个月复查1次血脂常规指标及肝酶、肌酸激酶,若有其他需复查的因素(如ASCVD等级变化等),可增加检测频率。
需注意,血脂管理(生活方式干预、降脂药物治疗)必须长期坚持,才能有良好的临床获益。
八、转诊建议
1.经社区诊治控制不佳的高胆固醇血症(LDL-C≥4.9 mmol/L)、高TG血症(TG≥5.6 mmol/L)患者,需转诊上级医院,以进一步评估心血管或胰腺等受累情况。
2.患者存在明确的、社区诊治困难的继发性病因,如肾病综合征、甲状腺功能减退等。
3.基线时患有肝肾疾病者,是否启动降脂药物治疗决策困难。
4.降脂治疗后的2次随访(间隔6个月)血脂不能达标的患者。
5.需要启动联合降脂治疗时,基层医疗卫生机构缺乏所需药物。
6.降脂治疗过程中出现血清转氨酶在正常上限3倍及以上,或血清肌酸激酶在正常上限4倍及以上等不良反应,社区诊治存在困难的患者。
7.ASCVD患者LDL-C水平已达标或已接受他汀类药物治疗后,仍再发心脑血管事件的患者。
总之,基层医疗卫生机构在我国居民血脂管理中肩负着非常重要的责任,本共识以简明、实用为原则凝练了国内外最新血脂管理的理念、方法及策略,以期为基层医生临床实践提供参考。
【社区成人血脂管理中国专家共识(2024年)】撰写组
组长: 李勇 祝墡珠
专家组成员(按姓氏汉语拼音排序): 陈红(北京大学人民医院);杜雪平(首都医科大学附属复兴医院月坛社区卫生服务中心);段学燕(广东深圳龙华区中心医院);董吁钢(中山大学附属第一医院);符岱佳(南京市建邺区南湖社区卫生服务中心);方力争(浙江大学医学院附属邵逸夫医院);宦红梅(上海闵行区古美社区卫生服务中心);黄恺(华中科技大学附属协和医院);金迎(上海打浦桥社区卫生服务中心);廖晓阳(四川大学华西医院);李燕(上海市高血压研究所);李勇(复旦大学华山医院);山缨(复旦大学华山医院);寿涓(复旦大学附属中山医院);史玲(上海普陀区卫生健康事务管理中心);王爽(中国医科大学附属第一医院);王胜煌(宁波市第一医院);肖洁汶(上海市宝山区吴淞中心医院);谢坤(复旦大学华山医院);谢良地(福建医科大学附属第一医院);肖雪(遵义医科大学附属医院);张大庆(中国医科大学附属盛京医院);祝墡珠(复旦大学中山医院)
执笔专家: 山缨 谢坤
本文编辑:徐静 刘岚











