引言
自動胰島素輸送系統的歷史可追溯到上世紀60年代,當時科學家們首次嘗試開發能夠模擬人體胰腺功能的裝置 。最初的裝置被稱為「背包」,由Arnold Kadish設計,雖然其體積龐大且實用性有限,但它開啟了穿戴式胰島素泵和 連續血糖監測系統(CGM) 的發展之路。隨著技術的進步,1970年代末,商用的連續皮下胰島素輸送(CSII)泵問世,為I型糖尿病( T1D )患者提供了更加靈活和精確的胰島素管理方案。這些早期的CSII泵雖然功能有限,但它們的出現標誌著糖尿病管理進入了一個新的時代。
21世紀初,隨著第一款商用CGM系統的獲批,自動胰島素輸送技術邁出了重要一步 。這些系統能夠即時監測血糖水平,為患者提供了前所未有的血糖控制能力。CGM系統的出現不僅改善了糖尿病患者的血糖管理,還為後續的自動胰島素輸送系統的發展奠定了基礎。
自動胰島素輸送系統的最終目標是實作全自動人造胰腺,即 一個能夠根據即時血糖水平自動調節胰島素輸送的閉環系統 。這一概念最早由Arnold Kadish提出,經過數十年的研究和發展,這一夢想正逐步成為現實。隨著技術的不斷進步,研究人員和工程師們開發出了越來越先進的演算法和裝置,使得自動胰島素輸送系統更加精確和可靠。從最初的低血糖暫停(LGS)功能到今天的預測性低血糖暫停和混合閉環系統,這些技術的演進不斷推動著全自動人造胰腺的發展。
當前, 全自動人造胰腺的研究和試驗正在全球範圍內積極進行中,許多研究已經展示了這些系統在提高血糖控制、減少低血糖事件以及改善患者生活品質方面的巨大潛力 。隨著更多創新技術的套用和臨床試驗的成功,全自動人造胰腺的實作指日可待,這將為T1D患者帶來革命性的改變。3月6日 Nature Medicine 對相關進展也進行了回顧「 Type 1 diabetes: from the dream of automated insulin delivery to a fully artificial pancreas 」。
自動胰島素輸送系統的技術進展
持續皮下胰島素輸送(CSII)泵的發展
持續皮下胰島素輸送泵,簡稱CSII泵,作為糖尿病治療領域的一項重要創新,已經顯著改善了1型糖尿病(T1D)患者的治療效果和生活品質。從最早的原型到現今的高度整合化裝置,CSII泵的演進反映了醫療技術的快速發展以及對糖尿病管理需求的深入理解。
初始階段:早期探索
CSII泵的歷史可以追溯到20世紀70年代,當時的裝置雖然實作了持續胰島素輸送的基本功能,但體積龐大且操作復雜,限制了其廣泛套用。然而,這些早期的嘗試為後續技術的進步奠定了基礎,標誌著向自動化糖尿病管理轉變的重要一步。
技術突破:微型化與智慧化
隨著微電子學和材料科學的發展,CSII泵經歷了一系列重大技術革新。這些泵逐漸變得更小巧、更輕便,患者可以方便地佩戴在身上,幾乎不受日常活動的影響。此外,智慧化的控制系統使得泵能夠更準確地模擬人體的胰島素分泌模式,提高了治療的精確度和個人化程度。
使用者體驗的改善:從患者需求出發
設計師和工程師在CSII泵的開發過程中越來越註重使用者體驗。透過對患者需求的深入了解,新一代CSII泵不僅功能強大,而且操作簡便,患者可以輕松進行個人化設定。此外,與行動應用和健康管理平台的整合,使患者和醫生能夠即時監控治療數據,進一步提升了糖尿病的管理效率和效果。
朝著全自動人造胰腺邁進
CSII泵的不斷進步為實作全自動人造胰腺—— 一個能夠根據即時血糖水平自動調整胰島素輸送的系統 ——奠定了堅實的基礎。當前的研究和開發正集中於提高泵的智慧化水平,使其能夠 更準確地預測和響應患者的胰島素需求,從而實作更加精細和自主的糖尿病管理 。
即時連續血糖監測(CGM)系統
即時連續血糖監測(CGM)系統是管理1型糖尿病(T1D)不可或缺的一部份,其技術革新極大地改善了患者的生活品質並最佳化了血糖控制。CGM系統透過持續監測患者的血糖水平,為患者和醫療團隊提供了前所未有的血糖管理能力。
CGM系統的技術演進
CGM技術自推出以來,經歷了多代產品的更新。早期系統雖然能夠提供連續的血糖讀數,但由於其較大的尺寸、復雜的使用流程及較低的準確性,限制了其普及。隨著傳感器技術、微電子學和數據處理技術的進步,最新一代CGM系統已經變得更加小巧、使用更為便捷,且準確性大幅提高。
CGM系統對糖尿病管理的影響
CGM系統對於提高糖尿病患者的血糖控制水平具有重要意義。 透過即時監測血糖水平,患者可以即時調整飲食、運動和胰島素劑量,從而更有效地管理血糖波動 。此外,CGM系統還能夠預警潛在的高血糖或低血糖事件,極大地降低了這些血糖異常對患者健康的威脅。
CGM系統的未來發展趨勢
隨著技術的不斷進步,未來的CGM系統將更加智慧化和個人化。基於人工智慧演算法的數據分析能力將使CGM系統 不僅能夠提供即時血糖讀數,還能夠預測血糖趨勢並向患者提供個人化的管理建議 。此外,未來的CGM系統可能會與可穿戴裝置、智慧型手機等其他裝置更緊密地整合,為患者提供一個全面的健康管理生態系。
CGM系統與自動胰島素輸送系統的融合
CGM系統與 自動胰島素輸送(AID) 系統的融合是糖尿病技術發展的重要趨勢之一。這種整合化的治療方案能夠根據CGM系統提供的即時血糖數據自動調整胰島素泵的輸送,實作更加精細和個人化的血糖控制。這種閉環系統的發展,標誌著向全自動人造胰腺邁出了重要一步。
低血糖暫停(LGS)與預測性LGS系統
在糖尿病管理中,避免低血糖事件的發生是至關重要的,特別是對於需要密切監控血糖水平的1型糖尿病(T1D)患者。低血糖暫停(LGS)系統和預測性LGS系統的出現,為減少低血糖風險提供了革命性的解決方案。
低血糖暫停(LGS)系統的工作原理
LGS系統與持續皮下胰島素輸送泵(CSII泵)和即時連續血糖監測(CGM)系統相結合,能夠即時監控患者的血糖水平。當系統檢測到血糖水平低於預設的安全閾值時,它會自動暫停胰島素的輸送,防止血糖進一步下降,從而避免低血糖事件的發生。
預測性LGS系統的技術進步
預測性LGS系統在LGS的基礎上進一步發展,不僅能夠響應當前的低血糖狀態,還能夠預測血糖水平的趨勢。透過高級演算法分析CGM提供的血糖數據,系統能夠預見到血糖即將下降至危險水平,並在此之前就自動調整胰島素輸送, 更加主動地預防低血糖事件的發生 。
LGS系統在糖尿病管理中的作用
LGS系統和預測性LGS系統為T1D患者提供了額外的安全網,減輕了患者對低血糖的擔憂,使他們能夠更加自信地管理自己的疾病。這些系統特別適用於夜間,當患者可能無法感覺到低血糖癥狀時,能夠有效地減少無癥狀低血糖事件,提高患者的睡眠品質和生活品質。
LGS系統的未來發展
隨著技術的不斷進步和演算法的持續最佳化,預測性LGS系統的準確性和可靠性將進一步提高。未來的系統可能會 更加智慧化,能夠根據患者的生活習慣、活動水平胡飲食模式進行個人化調整,實作更加精準和個人化的低血糖預防 。此外,隨著人工智慧和機器學習技術的融入,預測性LGS系統將能夠更好地適應患者的變化,為糖尿病患者提供更加全面和主動的保護。
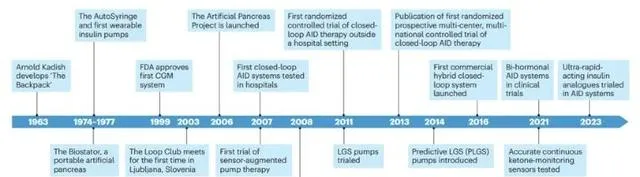
自動胰島素輸送系統的技術和臨床發展 (Credit: Nature Medicine )
朝全自動人造胰腺的步伐
傳感器增強泵療法
在追求全自動人造胰腺的行程中, 傳感器增強泵療法(SAP) 成為了一個重要的裏程碑。它透過將即時連續血糖監測(CGM)系統與持續皮下胰島素輸送泵(CSII泵)結合起來,實作了對1型糖尿病(T1D)患者血糖水平的更精確調節。
SAP技術的核心優勢
SAP技術的核心在於其 能夠提供即時的血糖水平反饋,並根據這些資訊自動調整胰島素泵的輸送率 。這一過程減少了患者手動監測和調節胰島素的需求,從而降低了出錯的風險,增加了血糖控制的準確性和穩定性。
SAP技術的實際套用
在實際套用中,SAP技術使患者能夠看到自己血糖水平的即時變化,以及胰島素泵如何對這些變化作出響應。這不僅幫助患者更好地理解自己的糖尿病管理,也為醫生提供了寶貴的數據,以便進行更為個人化的治療計劃調整。
面臨的挑戰和解決方案
盡管SAP技術帶來了顯著的改進,但在實際操作中仍然面臨一些挑戰,例如 傳感器的準確性、裝置的可靠性以及使用者介面的友好性等 。為了克服這些挑戰,研發團隊正不斷改進傳感器技術,提高數據處理演算法的智慧化水平,並最佳化使用者介面設計,使其更加直觀易用。
展望未來,SAP技術將繼續向更高的智慧化、整合化方向發展。 未來的系統將更加精準地預測血糖變化趨勢,即時調整胰島素輸送策略,甚至能夠自動辨識和適應患者的生活模式變化。 這些進步將使SAP技術在實作全自動人造胰腺的道路上邁出更堅實的一步,為T1D患者帶來更加自由和高品質的生活。
混合閉環系統:過渡技術的角色
在實作全自動人造胰腺的旅程中,混合閉環系統扮演了不可或缺的過渡角色。這種系統整合了即時連續血糖監測(CGM)和持續皮下胰島素輸送(CSII)泵的功能,能夠自動調節大部份胰島素的輸送,但 仍需使用者參與部份決策 ,如飲食時的胰島素劑量調整。
混合閉環系統的工作原理
混合閉環系統透過先進的演算法分析CGM提供的血糖數據,自動調整CSII泵的胰島素輸送速率,以維持血糖水平在目標範圍內。系統能夠預測血糖趨勢,並在檢測到血糖即將偏離目標範圍時主動調節胰島素輸送,減少使用者的幹預需求。
混合閉環系統的臨床效益
混合閉環系統在提高血糖控制水平、降低低血糖風險以及改善患者生活品質方面展現出顯著的潛力。透過自動調節胰島素劑量,該系統能夠減少血糖的劇烈波動,為患者提供更穩定的血糖管理方案。
面臨的挑戰
盡管混合閉環系統取得了顯著進步,但在實作完全自動化管理前仍面臨一些挑戰,包括提高系統的準確性、可靠性和使用者友好性,以及解決餐後血糖控制的問題。此外,教育和培訓對於確保患者能夠正確使用這一技術也至關重要。
隨著技術的不斷進步,混合閉環系統正逐步向全自動人造胰腺邁進。未來的系統將更加智慧化,能夠更準確地預測和應對血糖波動,減少甚至消除使用者的幹預需求。此外,系統的整合化和模組化將為患者提供更加個人化和便捷的糖尿病管理方案。
全閉環自動胰島素輸送系統的研究
全閉環自動胰島素輸送系統,常被視為「人造胰腺」的終極形態,旨在徹底自動化1型糖尿病(T1D)患者的血糖管理 。該系統透過整合即時連續血糖監測(CGM)技術與持續皮下胰島素輸送(CSII)泵,無需使用者幹預即可實作血糖的精確控制。
全閉環系統的工作機制
全閉環系統透過即時監測患者的血糖水平,並根據預設的血糖目標範圍自動調節胰島素泵的輸送速率。系統中的 控制演算法會根據CGM數據預測血糖趨勢,並提前作出調整,以避免血糖過高或過低的情況發生 。
提高血糖控制的潛力
全閉環系統為T1D患者提供了一種前所未有的血糖管理方式。透過實作24小時不間斷的血糖監控與胰島素調節,該系統能顯著降低患者的血糖波動,減少低血糖和高血糖事件的發生,從而提高患者的長期血糖控制水平及生活品質。
面臨的挑戰
盡管全閉環系統展現出巨大的潛力,但在實際套用中仍面臨諸多挑戰。這些挑戰包括但不限於 演算法的準確性與適應力、裝置的可靠性、使用者的接受度以及長期的安全性評估 。此外,個體間的生理差異也要求系統具有高度的個人化調節能力。
當前,全球多個研究機構和企業正在積極開展全閉環系統的研究與開發工作。 透過不斷的臨床試驗和技術叠代,全閉環系統的效能正逐步提升。 未來,隨著演算法智慧化水平的提高以及生物傳感器技術的進步,全閉環自動胰島素輸送系統有望成為T1D管理的新標準。
創新驅動:公司與糖尿病患者的共同努力
糖尿病技術領域的新興企業
在全球範圍內,新興企業正在以其創新能力和靈活性推動糖尿病管理技術的發展。這些企業透過開發先進的監測裝置、智慧胰島素泵、以及基於雲端運算和大數據的管理平台,為糖尿病患者提供了更加個人化和高效的治療方案。 新興企業通常具有強烈的創新意識和快速的產品開發周期,使它們能夠迅速將最新的科研成果轉化為實用的糖尿病管理解決方案。這些企業在可穿戴裝置、人工智慧演算法、遠端醫療和患者教育等領域的探索,不僅提升了血糖監測和胰島素輸送的準確性和便捷性,也極大地豐富了糖尿病管理的維度。
盡管面臨著資金、市場準入和監管審批等挑戰,新興企業仍然透過與醫療機構、研究組織和患者社群的合作,不斷最佳化其產品和服務。此外,隨著全球糖尿病患病率的上升以及數位醫療技術的普及,這些企業在糖尿病技術領域的創新活動將面臨更廣闊的市場機遇。
糖尿病患者社群的貢獻
糖尿病患者社群在推動糖尿病管理技術進步中發揮著越來越重要的作用。透過社交媒體、論壇和自我管理套用,患者之間的資訊交流和經驗分享為技術創新提供了寶貴的使用者反饋和需求洞察。
在患者社群中,一些技術熟練的患者和開發者透過開源計畫合作開發了多種DIY糖尿病管理工具,如自訂胰島素泵控制系統和數據視覺化平台。 這些解決方案往往更加貼合患者的實際需求,提供了傳統醫療產品無法覆蓋的個人化功能。
糖尿病患者社群不僅是技術創新的受益者,更是創新過程的重要參與者。 他們的實際使用經驗和需求反饋對新興企業的產品設計和叠代至關重要,有助於推動更加人性化和高效的糖尿病管理解決方案的開發。
朝全自動人造胰腺的未來展望
連續酮體和乳酸監測
隨著自動胰島素輸送(AID)系統的不斷發展, 新型的生物監測技術,如連續酮體和乳酸監測,正在成為提高AID系統效能的關鍵因素 。這些監測技術不僅能為糖尿病患者提供更全面的健康資訊,也為實作全自動人造胰腺的目標提供了新的可能性。
連續酮體監測的重要性
酮體是體內糖尿病患者由於胰島素不足而產生的代謝產物,其水平的異常升高是糖尿病酮癥酸中毒(DKA)的主要標誌之一 。透過連續監測酮體水平,AID系統能夠及時發現患者的代謝異常,預防DKA的發生,從而提高治療的安全性。
連續乳酸監測的潛力
乳酸是人體在缺氧狀態下產生的一種物質,其水平的升高通常與組織缺氧或過度運動有關 。在糖尿病管理中,連續乳酸監測能夠幫助評估患者的身體狀態,特別是在運動或其他高能耗活動中,為AID系統提供重要的調節依據。
監測技術對AID系統的影響
整合了連續酮體和乳酸監測的AID系統能夠提供更為全面的代謝狀態資訊,使系統能夠更加精確地調節胰島素的輸送。這種高度整合化的監測能力,將AID系統從單一的血糖控制工具轉變為全面的代謝管理平台。
技術發展的挑戰
盡管連續酮體和乳酸監測技術具有巨大的套用潛力,但目前仍面臨一些技術和臨床套用的挑戰。這包括 提高傳感器的穩定性和準確性、延長傳感器的使用壽命、以及確保監測數據的即時性和可靠性 。
超快速作用胰島素類似物和雙激素系統
在追求全自動人造胰腺的行程中,超快速作用胰島素類似物和雙激素系統的研發成為了重要的裏程碑。這些新療法的出現,為提高自動胰島素輸送(AID)系統的效能和效率提供了新的可能性。
超快速作用胰島素類似物的優勢
超快速作用胰島素類似物能夠在註射後迅速發揮作用,縮短胰島素起效時間,更加貼近人體自然分泌胰島素的速率 。這種胰島素的快速響應特性,使得AID系統能夠更加精確地調節血糖水平,特別是在飲食導致的血糖波動較大時,能夠有效減少高血糖的風險。
雙激素系統的工作原理
雙激素系統不僅輸送胰島素以降低血糖,還能夠輸送胰高血糖素類似物來防止低血糖的發生 。這一系統能夠模擬健康胰腺的工作方式,根據血糖水平的即時變化,自動調節兩種激素的輸送,實作更加平穩和自然的血糖控制。
提高AID系統效能的潛力
超快速作用胰島素類似物和雙激素系統的結合使用,為全自動人造胰腺的實作提供了強有力的支持。這些新療法能夠提高AID系統對血糖波動的響應速度和準確性,特別是在控制餐後血糖和預防低血糖方面展現出巨大的優勢。
雖然超快速作用胰島素類似物和雙激素系統在理論上具有巨大的套用潛力,但在實際套用中仍面臨著諸多挑戰,包括 激素穩定性、輸送系統的精確性、以及長期安全性等問題 。 未來的研究需要解決這些問題,同時,隨著技術的不斷進步和臨床試驗的深入,這些新療法有望在不久的將來為糖尿病患者帶來更加有效和安全的治療方案。
未來的技術和治療策略
隨著科技的不斷進步,全自動人造胰腺系統的研發正在邁向新的裏程碑。未來的技術和治療策略將更加精細化、個人化,以滿足1型糖尿病(T1D)患者多樣化的需求,進一步提升糖尿病管理的效率和效果。
智慧化演算法的進步
未來的人造胰腺系統將更加依賴於高度智慧化的演算法,這些演算法能夠實分時析患者的血糖數據、飲食習慣、生活方式及其他健康參數,從而進行更為精確的胰島素劑量調節。透過大數據和機器學習技術的套用,這些演算法將不斷自我最佳化,提供更加個人化的糖尿病治療方案。
穿戴式技術的融合
未來的人造胰腺系統將更廣泛地利用穿戴式技術,如智慧型手錶、健康監測貼片等,以無創或微創方式即時監測患者的生理指標。這些技術的融合不僅能夠提供更為全面的健康數據,還能提高患者使用人造胰腺系統的舒適度和便捷性。
多參數監測技術的發展
除了血糖監測外,未來的人造胰腺系統還將整合多種生理參數監測技術,如連續酮體監測、乳酸水平監測等,以全面評估患者的代謝狀態。這些多參數監測技術的整合將使人造胰腺系統能夠更全面地理解患者的健康狀況,實作更為精細的糖尿病管理。
治療策略的多樣化
隨著研究的深入,未來的人造胰腺系統可能不僅限於胰島素的輸送。研究人員正在探索包括 胰島素類似物、胰高血糖素樣肽-1(GLP-1)激動劑、雙激素治療策略(如胰島素和胰高血糖素)在內的多種治療手段 ,以更全面地模擬人體的生理機制,實作更優的血糖控制效果。
Q&A
全自動人造胰腺如何工作?
全自動人造胰腺系統結合了即時連續血糖監測(CGM)技術和持續皮下胰島素輸送(CSII)泵。系統透過智慧演算法實分時析血糖數據,並根據需要自動調整胰島素輸送,以保持血糖水平在目標範圍內。
全自動人造胰腺系統的主要組成部份有哪些?
全自動人造胰腺系統主要包括三個核心部份:一個連續監測血糖水平的CGM裝置,一個根據CGM數據調節胰島素輸送的CSII泵,以及一個內建智慧演算法的控制器,用於分析數據並做出決策。
全自動人造胰腺系統與現有糖尿病治療方法相比有何優勢?
與傳統糖尿病治療方法相比,全自動人造胰腺系統能夠提供更加連續和精確的血糖控制,減少低血糖和高血糖事件的發生,降低患者的管理負擔,改善患者的生活品質。
全自動人造胰腺系統面臨的主要挑戰是什麽?
全自動人造胰腺系統面臨的挑戰包括提高系統的準確性和可靠性、確保患者的使用安全、以及滿足不同患者的個人化需求。此外,技術的推廣和普及還需克服經濟成本和醫療體系整合的障礙。
全自動人造胰腺的未來發展方向是什麽?
未來的全自動人造胰腺系統將更加智慧化和個人化,透過引入更先進的監測技術和治療策略,實作更精確的血糖控制。同時,研究人員也在探索新的治療方法,如雙激素系統,以進一步完善系統效能。
參考文獻
Phillip M, Kowalski A, Battelino T. Type 1 diabetes: from the dream of automated insulin delivery to a fully artificial pancreas. Nat Med. Published online March 6, 2024. doi:1 0.1038/d41591-024-00013- 5
Pfeiffer, E., Thum, Ch. & Clemens, A. Horm. Metab. Res. 6, 339–342 (1974).
Bergenstal, R.M. et al. N. Engl. J. Med. 369, 224–232 (2013).
Battelino, T. & Phillip, M. J. Pediatr. Endocrinol. Metab. 17, 375–376 (2004).
Kowalski, A.J. Diabetes Technol. Ther. 11 S1, S113–S119 (2009).
Bergenstal, R.M. et al. N. Engl. J. Med. 363, 311–320 (2010).
Battelino, T., Nimri, R., Dovc, K., Phillip, M. & Bratina, N. Diabetes Care 40, 764–770 (2017).
Hovorka, R. et al. Lancet 375, 743–751 (2010).
Phillip, M. et al. N. Engl. J. Med. 368, 824–833 (2013).
Tauschmann, M. et al. Lancet 392, 1321–1329 (2018).
Armiger, R., Reddy, M., Oliver, N.S., Georgiou, P. & Herrero, P. J. Diabetes Sci. Technol. 16, 29–39 (2022).
Biester, T. et al. Diabetes Obes. Metab. 23, 599–608 (2021).
Alva, S., Castorino, K., Cho, H. & Ou, J. J. Diabetes Sci. Technol. 15, 768–774 (2021).
Nwokolo, M. et al. Diabetes Technol. Ther. 25, 856–863 (2023).
Blauw, H., Onvlee, A.J., Klaassen, M., van Bon, A.C. & DeVries, J.H. Diabetes Care 44, 836–838 (2021).
Tsoukas, M.A. et al. Lancet Digital Heal 3, e723–e732 (2021).
責編 |探索君
排版|探索君
轉載請註明來源於 【生物探索】
End











