癌癥是人類發病率和死亡率第二高的疾病,中國2022年癌癥新發病例482萬、死亡病例257萬,均居世界首位,以至於很多民眾「談癌色變」。
腫瘤靶向遞藥是已在臨床上廣泛套用的癌癥治療手段,顧名思義,科學家們希望將裝載有奈米腫瘤藥的「包裹」精確遞送至腫瘤細胞位置,並將其徹底清除。但現實情況是,傳統遞藥系統的腫瘤靶向效率極低,靶向治療的療效有限。

浙江大學化學工程與生物工程學院教授申有青帶領計畫團隊,經過十五年的科研攻關,從設計合成醫用功能高分子入手,發現了腫瘤主動「索取」藥物的腫瘤主動遞藥新機制,構建了智慧遞藥系統,克服了「從血管出不來」和「瘤內進不去」兩大瓶頸難題,顯著提高了靶向治療的療效。
6月24日上午,2023年度國家科學技術獎在北京揭曉,這項成果獲得國家自然科學獎二等獎。
創新機制,攻克兩大瓶頸問題
從小動物模型腫瘤的研究提出的傳統理論,發現腫瘤毛細血管有眾多孔隙,遞藥系統可以透過這些孔隙「漏」進瘤內實作富集,即EPR效應,研究人員也依此設計了諸多遞藥系統。然而,臨床實踐發現,人的腫瘤血管孔隙少,遞藥系統實際上難以從血管中「漏」出來進而進入腫瘤組織,同時這些遞藥系統也難以擴散到達瘤內深處。「從血管中出不來」「鉆不進腫瘤」一直是腫瘤靶向遞藥懸而未解的兩大難題,嚴重制約了藥效發揮。
正電性高分子誘導細胞轉胞運的現象(動畫)
既然遞藥系統自身的「被動擴散」效果有限,那麽能否轉換思路,引導癌癥細胞進行「主動傳遞」?從這個思路出發,團隊首次發現了高分子觸發細胞轉胞運的現象,即細胞可以主動吞噬高分子載體,然後再從其他部位將其吐出去。在這個發現的基礎上,團隊建立起腫瘤主動遞藥機制。與傳統遞藥系統截然不同的是,曾經只是被動等待的腫瘤細胞被啟用了,它們不僅會主動將血液中的遞藥系統抓取到腫瘤組織中來,而且在自己「飽餐一頓」之後,還樂於將藥物「分享」給其他腫瘤細胞。而曾經大費周章地在血液中尋找通往腫瘤組織入口的遞藥系統,現在可以輕輕松松地「鉆」進敵軍內部,並將腫瘤細胞一網打盡。由此,腫瘤靶向遞藥獲得了變革性的療效。
高分子誘導細胞間連續轉胞運「主動」滲透腫瘤的原理(動畫)
在該理論的指導下,團隊利用γ-谷氨酰轉肽酶在胰臟癌等腫瘤高表達的特點,設計合成了酶響應性高分子聚合物,可使得在血液中原本呈現為電中性或電負度的奈米藥,在達到腫瘤之後可快速「轉性」,呈現出正電性,進而完成奈米藥的跨細胞快速「接力」轉運。
統籌設計,構築高效遞藥系統
在創新理論的基礎上,團隊也將視野延伸到開發合適的高分子遞藥材料上,為規模化生產鋪平道路。載體結構明確、無毒且能規模化生產是臨床轉化套用的關鍵。作為分子結構明確的單分散合成高分子,樹狀高分子是理想的遞藥載體。但傳統樹狀高分子的合成基元反應效率低、副產物多,導致其純化困難、單分散高分子產率極低,無法規模化套用。針對這一難題,團隊提出了不對稱單體對「正交雙點選反應」的樹狀高分子合成新方法,簡化了合成步驟,提升了產率和合成效率,並顯著提高了高分子結構的精準性。據了解,利用新方法,第五代樹狀高分子在一天之內就可以合成。
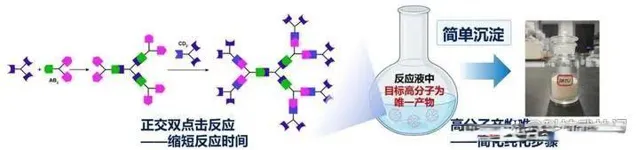
單分散高分子載體合成新方法
在新機制的指導下,團隊還利用載體材料構築起高效遞藥系統。為實作腫瘤靶向遞藥的療效最大化,在解決了兩大瓶頸難題後,團隊還梳理出包括血液迴圈、血管外滲、瘤內滲透、細胞攝取和藥物釋放在內的五步級聯過程,詳細闡明了高分子載體尺寸、表面電勢、穩定性等奈米特性與各步效率間的關系,揭示了各步對奈米特性的矛盾要求,並提出了透過載體性質自適應將遞藥系統各功能進行整合和協同的原則,建立起載體性質調控方法,實作了遞藥系統的功能整合。
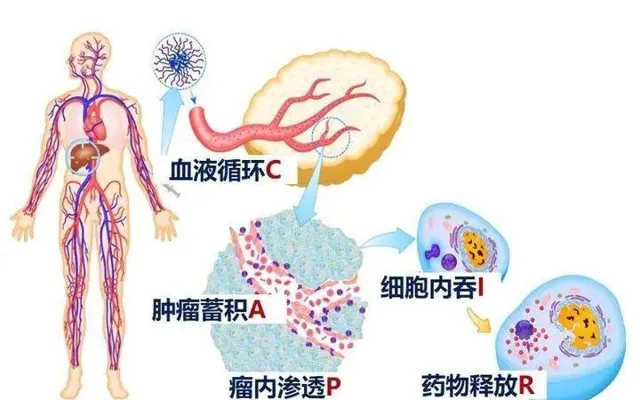
CAPIR五步級聯過程
團隊的創新性理論指導實作3項轉化成果,其中1項已在美、韓開展臨床試驗並獲得美國孤兒藥授權,另2項分別獲中、美臨床試驗批件,為胰臟癌、肺癌和大腸癌等癌癥的治療提供有力支持。

「我們團隊將繼續深入研究,進一步闡明高分子結構與轉胞運能力之間的關系,發展功能整合型高分子精準合成方法,構建更高效的遞藥系統,為戰勝癌癥病魔提供有力武器。」申有青說。











