*仅供医学专业人士阅读参考
直击乳腺癌盛会,ADC研究抢先看!
撰文丨 是橘不是桔
2023 圣安东尼奥乳腺癌会议(SABCS)即将开幕!近年来,在科学家和临床医生的共同努力下,乳腺癌的诊断与治疗取得了长足进步,新的生物标记物不断被发现,个体化治疗的方案也日益丰富。其中,抗体药物偶联物(ADC)作为肿瘤领域的研究热点,在乳腺癌领域的研究也如火如荼。 赶快跟随医学界小编,共同探索入选此次SABCS大会的重磅ADC相关研究内容吧 !
全新探索!HER2阳性患者迎治疗新篇章
1、HER2CLIMB-02:Tucatinib和恩美曲妥珠单抗治疗经治HER2阳性转移性乳腺癌的随机化、双盲、III期试验
(研究结果将于SABCS会议期间公布)
2、III期JCOG1607 HERB TEA研究:恩美曲妥珠单抗与曲妥珠单抗、帕妥珠单抗和多西他赛治疗HER2阳性转移性乳腺癌(mBC)老年患者的疗效与安全性比较
对于HER2阳性mBC患者,曲妥珠单抗、帕妥珠单抗和多西他赛联合用药(HPD)被推荐为一线治疗方案。但对于老年患者来说,HPD常常会带来不可承受的毒性,很难保持足够的剂量强度。因此,老年患者群体亟需毒副作用较小且不劣于HPD疗效的新型治疗方案。
研究纳入年龄65岁及以上、既往未接受过化疗和抗HER2靶向治疗的HER2阳性mBC患者。治疗方案为恩美曲妥珠单抗(T-DM1)3.6mg/kg Q3W,或HPD方案(曲妥珠单抗8mg/kg,然后6mg/kg;帕妥珠单抗840mg,然后420mg/人;多西他赛60mg/m 2 ,若无不可控制的毒副作用可以提高至75mg/m 2 )Q3W,按1:1随机分组。研究主要终点为总生存期(OS),次要终点为无进展生存期(PFS)、有效率(RR)、不良事件、乳腺癌特异性死亡累积率(BCSM)、安全性和日常活动下降情况等。
2018年1月至2023年3月期间,总共招募了148例患者。T-DM1组和HPD组的中位年龄分别是72岁和71岁。两组间激素受体(HR)阳性患者的比例平衡。T-DM1组相比HPD组在OS方面未达到非劣效性终点(HR 1.487)。T-DM1组和HPD组的PFS分别为9.8个月和18.4个月。T-DM1组的RR(52.7%)低于HPD组(76.8%)。T-DM1组的BCSM高于HPD组。T-DM1组中3级或以上中性粒细胞减少症发生率低于HPD组(0 vs 30.4%),但血小板减少发生率(16.9%)高于HPD组(0%)。T-DM1组3级或以上非血液学不良反应(35.2%)低于HPD组(58.6%),包括乏力(5.6% vs 22.9%)、腹泻(0% vs 11.4%)、食欲减退(8.5% vs 11.4%)以及发热性中性粒细胞减少(0% vs 10.0%)。
T-DM1在OS方面未达到HPD的非劣效性结局,但是T-DM1在不良事件发生率和严重程度方面结局良好。由于乳腺癌老年患者具有异质性的健康状况,因此,根据年龄或老年评估进行亚组分析有可能识别出更适合T-DM1治疗方案的HER2阳性mBC老年患者群体。
重磅更新!HER2低表达mBC患者预后再提升
1、德曲妥珠单抗(T-DXd)联合阿那曲唑或氟维司群治疗HER2低表达、HR+晚期/转移性乳腺癌患者:一项Ib期、开放标签、多中心、剂量扩展研究(DESTINY-Breast08)
DESTINY-Breast08(DB-08)旨在确定德曲妥珠单抗(T-DXd)与广泛使用的标准治疗方案在HER2低表达、HR阳性转移性乳腺癌(mBC)患者中的安全性、耐受性和初步活性。此次会上报告的结果来自于DB-08研究的剂量扩展阶段,主要探索了T-DXd与内分泌治疗(ET)的联合疗法。
研究纳入HER2低表达且HR+的晚期/转移性mBC患者。患者接受T-DXd 5.4 mg/kg 静脉注射(IV)每三周1次(Q3W)+口服阿那曲唑1mg每日(T-DXd+ANA)或T-DXd 5.4 mg/kg IV Q3W +氟维司群500 mg肌内注射Q4W(T-DXd+FUL)。研究主要终点为安全性和耐受性,次要终点包括客观缓解率(ORR)、PFS、缓解持续时间(DoR)和OS。
截至2023年2月,T-DXd+ANA组中21名患者和T-DXd+FUL组中20名患者接受了治疗。中位年龄分别为55岁和66岁,T-DXd+ANA组中67%和T-DXd+FUL组中75%的患者曾接受过内分泌±靶向治疗,T-DXd+ANA组中33%和T-DXd+FUL组中25%的患者没有接受用于转移性乳腺癌的前期治疗。T-DXd+ANA组和T-DXd+FUL组的中位随访时间分别为12.1个月(范围4.0-17.3个月)和8.5个月(范围1.3-15.1个月)。T-DXd+ANA组中95.2%的患者和T-DXd+FUL组中100%的患者发生了不良事件(AEs),T-DXd+ANA组47.6%的患者和T-DXd+FUL组55.0%的患者发生≥3级AEs。通过减量或中断药物可控制不良事件。T-DXd+ANA组的ORR为71.4%,T-DXd+FUL组为40.0%。总生存数据尚未达到。
表1 安全性与疗效结局
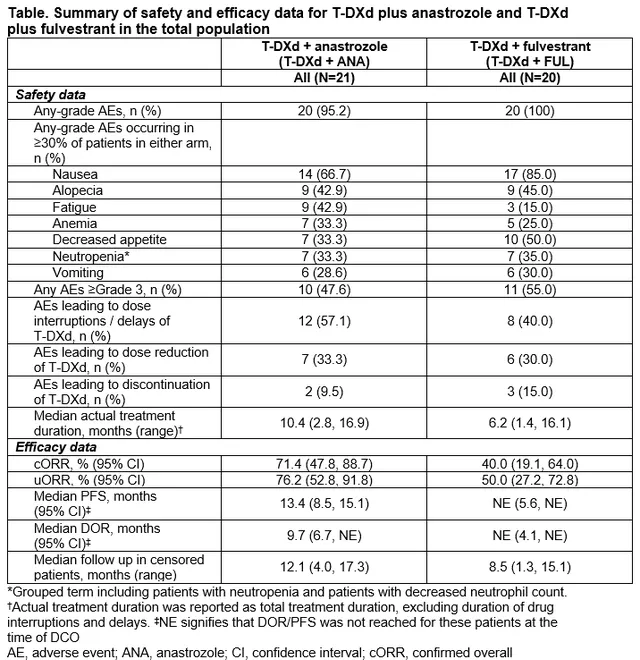
T-DXd联合内分泌治疗方案的安全性结局与T-DXd单药治疗相当,通过剂量调整和常规临床实践可控制。T-DXd联合阿那曲唑或氟维司群在HER2低表达、HR阳性mBC患者的一线或二线治疗中表现出活性。
2、BB-1701在局部晚期/转移性HER2低表达乳腺癌症患者中的安全性、耐受性、药代动力学和抗肿瘤活性的I期研究队列扩展报告
BB-1701是一种新型ADC药物,由与曲妥珠单抗相同序列的人源化IgG1κ单克隆抗HER2抗体与艾立布林连接而成。艾立布林是一种微管抑制剂,已获批用于治疗失败后的mBC和进展性脂肪肉瘤的治疗。本研究报告了BB-1701在HER2低表达乳腺癌患者中正在进行的I期队列扩展试验的初步结果(NCT04257110)。
研究纳入≥18岁,经确诊为局部晚期/转移性HER2低表达乳腺癌(IHC 2+且FISH阴性,或IHC 1+),并经历至少两线标准治疗失败且ECOG PS≤2的患者。HER2表达情况在入组前通过IHC和FISH确定。样本扩增组给予4组剂量水平的BB-1701(1.0 mg/kgQ3W、1.2 mg/kg Q3W、1.4 mg/kg Q3W和1.6 mg/kg Q3W)。研究旨在评估BB-1701的安全性、耐受性和初步抗肿瘤活性。患者每6周接受一次放射学评估。
截至2023年6月30日,共入组40例患者。其中,1.0 mg/kg Q3W组5例,1.2 mg/kg Q3W组20例,1.4 mg/kg Q3W组5例,1.6 mg/kg Q3W组10例。中位年龄55岁(范围30-74岁),女性占97.5%,ECOG PS 0级/1级患者分别占30.0%/70.0%。中位治疗线数为3(范围2-9)。所有患者治疗期间均至少出现1种AEs,30例患者出现治疗相关不良事件(TRAEs)。最常见的所有级别TRAEs(≥20%)为周围神经病变、天门冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高、贫血、白细胞计数减少。3级TRAEs包括周围神经病变(3例)、周围感觉神经病变(2例)、中性粒细胞计数减少(2例)、血小板计数减少(1例)、白细胞计数减少(1例)。未见4级或5级事件。严重TRAEs包括感觉神经病变(1例)和输液反应(1例)。未报告间质性肺病。无患者因AEs中止治疗。在38例可评估疗效的患者中,1.0mg/kg组有2例达到部分缓解(PR),2例疾病稳定(SD),最佳总体疗效(BOR)为40.0%,疾病控制率(DCR)为80.0%。1.2mg/kg组有5例达到PR,11例SD,BOR为27.8%,DCR为88.9%。1.4mg/kg组有2例达到PR,2例SD,BOR为40.0%,DCR为80.0%。
总体而言,BB-1701在HER2低表达乳腺癌中的初步抗肿瘤活性显示出潜力,包括之前接受过抗HER2药物联合化疗的患者,并且安全性也可控。
结果喜人!Dato-DXd BC亚组数据更新
在HR+、HER2-不可手术或转移性乳腺癌中比较Datopotamab deruxtecan(Dato-DXd)与化疗的随机III期研究:TROPION-Breast01的疗效、安全性和生物标志物结果
III期 TROPION-Breast01全球研究(NCT05104866)评估了以TROP2为靶点的ADC药物Dato-DXd与依托泊苷、紫杉醇、卡培他滨或吉西他滨(ICC)联合化疗方案在不能手术或转移性HR+/HER2‒的患者中的疗效。主要结果已在2023 ESMO大会上公布。此次SABCS大会上将公布TROPION-Breast01研究的扩展数据。
研究纳入年龄≥18岁,不能手术或转移的HR+/HER2‒、药物治疗失败或不适合继续药物治疗且已接受1-2个线系统化疗的乳腺癌患者。患者按1:1随机分组,分别给予Dato-DXd(Q3W 6mg/kg)或ICC直至疾病进展或不可耐受的毒性。研究主要终点为盲性独立中心评估(BICR)的PFS和OS(RECIST 1.1标准)。
截至2023年7月17日,共纳入732例患者,其中Dato-DXd组365例, ICC组367例。Dato-DXd组和ICC组分别有93例/39例患者仍在治疗中。接受Dato-DXd治疗的患者PFS显著优于ICC组。在转移前线数(1线vs 2线)、以前使用CDK4/6抑制剂时间(≤12个月vs >12个月)、转移前使用药物治疗时间(<6个月vs ≥6个月)和脑转移(有vs无)等预定义的亚组中,Dato-DXd组PFS均优于ICC组。总体OS数据未达到。Dato-DXd组与ICC组后续治疗人数分别为192例(53%)对247例(67%),包括15例(4%)及52例(14%)使用后续ADC治疗,165例(45%)及186例(51%)使用后续化疗。Dato-DXd组首次后续治疗时间中位数为8.2个月,ICC组为5.0个月[HR 0.53(95%CI 0.45–0.64)]。整体而言,Dato-DXd组≥3级TRAEs发生率远低于ICC组。二次患者报告结果显示,Dato-DXd组体能状态、疼痛和全球健康状况/生活质量恶化时间均迟于ICC组。
TROPION-Breast01研究达到PFS主要终点,Dato-DXd组PFS显著优于ICC组,在所有亚组中都具有统计学和临床意义。总而言之,Dato-DXd组安全性和生活质量均优于ICC组。这些数据支持Dato-DXd作为已经接受1-2线化疗后的不能手术或转移HR+/HER2‒ BC患者的一种潜在治疗选择。
责任编辑:Sheep
*医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。











