美國中部時間3月12日,2024年美國皮膚病學會(AAD)年會圓滿落幕。銀屑病是一種遺傳與環境共同作用誘發的免疫介導的慢性、復發性的炎癥性皮膚疾病,除了引起皮損癥狀外,還會嚴重影響患者的生活質素,本次AAD會議上,銀屑病治療的相關研究獲得了各國學者的廣泛關註。
重點一覽:
瑞莎珠單抗治療中重度銀屑病患者有效清除皮損且維持長期療效可達2年
佩索利單抗每4周一次皮下註射預防泛發性膿皰型銀屑病(GPP)的發作
氘可來昔替尼治療中重度斑塊狀銀屑病的療效可維持148周
研究設計
該研究共納入255名患者, 按照1:1:1:1:1:1隨機分組接受JNJ-77242113(25mg QD、50mg QD、100mg QD、25mg BID、100mg BID)治療或安慰劑治療,為期16周。
入組標準:1.年齡≥18歲;2.PASI≥12,研究者整體評估(IGA)≥3,銀屑病皮損體表面積(BSA)≥10%;3.確診銀屑病(PsO),伴或不伴銀屑病關節炎(PsA),持續≥6個月;4.接受光療或系統治療者。
研究結果
與安慰劑組相比,每個JNJ-77242113治療組在第16周時銀屑病皮損面積與嚴重程度指數(PASI)較基線改善的平均百分比明顯更大(P均<0.001)(圖1)。
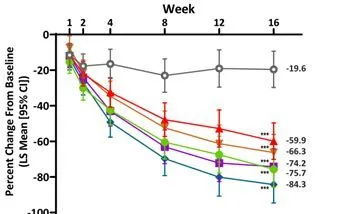
圖1治療16周,PASI的平均百分比變化
註:***:與安慰劑相比,P<0.001。
與安慰劑組相比,每個JNJ-77242113治療組在第16周達到絕對PASI評分 =0、≤1、≤2、≤3和≤5的患者比例明顯更高#(圖2)。
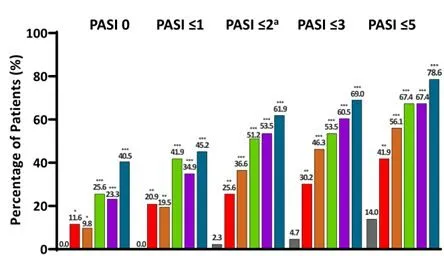
圖2第16周內達到絕對PASI評分的患者比例
註:與安慰劑相比,*、**、***分別為P<0.05、P<0.01、P<0.001。
#:與安慰劑組相比, 25mg QD組PASI =0(P<0.05),PASI≤1/PASI≤2/PASI≤3/ PASI≤5的P均<0.01;
25mg BID組PASI =0(P<0.05),PASI≤1(P<0.01),PASI≤2/ PASI≤3/ PASI≤5的P均<0.001;
50mg QD、100mg QD、100mg BID組PASI =0/PASI≤1/PASI≤2/ PASI≤3/ PASI≤5的P均<0.001
與安慰劑組相比,每個JNJ-77242113治療組在第12周達到BSA≤3%和≤1%的患者比例明顯更高。從第12周到第16周,所有JNJ-77242113治療組患者的應答率均有所增加(圖3)。
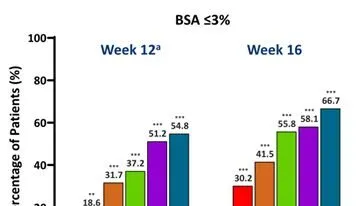
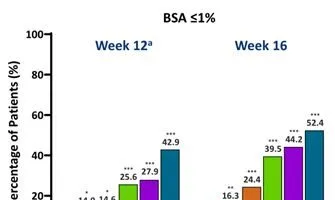
圖3第12周和第16周時達到BSA的患者比例
註:與安慰劑相比,*、**、***分別為P<0.05、P<0.01、P<0.001。
研究結論
瑞莎珠單抗治療中重度銀屑病實作皮損清除且維持長期療效可達2年
瑞莎珠單抗是一種IL-23抑制劑,已於2019年獲美國食品藥品監督管理局(FDA)批準用於治療中重度斑塊狀銀屑病。但其治療斑塊型銀屑病的長期真實有效性數據仍然缺乏。這項研究旨在評估接受瑞莎珠單抗治療患者達到美國國家銀屑病基金會(NPF)定義的治療目標以及在真實世界中維持臨床應答方面的長期療效。
研究設計
納入的297名患者均為中重度斑塊狀銀屑病成人(研究者總體評估≥3),他們在基線存取時開始使用瑞莎珠單抗,並在24(±3)個月後持續使用。在24個月時評估是否達到NPF定義的理想目標(BSA≤1%)或可接受目標(BSA≤3%或BSA較基線改善≥75%)。在第6個月和第12個月時PASI均為90%(PASI90)的患者中,評估第24個月時的維持情況(圖1)。
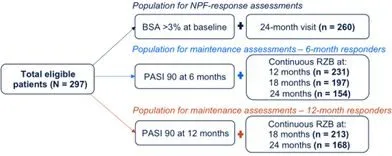
圖1評估的患者群體
註:BSA:銀屑病皮損體表面積;NPF:國家PsO基金會;PASI:銀屑病面積和嚴重程度指數;RZB:瑞莎珠單抗(Risankizumab)。
研究結果
在符合條件的297名患者中,260名基線時BSA>3%,並在24個月時評估了達到治療目標的情況。治療24個月後,260名基線BSA>3%的患者中,90.4%(235/260)和77.3%(201/260)分別達到了NPF定義的可接受目標(BSA≤3%或BSA較基線改善≥75%)和理想目標(BSA≤1%)(圖2)。

圖2連續使用RZB24個月後達到BSA≤3%或NPF定義的可接受目標和理想目標的患者百分比a
註:a:24個月時缺失結果資訊或基線時BSA≤3%的患者被排除在分析外;b:BSA≤3%或BSA改善75%;c:BSA≤1%。
在第6個月時達到PASI90且仍繼續使用RZB治療12、18和/或24個月的患者中,≥85%的患者維持臨床應答。在第12個月時達到PASI90且仍繼續使用RZB的患者中經過18和/或24個月的治療,≥86%的患者維持臨床應答。在第6個月和第12個月均達到PASI90並在第18和/或24月進行隨訪的患者中,133/144(92.4%)在18月內維持臨床應答,100/110(90.9%)的患者在24個月內可以維持PASI 90臨床應答(圖3)。
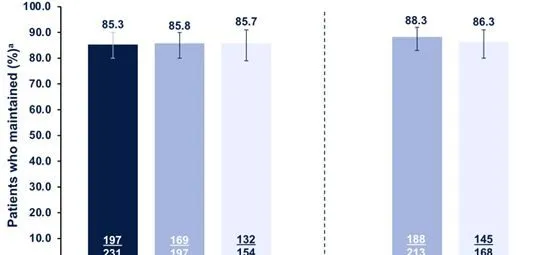
圖3 在第6或12個月達到PASI 90的患者中,連續使用RZB治療12、18和/或24個月時維持PASI90應答
註:a(%):是在可用於分析的患者中觀察到的(例如,在第6或12個月時達到PASI90應答率,並且在每次隨訪期間持續接受RZB治療)。
研究結論
在使用瑞莎珠單抗持續治療2年後,該真實世界研究中的大多數患者均達到了NPF定義的治療目標,並在24個月內維持了較高的皮損清除率。
每4周一次皮下註射佩索利單抗預防泛發性膿皰型銀屑病(GPP)的發作:Effisayil 2和Effisayil ON試驗
佩索利單抗是一種靶向作用於IL-36R的單複制抗體,已獲中國國家藥品監督管理局(NPMA)和美國食品藥品監督管理局(FDA)批準用於治療成人GPP急性發作。Effisayil 2和Effisayil ON 開放標簽擴充套件(OLE)試驗分別評估了佩索利單抗在預防GPP發作和治療GPP方面的療效與安全性。本研究透過Effisayil 2和Effisayil ON OLE試驗的數據,比較佩索利單抗皮下註射每4周一次與每12周一次的劑量方案預防GPP發作的相對療效。
研究設計
Effisayil 2試驗納入有GPP病史且既往至少發生過2次GPP復發,並在篩查期/隨機分組時GPP醫師總體評估(GPPGA)評分為 0 或 1的患者。患者隨機分配到佩索利單抗三個不同劑量組和一個安慰劑組:高劑量組為皮下註射600mg負荷劑量,隨後每4周註射300mg;其次是中劑量組,為皮下註射600mg負荷劑量,隨後每12周註射300mg;然後是低劑量組,皮下註射300mg負荷劑量,隨後每12周註射150mg;第四組為安慰劑對照組(圖1)。
研究主要終點:第48周內患者首次GPP發作的時間;關鍵次要終點:第48周內至少有一次GPP發作的發生率。GPP發作定義為GPPGA總分相較於基線增加≥2分,GPPGA膿皰單項評分≥2分。
Effisayil ON試驗納入的患者是在之前佩索利單抗的試驗(包括 Effisayil 2)中已完成治療,且沒有停藥。患者非隨機分配接受安慰劑和佩索利單抗皮下註射:根據先前試驗中的治療反應選擇劑量,既往試驗中不需要靜脈註射900mg 或接受安慰劑的患者每12周皮下註射300mg ;在先前試驗中需要靜脈註射900mg的患者每4周皮下註射300mg進行強化治療,劑量方案可根據GPPGA總分和膿皰評分變化、既往試驗中GPP發作史等相關的具體標準進行遞增或遞減(圖1)。
研究主要終點:至第252周的TEAE;次要終點:GPP復發以及接受佩索利單抗靜脈註射900mg治療的受試者達到GPPGA分數0或1的時間。GPP復發定義為GPPGA總分增加≥2分同時膿皰單項評分≥2(篩選時GPPGA得分0或1),或GPPGA總分增加≥1分且存在新鮮膿皰形成(篩查時GPPGA評分2分)。
圖1研究設計
註:DB:雙盲法;OL:開放標簽;SC:皮下註射;IV:靜脈註射;q4w:每4周;q12w:每12周;*:在DB治療期間,針對GPP發作給予900mg IV治療;†:治療期間針對GPP發作給予900mg IV治療。*GPPGA分數為0或1表示幹凈或幾乎幹凈的皮膚。
研究結果
Effisayil 2結果:佩索利單抗皮下註射600mg負荷劑量後,隨後每4周註射300mg與每12周註射300mg相比,每4周註射300mg療效更好,減少了近2/3的受試者經歷GPP復發(q4w組10.0%[3/30] vs q12w組29.0%[9/31]),使受試者的GPP發作降低了84%。
表1 截至第48周GPP發作時間
註:†Cox回歸模型透過隨機分組時所使用的GPP藥物進行分層。‡按隨機化使用系統性GPP藥物進行分層的對數秩檢驗。§Cochran-Mantel-Haenszel檢驗(多重推算後),按隨機化使用系統性GPP藥物進行分層。CI:置信區間;HR:風險比;LD:負荷劑量。
Effisayil ON結果:患者接受佩索利單抗每12周皮下註射300mg和每4周皮下註射300mg強化治療,結果進一步表明每4周皮下註射300mg預防GPP發作療效更好。
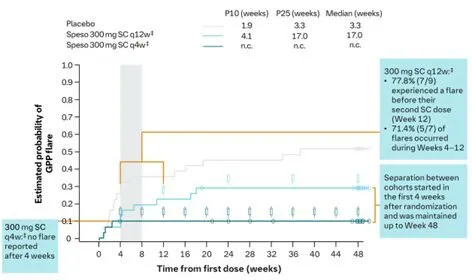
圖2Effisayil2研究,隨訪至第一次GPP發作或第48周
註:*EM,本研究對於隨機治療期間GPP發作的定義為,靜註佩索利單抗等挽救藥物或醫生起始標準治療;PM,即審查的主要方法,定義為如果沒有並行事件,則會在研究結束時(第351天)進行審查。†事件概率透過Kaplan-Meier方法估計。‡600mg SC負荷劑量後。
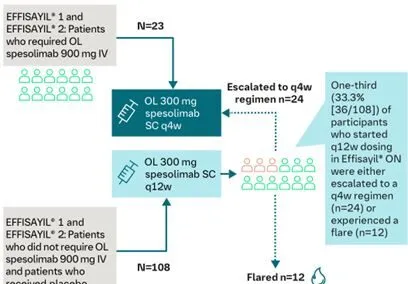
圖3Effisayil ON的研究情況
註:靜註佩索利單抗等挽救藥物或醫生起始標準治療被視為事件或治療失敗;nc,不可計算;PM,審查的主要方法。
研究結論
Effisayil 2和Effisayil ON試驗表明,佩索利單抗每4周皮下註射300mg是預防GPP發作的最佳給藥方案,仍需要進一步的研究了解其預防GPP發作的機制。
氘可來昔替尼治療中重度斑塊狀銀屑病的PASI結果:3年的POETYK長期擴充套件(LTE)試驗
氘可來昔替尼是全球首個口服選擇性變構TYK2抑制劑,已在美國、歐盟和其他國家獲批用於適合系統治療或光療的成年中重度斑塊狀銀屑病患者。目前兩項全球多中心、隨機、雙盲III期研究POETYK PSO-1和POETYK PSO-2已證實氘可來昔替尼的有效性和耐受性。本研究是對氘可來昔替尼治療的患者進行的POETYK LTE試驗,旨在評估氘可來昔替尼連續治療148周的長期療效。
研究設計
POETYK PSO-1(NCT03624127)和POETYK PSO-2(NCT03611751)是為期52周的全球3期雙盲試驗,將中重度斑塊型銀屑病患者按1:2:1隨機分配至口服安慰劑、氘可來昔替尼6mg 每日一次(QD),或阿普米司特30mg每日兩次(BID)。在第52周,入組POETYK LTE試驗的患者接受氘可來昔替尼6mg QD治療。
療效評估終點:PASI 評分相對於基線的平均變化;PASI 評分在以下範圍內較基線有所下降的患者比例:75%至<80%,80%至<85%、85%至<90%、90%至<95%、95%至≤100%,每個範圍或條帶、不重疊;達到達標治療絕對PASI閾值≤1、≤2、≤3、≤4和≤5的患者比例;達到PASI評分範圍>1至≤3和>3至≤5的患者比例。
研究結果
在完成為期52周的POETYK PSO-1和POETYK PSO-2臨床研究之後,患者可參加正在進行中的POETYK PSO-LTE試驗,以開放標簽形式繼續接受氘可來昔替尼(6 mg,每日一次)治療。結果發現,從第16周到第52周以及148周,達到PASI 75至<80、80至<85、85至<90、90至<95和95至≤100的患者比例增加或維持不變(圖1)。
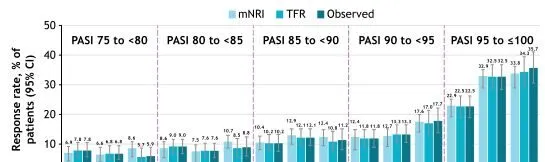
圖1持續接受氘可來昔替尼治療隨時間達到目標PASI的患者比例
註:mNRI:第16周,n=456;第52周,n=456;第148周,n=456。TFR:第16周,n=510;第52周,n=511;第148周,n=353。觀察:第16周,n=510;第52周,n=511;第148周,n=339。CI,置信區間;mNRI,修正的無應答插補;TFR,治療失敗規則。
基線PASI分數的平均值(標準差[SD])為21.1(7.9):從第一周開始就觀察到了改善(-3.2);從第16周(-15.7)到第52周(-17.6),應答率保持不變或增加;從第52周到第148周患者出現持續應答(-16.4)(圖2)。
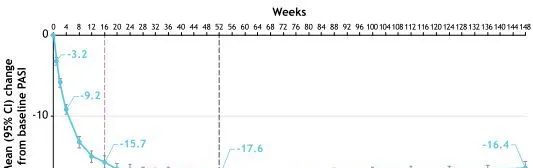
圖2持續氘可來昔替尼治療後PASI評分(mBOCF)相對於基線的平均變化(平均值[SD],21.1[7.9])(n=513)
註:CI,置信區間;LTE,長期延伸;mBOCF,修正基線觀察結轉;SD,標準差。
此外,絕對 PASI 閾值從第16周到第52周,應答率增加或總體保持不變(圖3)。應答率從第52周持續到第148周;第148周與第52周相比,PASI>3至≤5內的應答率稍低,可能是由於第148周時轉向更高的分數(PASI≤3)(圖4)。無論是使用觀察值還是使用mNRI和TFR數據估算方法,達到PASI閾值和PASI範圍的患者比例都相似。
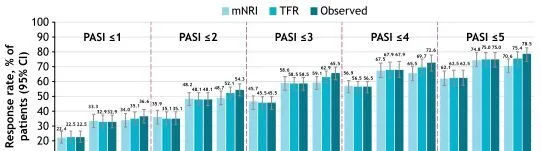
圖3 隨時間變化達到絕對PASI閾值的患者比例
註:mNRI:第16周,n=456;第52周,n=456;第148周,n=456。TFR:第16周,n=510;第52周,n=511;第148周,n=353。觀察:第16周,n=510;第52周,n=511:第148周,n=339。CI,置信區間;mNRI,修正的無應答插補;TFR,治療失敗規則。
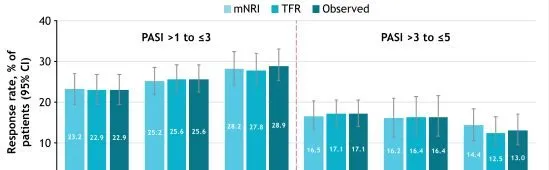
圖4隨時間變化達到PASI改善的患者比例
註:mNRI:第16周,n=456;第52周,n=456;第148周,n=456。TFR:第16周,n=510;第52周,n=511;第148周,n=353。觀察:第16周,n=510;第52周,n=511:第148周,n=339。CI,置信區間;mNRI,修正的無應答插補;TFR,治療失敗規則。
研究結論
接受氘可來昔替尼治療3年的患者,從第16周到第148周達到目標PASI評分和絕對PASI閾值的患者比例有所增加或維持不變。氘可來昔替尼每日口服一次,有望成為中重度斑塊狀銀屑病患者的首選治療方法。
參考文獻:
[1]. Kim A, et al. AAD 2024. #54112.
[2]. Diamant Thaçi, et al. AAD 2024. #51342.
[3]. April W, et al. AAD 2024. #51447.
[4]. Linda Stein Gold MD, et al. AAD 2024. #51091.











