硼中子俘獲療法(Boron Neutron Capture Therapy,BNCT)是 將硼化合物遞送至癌癥病竈 ,並用中子射線照射以透過與硼的核反應來破壞癌癥。
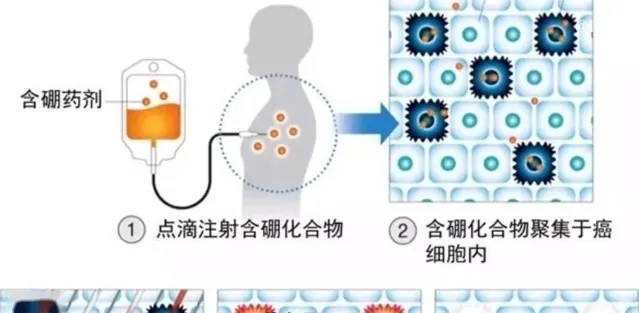
治療時先給患者註射一種含硼的藥物,這種藥物與癌細胞有很強的親和力,會迅速聚集在癌細胞內,而在其他組織內分布很少。隨後對病竈進行中子照射,時長在1小時內,整個治療過程一般只需照射一次。當照射的中子被癌細胞內的硼俘獲,透過核分裂, 釋放出殺傷力極強的射線 。
中子射線比X射線具有更高的能量並可以到達體內深處,因此該療法可用於深部區域的癌癥。這種射線的射程很短,只有一個癌細胞的長度。硼中子俘獲療法不同於傳統的放療, 對正常細胞幾乎沒有任何損傷 ,原則上只需照射一次即可。因此,BNCT又被譽為繼化療、放療、靶向療法、免疫療法後的「第五療法」。
中硼醫療自主研發的國產硼藥「註射用硼[10B]法侖」(NBB-001),其是一種透過L-胺基酸轉運系統(LAT-1)進行運輸的廣譜含硼藥物,擬用於針對復發性頭頸部惡性腫瘤,非臨床研究顯示了NBB-001聯合中子照射表現出 85%以上的抑瘤率 。
2024年1月,國家藥監局藥品審評中心(CDE)官網公示,中硼醫療旗下中硼(廈門)生物醫藥有限公司自主研發的2類新藥「註射用硼[10B]法侖」(NBB-001)臨床試驗申請獲批,成為 國內首個 、 全球第二個進入註冊臨床的BNCT硼藥 (硼中子俘獲療法,Boron neutron capture therapy)。此前,2020年3月,全球首個BNCT器材、 全球首個硼藥Steboronine在日本獲批上市 ,用於無法切除的局部晚期或局部復發性頭頸癌。
2024年5月,中硼醫療官網宣布,其BNCT藥械創新產品I期臨床試驗 完成首例患者入組治療 。患者表示「整個治療過程中一點痛感都沒有,很幸運我能第一個享受這麽先進的醫療技術」。BNCT治療後7天,經過嚴格的醫學觀察, 患者各項狀態良好 。接下來,治療團隊將按照臨床試驗方案要求進行定期隨訪跟蹤。

研究藥物: 註射用硼[10B]法侖(I期)
登記號: CTR20241076
試驗類別: 單臂試驗
適應癥: 復發性頭頸部惡性腫瘤(二線及以上)
申辦方: 中硼(廈門)生物醫藥有限公司
用藥周期
註射用硼[10B]法侖的規格:1.0g;用法用量:低劑量組:412.5mg/kg、中劑量組:550mg/kg、高劑量組:687.5mg/kg,靜脈輸註;用藥時程:單次給藥。
入選標準
1、受試者須在試驗前對本研究知情同意,並自願簽署書面的知情同意書。
2、年齡≥18歲且≤75歲,性別不限。
3、ECOG體力評分0-2分。
4、經組織學確認的頭頸部惡性腫瘤,病種範圍:鼻咽、鼻腔、鼻竇、口咽、口腔、下咽和喉等頭頸部器官,以及頭頸部血管、神經、淋巴結、骨和軟組織等。
5、經過手術治療、標準放療和全身系統治療失敗或不耐受後局部復發或區域淋巴結復發的 頭頸部惡性腫瘤(鱗癌、非鱗癌、鼻咽癌) 患者、不適合全身系統治療頭頸部惡性腫瘤患者。
6、 多個靶病竈需要在同一個照射野內覆蓋 。
7、根據RECISTv1.1標準至少有1個可評估腫瘤病竈。
8、18F-BPA-PET/CT檢查提示腫瘤與正常組織的 硼濃度比(TNR)應≥2.5 。
9、心電圖無臨床顯著異常。
10、有足夠的血液系統功能、肝功能及腎功能:
(1)血小板(PLT)≥80×10^9/L,嗜中性球絕對值計數(ANC)≥1.5×10^9/L,白細胞絕對值計數(WBC)≥2.5×10^9/L,血紅蛋白≥8g/dL(14天內未接受過EPO、G-CSF或GM-CSF等輔助手段治療,且給藥前至少7天內未接受過包括紅細胞及血小板輸註在內的輸血);
(2)腎功能:血清肌酐≤1.25×ULN;
(3)肝功能:AST和ALT≤3×ULN。
11、預期生存期≥3個月。
12、曾接受放療的患者,靶病竈的總累積劑量不超過75Gy。
13、有生育能力的合格患者(男性和女性)必須同意在試驗開始和末次用藥後至少12個月內使用可靠的避孕方法(激素或屏障法或禁欲);育齡期的女性患者在入選前7天內的妊娠試驗必須為陰性。
排除標準
1、淋巴瘤、預期采用化學療法或安全劑量的常規放射療法對癌癥有療效的任何其他腫瘤類別,以及活動性雙癌患者(同時期雙癌和異時性雙癌無病5年以內)。
2、 遠處轉移 的患者。
3、腫瘤累及伴動脈大出血風險,且無有效預防手段。
4、入組前靶病竈3個月內接受過放射治療。
5、既往 接受過粒子植入治療 的患者。
6、入組前4周內接受過主要臟器外科手術(不包括穿刺活檢)或出現過顯著外傷。
7、既往抗腫瘤治療的不良反應尚未恢復到CTCAE V5.0等級評價≤1級(脫發除外)。
8、免疫缺陷病史,包括HIV抗體檢測(化學發光法、酶聯免疫法或Western斑點法)陽性。
9、入組前4周內接受過全身癌癥治療,包括化療和靶向治療以及免疫治療。
10、 無法在治療室平躺或者保持坐姿至少60分鐘 的患者。
11、有心臟起搏器或不可移除的金屬植入物。
12、有包括但不限於以下嚴重並行癥的患者:
(1)不受控制的糖尿病;
(2)不受控制的高血壓;
(3)慢性肺病(阻塞性肺炎、間質性肺炎、肺纖維化、重度肺氣腫等);
(4)腎臟疾病(慢性腎功能衰竭、急性腎功能衰竭、腎病症候群等);
(5)心臟病(NYHA功能分級Ⅲ級或Ⅳ級);
(6)伴有活動性感染患者;
(7)具有其他高風險的患者。
13、已知有酒精或藥物依賴。
14、精神障礙者或依從性差者。
15、妊娠期或哺乳期女性或12個月內有生育計劃的患者。
16、既往對果糖嚴重不耐的患者。
17、 苯丙酮尿癥 患者。
18、白內障癥狀為3級(CTCAE V5.0)或更高級別。
19、對硼藥過敏者。
20、研究者認為受試者存在任何臨床或實驗室檢查異常或其他原因而不適合參加本臨床研究。
研究中心
福建廈門
具體啟動情況以後期咨詢為準
參考來源:











