(人民日報健康客戶端記者 譚琪欣 楊曉露)人民日報健康客戶端記者根據國家藥監局以及藥企公開數據統計,截至10月1日,已有3款中藥1.1類新藥獲批上市,超過去年同期。分別為齊進藥業/葵花藥業的兒茶上清丸、卓和藥業/亞寶藥業的九味止咳口服液以及成都華西天然藥物/永康制藥的秦威顆粒,治療領域涉及復發性口腔潰瘍、急性氣管-支氣管炎中醫辨證屬風熱證的咳嗽以及急性痛風性關節炎。
與此同時,還有10款1.1類中藥新藥上市申請已獲得受理,數量亦超去年同期,以嶺藥業、康緣藥業、健民藥業等中藥龍頭企業均有產品申報。
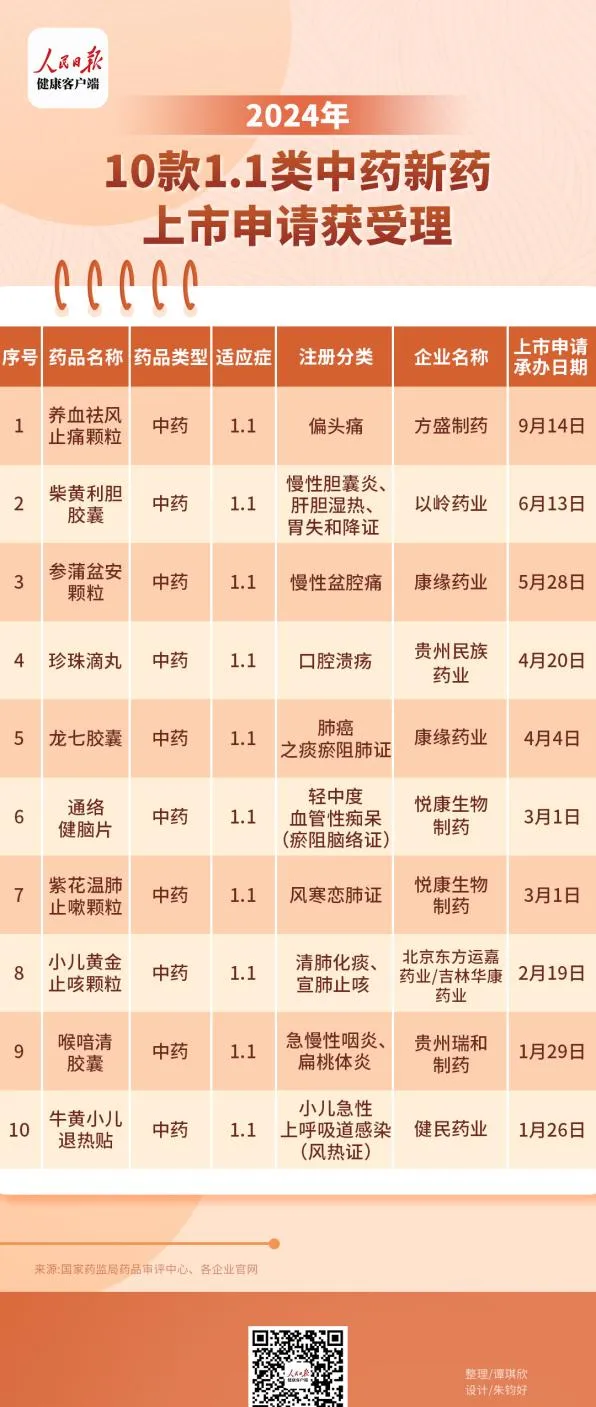
值得註意的是,部份申報上市的中藥品種也被納入了優先審評名單,分別是東方運嘉藥業申報的小兒黃金止咳顆粒、康緣藥業申報的抗腫瘤中藥龍七膠囊,均符合「國家藥品監督管理局規定其他優先審評審批的情形」被納入優先審評審批程式。其中,龍七膠囊功能主治為祛痰化瘀,清肺消積;用於治療肺癌之痰瘀阻肺證所致的咳嗽、咯痰、痰血、氣喘(氣急)、胸悶、胸痛等。
多位業內人士均在受訪過程中提到,國家層面的重視和政策利好是中成藥新藥研發加速最大的催化因素之一。北京中醫藥大學中藥制藥系副主任尹興斌教授此前接受人民日報健康客戶端記者采訪時曾提到,2017年之後,促進中藥研發的相關政策出台,中藥企業開始重視新藥研發,經過五六年的時間,如今可以說是進入到中藥新藥成果轉化的收獲期。
具體到準入環節,湖南時代陽光藥業股份有限公司執行董事唐純玉提到,【中藥註冊管理法】、【中藥註冊管理專門規定】等政策的相繼出台,為中國中藥新藥審批進一步加速提供了政策指引,如規定中明確提到,中藥創新藥處方來源於古代經典名方或中醫臨床經驗方的,可不開展非臨床有效性研究。
「中藥行業是對政策高度敏感的行業,頂層制度設計的完善,為中藥企業的創新動能提供了強而有力的支撐,很多中藥企業都想抓住當前這一發展的時機,成為帶動中醫藥產業高質素發展的生力軍。」 唐純玉說。











