看過【眾病之王】的親們,你們看後有什麽想法呢?有沒有這樣一種感覺——癌癥之所以不可破是因為TA比人類前進演化得更完美?
作為一名生物學博士,我的研究領域是長壽,但是我也在做癌癥。我們發現長壽和癌癥有不少重疊,所以可以認為,長壽和癌癥,在某一方面上有共同的地方(未發表數據)。今天就來和大家聊聊癌癥和長壽有哪些重疊?
01,人為什麽會衰老?
我們知道,隨著年齡的增加,人的細胞會變得衰老。原因包括:
1,基因突變的積累
2,細胞損傷的積累
3,代謝廢物的積累
4,端粒縮短
其實簡單的理解,就像一輛汽車老化一樣,各個部件都會出現問題,線粒體出問題,高基氏體出問題,內質網出問題,反正一大堆。
那麽,我們能否清除這種衰老的細胞呢?
02,衰老細胞能否被清除?
能否清除衰老細胞?理論上是可以的。還記得2002年和2016年諾獎麽?一個頒發給了 程式性死亡 (programmed cell death,PCD) ,一個頒發給了 自噬 (autophagy) 。
大隅良典為什麽能獨得 2016 年諾貝爾生理學或醫學獎?他在細胞生物學研究上做出了哪些突出貢獻?
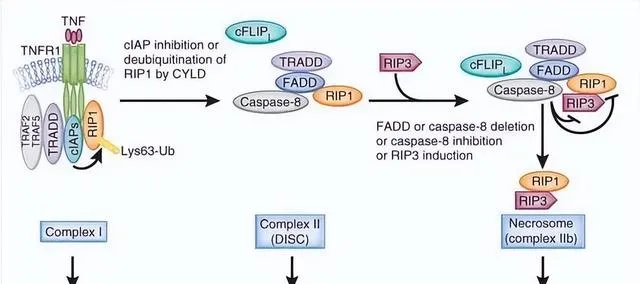
程式性死亡
這就是人體的主要清除機制,在這兩種手段之下,人體會對那些受損的或者衰老的細胞進行清理,從而維持細胞的狀態。
事實上,我們的確可以看到這種情況,比如我們每天的皮膚會有大量的細胞死亡,形成一層層的死皮。
然而,現實是殘酷的。這種細胞清理過程,其實更科學的說法是 「更新」 。什麽是更新,那就是用新的去替換舊的。
然而,問題來了?新的細胞從哪裏來?也許有人說,我們有幹細胞啊,人體記憶體在大量的幹細胞,他們可以彌補我們細胞的缺失,所以我們不至於掉頭發掉的最後光頭(脫發是病,得治)。
幹細胞
然而,很殘酷的是,我們的幹細胞也會衰老! 是的,當隨著年齡增加,幹細胞變得沒那麽幹練了,甚至,他們變得失去了幹性或者消失了……
關於幹細胞衰老的理論我們到目前為止尚沒有合理的解釋,然而,這種現象是客觀存在的。
否則如果老年人擁有像嬰兒般一樣的幹細胞的話,只要不得病,那長命百歲是小case,突破永生都不是問題,哪裏壞了修復哪裏即可。
03,癌癥和長壽共享
癌癥和長壽在很多內容上共享一些共同的內容 。 雖然我們知道幹細胞隨著年齡衰老,然而,我們發現有一種特殊的群體,我們稱之為「健康長壽」。這個群體特殊之處在於,他們和正常的衰老不一樣,是真的不一樣。
這個群體一般是100歲以上,雖然我們曾經認為,人的衰老是漸進的,然而放到群體研究裏,卻發現一個奇特的現象,100歲的老人是一個 特殊的群體 ,他們總體會呈現一種新的趨勢。而這個百歲群體,他們會表現出一種現象,他們很多指標非常的年輕,比如他們的血液各種生化指標大概和70/80歲的人比較類似,而且體內不少的物質很活躍。
我舉個例子,之前有篇發表在nature biotechnology 上的文章,他們用不同年齡來源的血細胞誘匯出來幹細胞,結果發現,百歲老人明顯特殊。
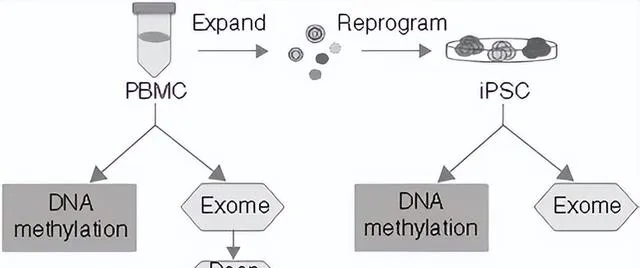
實驗設計思路,就是誘導細胞後做外顯子組和甲基化組檢測來比較幹細胞
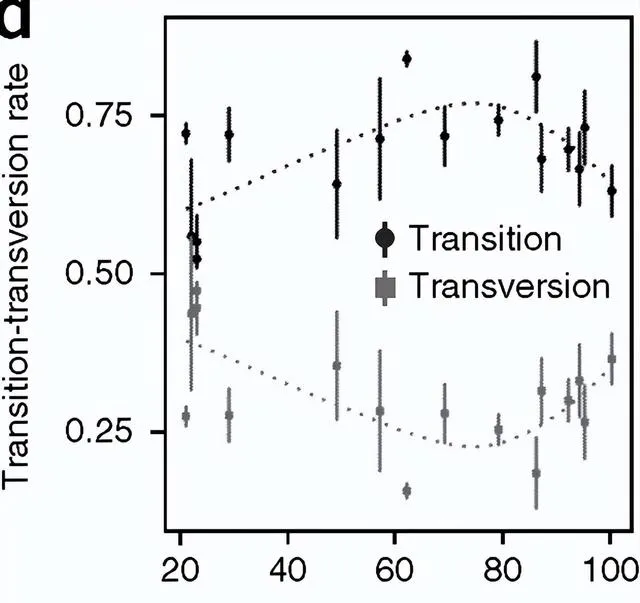
90歲以上transition小於transversion,呈現一個明顯的激烈變化。
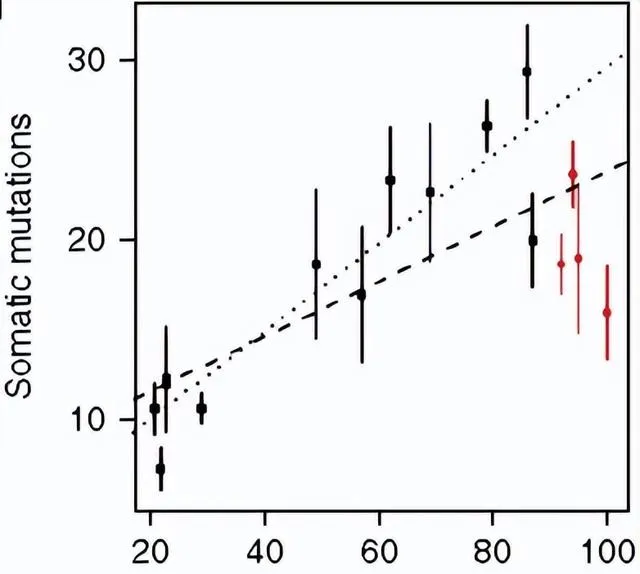
這是突變的分布,請註意紅線那些群體,他們是90歲以上的群體,呈現了一個下降的趨勢。
04,關於癌癥
事實上,癌癥的發育過程,是一個總體細胞重新編程的過程。而這個過程,我們發現,很多年輕或者幼年時候才應該出現的東西,在癌癥中重新出現或者增加了。
比如大家體檢的時候,經常會有個腫瘤標記物甲胎蛋白( AFP ),甲胎蛋白是一種糖蛋白,它是一個分化的指標。因為胎兒的肝尚未完全發育,所以會大量的分化,因此,體內會高度存在。隨著肝臟發育完全,這個蛋白合成就很少了。
甲胎蛋白檢測流程
然而對於肝癌患者,這個指標又出現了,因為肝癌組織開始重新啟動了合成分化過程,於是大量的合成甲胎蛋白。
據不完全統計:在成人,AFP可以在大約80%的肝癌患者血清中升高。事實上,不僅這個指標,癌癥中很多指標都會增高,而這些指標大部份和細胞的分裂分化有關,意味著癌組織在快速增長,而這些指標,事實上,另一種意義上,是「 年輕指標」。
再比如著名的端粒酶,相信很多人對這個耳熟能詳, 2009年度諾貝爾生理學或醫學獎授予Elizabeth Blackburn, Carol Greider和Jack Szostak,他們的重要貢獻就是對端粒酶的研究。
端粒也被科學家稱作「生命時鐘」。我們知道細胞隨著分裂,端粒會逐步縮短,當縮短到一定程度的時候,細胞就會啟動程式性死亡。當端粒不能再縮短時,細胞就無法繼續分裂而死亡。
端粒酶,則可以修復端粒,讓細胞不死。
然而,正常人,這個端粒酶是沒有活性的。但是在癌癥中,這個酶被啟用了,大約90%的癌細胞都有著不斷增長的端粒及相對來說數量較多的端粒酶。所以癌細胞可以無限復制而不走向雕亡。
所以想修復端粒的人,先考慮下致癌吧。 不過,這個酶,在幹細胞中,也是有活性的,在胎兒裏也是很多,否則幹細胞分裂幾次,就得死了。

事實上,長壽和癌癥,共享了很多類似的內容,這就比較神奇了。
我們認為,理論上,那些能夠獲得長壽的人,他們本身各種指標較為年輕,而這種年輕的背後,是那些和年輕有關的各種蛋白在發揮作用,進一步,是那些基因在發揮作用。
比如,某些清除能力很強的基因,某些抵抗演化壓力很強的基因,某些維持幹細胞很強的基因。甚至,對端粒本身的維護。當然,這些內容,還在研究中,但是,對這一點,我還是比較有信心的。
05,為什麽同時做長壽和癌癥
長壽是我的主體方向,所以寫了不少相關的內容。然而研究長壽的手段卻很有限,因為長壽樣本有限!
我經常看到有人說,咦,你們的樣本怎麽性比不平衡,我就一笑而過,你以為長壽滿地都有?本來就是女比男多很多。還有人覺得長壽的樣本數量太少,其實這些人犯了一些基本的錯誤,他們看了太多的人口數據,總以為人群中長壽很多,其實,這個比例是非常少的。
由於樣本有限,使得我們不得不尋求其他的途徑去研究長壽。那就是,尋找如何實作長壽。其實辦法很簡單: 長壽的秘訣就是不得大病 。看起來好像廢話,然而這句話是一個研究長壽健康的核心理念。
如果你規避了疾病,你就會長壽;如果你獲了疾病,你就可能會受到影響。當然,進一步,你需要詢問一下,到底是什麽原因導致了有些人規避了疾病,運氣?還是實力?這就是需要驗證的了。
這句話基本上在各種研究中都得到了驗證。大部份長壽的人,事實上,從來不會得那種極其嚴重的疾病,比如癌癥,嚴重心血管疾病等;或者,他們會延緩這種病的發生。比如正常人大概在60歲以後某些老年性疾病就會急劇上升,比如心血管疾病,老年癡呆癥或者二型糖尿病等,然而,那些極端長壽的人們,他們總體的發病率會延遲到70,80甚至90才開始。這個在生物學裏有個專門的名詞,叫做compression of morbidity,上個世紀有大量的群體數據支持這個結論。
所以,做長壽的,大部份人都會研究各種老年性疾病,從長壽老人為什麽不得或者少得這種老年性疾病的角度去研究長壽。算是曲線救國吧。其實我還做心血管疾病,老年癡呆癥。











