
來 源:孫 強,塗柯蓉,姜先梅,齊 瑤,楊尚沁,呂亮亮,丁歡歡,劉紅梅,蔡璐璐.藤黃酸抗腫瘤作用機制及聯合用藥研究進展 [J]. 中草藥, 2024, 55(7): 2423-2432.

惡性腫瘤是全球範圍內嚴重威脅人類健康的惡性疾病。盡管當前能夠對癌癥實作早診早篩並借助早期幹預減緩癌癥發展和延長生存期,但仍有約50%患者在確診時已處於晚期[1-2]。此外,雖然現代治療技術極大推動了臨床上以手術、放療和化療為主的癌癥治療策略的持續更新叠代,然而術後並行癥、放療和化療伴隨的藥物不良反應及多藥耐藥常常受到患者詬病[3-4]。因此,探尋高效低毒的新型治療藥物迫在眉睫。作為中國極具傳統特色的醫療形式,中醫藥在癌癥防治過程中可有效提高治療率,顯著改善患者生活質素並降低化療藥物不良反應[5-6]。近年來,得益於國家政策的大力扶持,中醫藥現代化和國際化行程持續加快,多個傳統中藥成分憑借卓越的抗癌作用已躋身臨床抗腫瘤輔助藥物行列,為腫瘤綜合治療提供了優勢凸顯的中國方案[7-8]。
藤黃為藤黃科藥用植物藤黃 Garcinia hanburyi Hook. f.分泌的幹燥樹脂,又名海藤、月黃等,原產於印度、馬來西亞和柬埔寨等國,隨後作為顏料傳入中國並被引種栽培,具有破血散結、祛腐斂瘡、解毒及殺蟲等多種功效,被廣泛用於癰疽腫毒、潰瘍、濕瘡、頑癬、跌打腫痛、瘡傷出血及燙傷等多種疾病的治療[9-11]。此外,中國傳統醫籍【海藥本草】記載其「主蚛牙蛀齒,點之便落」。現代藥理學研究表明,藤黃中主要的籠狀呫噸酮成分藤黃酸具有顯著的抗癌作用,其抗癌譜主要包括肺癌、乳癌、口腔癌、鼻咽癌、胃癌、肝癌和結直腸癌等,且可與多種化療藥物或天然產物聯合用於癌癥的協同治療[12-14]。然而,藤黃酸的抗腫瘤作用和機制缺乏系統且全面的整合與梳理。
因此,本文主要從抑制細胞增殖、阻礙遷移和侵襲、誘導雕亡和自噬、阻滯細胞周期、抑制血管生成、誘導鐵死亡和焦亡、靶向腫瘤炎癥微環境及免疫調控等多個方面系統闡述了藤黃酸的抗腫瘤作用及機制,並從聯合用藥的視角總結了藤黃酸協同其他活性成分抗癌的作用與機制,為藤黃酸的臨床研究提供科學依據和理論基礎。
1 藤黃酸的抗腫瘤作用及分子機制
1.1 抑制腫瘤細胞增殖
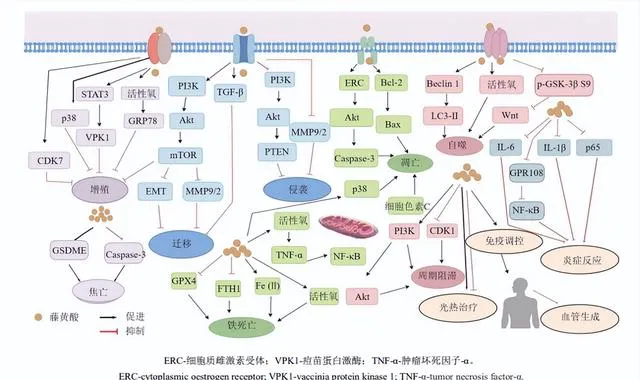
藤黃酸可透過多條訊號途徑抑制腫瘤細胞增殖。在人神經膠質瘤U251細胞中,藤黃酸可抑制p38、核糖體蛋白前體和上遊結合因子的磷酸化,進而透過下調磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳動物雷帕黴素靶蛋白(mammalian target of rapamycin,mTOR)訊號通路而阻礙膠質瘤細胞核糖體的形成[15]。
在人肺癌A549細胞中,藤黃酸可呈劑量相關性抑制細胞增殖,具體機制涉及上調活性氧水平、增加葡萄糖調節蛋白78(glucose-regulated protein 78,GRP78)、C/EBP同源蛋白和啟用轉錄因子6的表達,及促進蛋白激酶R-樣ER激酶和肌醇酶-1α的磷酸化[16]。CircRNA_ ASAP2/miR-33a-5p/CDK7軸在胃癌進展中扮演重要角色。研究證實,藤黃酸可透過與miR-33a-5p結合促進CDK7的表達進而抑制胃癌細胞的增殖[17]。此外,藤黃酸可降低人結直腸癌SW480細胞活力並抑制增殖,該效應可能與miR-199a-3p上調密切相關,但仍需在體內研究中進一步證實[18]。
1.2 抑制腫瘤細胞遷移和侵襲
腫瘤細胞常常透過血液、淋巴管或其他鄰近結構的直接滲透播散於遠端組織或器官並定植生長,而該特性往往造成絕大多數患者死於腫瘤轉移。miR-1275與其分泌的富含半胱胺酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine,SPARC)在胃癌轉移過程中具有重要作用,且SPARC與miR-1275的表達呈負相關。研究表明,藤黃酸能夠透過上調miR-1275的水平抑制SPARC的表達,進而抑制胃癌進展[19]。上皮間質轉化(epithelial mesenchymal transition,EMT)與腫瘤轉移密切相關。研究發現,藤黃酸能夠阻礙轉化生長因子-β(transforming growth factor-β,TGF-β)誘導的EMT過程進而抑制肺癌轉移[20]。
在人惡性黑色素瘤A375細胞中,藤黃酸可透過抑制PI3K/Akt和細胞外訊號調節激酶(extracellular signal-regulated kinase,ERK)通路降低EMT和基質金屬蛋白酶2(matrix metalloproteinase 2,MMP2)及MMP9的活性,可能是對抗轉移性黑色素瘤的候選藥物[21]。Gao等[22]研究發現藤黃酸可抑制人結直腸癌HT29細胞的PI3K/Akt通路,並誘導磷酸酶和緊張素同源物(phosphatase and tensin homolog,PTEN)的啟用,而miR-21能夠逆轉藤黃酸對PI3K/Akt通路的抑制並阻礙PTEN的啟用,證明miR-21可能是藤黃酸阻斷PI3K/Akt通路並增強PTEN活性的效應子。
1.3 誘導腫瘤細胞雕亡
藤黃酸主要透過影響p38依賴性雕亡途徑、內質網應激途徑、線粒體膜通透性、活性氧積聚等誘導細胞雕亡。在口腔鱗狀細胞癌中,藤黃酸能夠上調雕亡蛋白如血紅素加氧酶-1(heme oxygenase-1,HO-1)和半胱胺酸天門冬胺酸蛋白酶(cystein-asparateprotease,Caspase)的表達。同時,藤黃酸對HO-1表達和Caspase切割的誘導效應因p38激酶的失活而受到抑制,因此,推測藤黃酸誘導雕亡可能與啟用p38依賴途徑密切相關[23]。
在淋巴瘤中,藤黃酸以時間和劑量相關性抑制細胞生長並誘導雕亡,其機制涉及抑制Akt通路及促進Caspase-3的釋放[24]。此外,藤黃酸可顯著誘導SW480細胞雕亡,但對正常結腸細胞無明顯影響。隨後觀察到B淋巴細胞瘤-2(B-cell lymphoma-2,Bcl-2)/Bcl-2相關X蛋白(Bcl-2 associated X protein,Bax)的值降低和Caspase-3蛋白表達減少,表明藤黃酸可能透過破壞線粒體膜通透性啟動細胞雕亡程式[25]。
借助原子力顯微鏡,Liu等[26]觀察到藤黃酸能夠促進食道癌細胞活性氧的產生進而誘導細胞雕亡,同時降低線粒體膜電位,具體表現為增加膜高度分布和膜粗糙程度,而該效應可透過去除過量活性氧而逆轉。此外,藤黃酸可與半胱氨酰硫醇反應形成Michael加合物,導致蛋白質錯誤折疊並在內質網和線粒體內大量積聚,最終引發內質網和線粒體雙途徑細胞雕亡[27]。
1.4 誘導腫瘤細胞自噬
自噬廣泛參與多種癌細胞的訊號調節並在不同類別癌癥中發揮雙重作用[28-29]。研究表明,藤黃酸可透過上調Beclin 1(自噬體形成的起始因子)的表達及促進自噬標記物微管相關蛋白1的輕鏈3-I(microtubule associated protein 1 light chain 3-I,LC3-I)向LC3-II的轉化誘導肺癌細胞自噬。同時活性氧清除劑 N -乙酰半胱胺酸能夠逆轉藤黃酸誘導的自噬,表明藤黃酸可透過活性氧依賴途徑誘導細胞自噬,該結果在異種移植瘤模型上也得到了證實[30]。
此外,Wang等[31]發現藤黃酸能夠啟用白血病細胞自噬,其機制涉及下調Wnt/β-catenin訊號傳導和上調糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)活性及促進β-catenin的降解。在人胰臟癌PANC-1細胞中,藤黃酸可誘導細胞LC3-II和Beclin 1蛋白的表達和抑制p62蛋白的表達,增加酸性囊泡胞器、自噬體形成和自噬流量[32]。突變型p53蛋白具有較強的致癌特性且與細胞自噬密切相關。研究表明,藤黃酸可上調自噬相關蛋白p53-R280K和p53-S241F的表達水平,進而誘導突變型p53蛋白降解,最終促進細胞死亡[33]。
1.5 阻滯腫瘤細胞周期
細胞分裂過程中G0/G1期、S期和G2/M期被認為是腫瘤細胞周期的3個重要調控點[34]。在人宮頸癌SiHa細胞和小鼠異種移植瘤模型上,藤黃酸能夠阻滯細胞於G0/G1期並減少S期細胞數,進一步的機制研究表明上述效應受到p53和p21的共同調節[35]。基於膠質母細胞瘤模型,Xia等[36]證實藤黃酸透過PI3K/Akt途徑阻滯細胞於G0/G1期。此外,藤黃酸在膽管癌細胞中可降低β-catenin轉錄水平,抑制Wnt/β-catenin通路下遊靶基因 c-Myc 的表達,同時促進G1周期阻滯並啟用參與內質網應激的相關基因,進而實作對膽管癌的抑制[37]。此外,Huang等[38]發現藤黃酸處理的A549耐藥細胞表現出G2/M期阻滯和總雕亡細胞百分比的增加,細胞周期關鍵因子如CDK1和cyclin B的蛋白表達顯著降低,表明藤黃酸可能是一種潛在的周期阻滯劑。
1.6 阻礙腫瘤血管生成
腫瘤血管持續地供給腫瘤細胞代謝需要的各種營養物質進而使其不斷生長,而其高通透性的結構缺陷則成為了腫瘤轉移的重要條件[39]。因此,抗腫瘤血管生成已成為腫瘤治療研究的焦點。近年來,藤黃酸的抗血管生成作用也逐漸引起研究者廣泛關註[40]。血管生成素樣蛋白4(angiopoietin-like protein 4,ANGPTL4),作為ANGPTLs家族的重要成員之一,與腫瘤血管生成密切相關。研究發現,藤黃酸可透過抑制人結腸癌LOVO細胞中ANGPTL4蛋白的表達,阻礙腫瘤血管生成,進而發揮有效的抗結直腸癌作用[41]。
此外,控制血管生成因子表達的關鍵選擇性轉錄因子yes相關蛋白(yes-associated protein,YAP)在抗血管生成治療中受到廣泛關註。研究表明,藤黃酸可在體外顯著抑制血管內皮生長因子誘導的內皮細胞增殖、遷移、出芽和微管形成,進而透過阻止腫瘤血管生成和血管成熟來限制腫瘤生長。進一步研究表明,上述過程與藤黃酸靶向YAP/訊息傳遞因子和轉錄啟用因子3訊號軸密切相關[42-43]。
1.7 誘導腫瘤細胞鐵死亡和焦亡
鐵死亡在常規療法難治愈的癌癥治療中有望帶來全新突破。因此,針對靶向鐵死亡的藥物開發可能為惡性腫瘤的治療提供極富前景的策略[44]。脂質過氧化物在腫瘤部位的積累受到脂質氧化水平的限制,而該過程直接決定了細胞鐵死亡的敏感性。研究表明,藤黃酸能夠透過消耗谷胱甘肽削弱細胞的抗氧化能力,隨後降低谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)的表達,進而破壞細胞內氧化還原穩態並最終促進腫瘤細胞鐵死亡[45]。
此外,藤黃酸可透過破壞細胞氧化還原穩態,誘導細胞鐵死亡並改變耐藥腫瘤細胞的異質性和可塑性[46]。在腎癌細胞中,藤黃酸能夠升高線粒體活性氧和Fe2+水平,且該效應可被鐵死亡抑制劑Ferrostatin-1逆轉。同時,鐵死亡標誌性蛋白鐵蛋白重鏈1(ferritin heavy chain 1,FTp)和GPX4的表達在藤黃酸處理的腎癌細胞中呈現出降低趨勢,且Ferrostatin-1部份恢復了FTp和GPX4的水平,表明藤黃酸可能透過抑制FTp和GPX4表達誘導腎癌細胞鐵死亡[47]。
細胞焦亡是由炎性小體引發的一種新型細胞死亡方式,其發生伴有大量促炎因子的釋放,因而可作為機體重要的天然免疫反套用於癌癥治療。借助光學顯微鏡和透射電鏡,Xu等[48]觀察到藤黃酸處理的結直腸癌細胞中出現以多個孔狀大氣泡為主的細胞焦亡典型特征。隨後的機制研究表明,藤黃酸能夠裂解細胞焦亡標誌性因子和促進Caspase-3的啟用。同時,藤黃酸顯著增加了腫瘤微環境中CD3+T細胞、細胞毒性T淋巴細胞(cytotoxic T lymphocytes,CTLs)和樹狀細胞的比例。此外,小鼠脾臟中CTLs和效應記憶T細胞的比例顯著增加,表明藤黃酸的焦亡誘導效應觸發了強烈的抗腫瘤免疫反應。
1.8 抑制腫瘤相關炎癥反應
多種外環境刺激可在特定機體器官中誘導炎癥反應,後者能夠啟動上皮細胞損傷與間質細胞浸潤程式。隨後,持續的慢性炎癥致使組織損傷與修復作用不斷更叠,在伴以多基因改變的環境中促進癌變。因此,對於腫瘤相關炎癥的控制可作為抑制癌前病變的重要手段[49-50]。研究表明,藤黃酸可下調卵巢癌細胞中炎癥相關標誌因子如白細胞介素-6(interleukin-6,IL-6)和IL-1β的表達,進而抑制卵巢癌局部炎癥因子浸潤[51]。在一項關於藤黃酸治療膀胱癌相關炎癥的研究中,藤黃酸能夠靶向類胰島素樣生長因子1/胰島素受體受質1訊號通路減輕膀胱炎癥反應[52]。近年來的研究發現,降低先天免疫系統中GPR108的表達可抑制核因子-κB炎性通路的啟用,而藤黃酸被證實能夠與GPR108結合並促進其降解,進而在癌前炎癥控制中發揮重要作用[53]。
1.9 調節抗腫瘤免疫反應
免疫治療利用機體自身免疫活性物質和免疫細胞對腫瘤進行殺傷和清除,已成為當前癌癥治療最具潛力的策略[54-55]。免疫檢查點CD47與鼻咽癌的遠端轉移和復發密切相關。研究發現,藤黃酸能夠部份逆轉化療刺激所致的CD47升高,可能在控制鼻咽癌遠端轉移方面大有裨益[56]。借助生物資訊學和實驗分析,研究者證實藤黃酸處理的SW620細胞呈現出53個與免疫相關的差異基因,且其調控效應主要側重對抗原提呈和腸道免疫通路的調控[57]。
此外,藤黃酸可作為有效的免疫佐劑直接殺傷腫瘤細胞,還能透過調節腫瘤免疫微環境間接殺傷腫瘤,為結直腸癌的免疫治療提供豐富的候選藥物[58]。在肝細胞癌中,Shao等[59]發現以藤黃酸為主要治療藥物構建的核殼納米粒能夠有效上調CTLs水平,促進輔助性T細胞(T helper type,Th)分化並誘導Tp的免疫反應。課題組前期制備了一種負載藤黃酸的可註射溫敏水凝膠並透過一系列機制研究表明其能夠下調程式性死亡受體1的表達,增加CTLs水平並減少免疫抑制細胞,從而增強口腔鱗狀細胞癌荷瘤小鼠的抗腫瘤免疫能力[60]。
1.10 基於熱休克反應的光熱療法
免疫療法雖然在整體上改善了癌癥患者的生活質素,但將其用於治療部份具有免疫抗性的癌癥時卻收效甚微。光熱療法(photothermal therapy,PTT)憑借其誘導免疫原性細胞死亡、重編程腫瘤免疫微環境及促進內源性免疫細胞募集等多種優勢為克服免疫治療缺陷提供了一種極富前景的策略[61]。然而,PTT的療效也常常受到熱休克蛋白(heat shock proteins,HSPs)介導的細胞耐熱性的限制。研究發現,藤黃酸能夠雙重抑制HSP70和HSP90的代償性增加,進而分別與PTT和光動力療法用於腫瘤的協同治療[62]。
腫瘤細胞中活性氧水平不足和HSPs介導的耐熱性是影響PTT療效的2個關鍵障礙。研究證實,藤黃酸能夠耗盡細胞內谷胱甘肽並阻斷HSP90的表達,同時增加活性氧水平,並抑制耐熱性從而提高PTT療效[63]。在藤黃酸協同黑磷量子點用於腫瘤治療時,其能夠與HSP90特異性結合並促進細胞雕亡[64]。此外,在人肝癌HepG2細胞上,藤黃酸同樣表現出對於HSP90的抑制[65]。進一步研究發現藤黃酸抑制HSP90的作用主要涉及破壞HSP90與熱休克因子1(heat shock factor 1,HSF1)及HSP90和HSF2間的相互作用[66]。
藤黃酸抗腫瘤作用的主要機制見圖1。
2 藤黃酸抗腫瘤聯合用藥策略
近年來研究發現,抗腫瘤聯合用藥顯示出比單一用藥更優的治療效果和更小的安全風險。當前,已有不少研究開始探索藤黃酸與其他藥物聯合用於腫瘤治療的方案,以提高對化療藥物的敏感性或減少不良反應(圖2)。概括來說,目前基於藤黃酸的聯合用藥策略主要包括與化療藥物和天然產物的聯合。
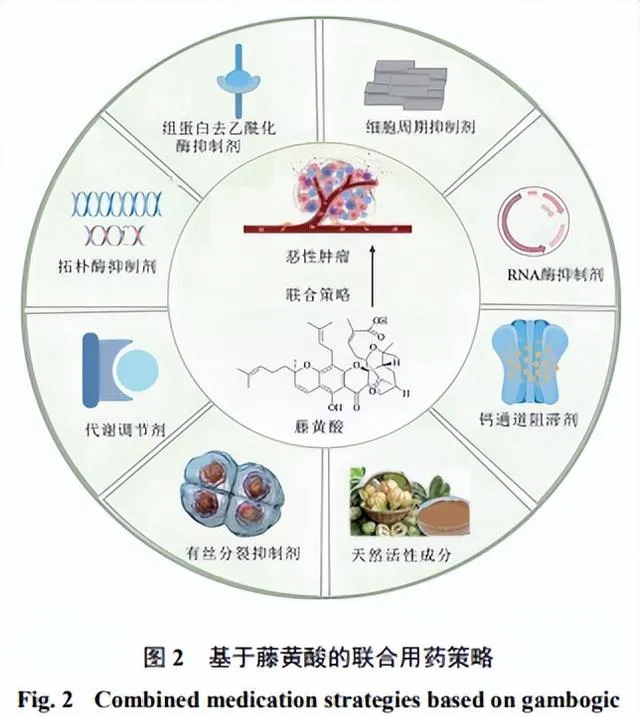
2.1 藤黃酸與化療藥物的聯合策略
當前,藤黃酸主要與多西他賽、維甲酸-氯查耳酮、吉西他濱、伏立司他、伊立替康、奧沙利鉑、順鉑和維拉帕米等化療藥物聯合使用,以最大限度發揮抗腫瘤作用。在治療肺癌骨轉移的研究中,藤黃酸能夠增強多西他賽對肺癌細胞的治療作用並在骨轉移原位小鼠模型中有效抑制腫瘤轉移,進而顯著延長小鼠生存期[67]。在藤黃酸與維甲酸-氯查耳酮的聯合中,二者能夠協同抑制骨肉瘤細胞增殖並誘導雕亡,但具體分子機制有待進一步深入挖掘[68]。
吉西他濱的耐藥性是制約胰臟癌臨床療效的主要障礙。研究顯示,藤黃酸能夠透過增強Caspase-3/9、Bax的表達及降低Bcl-2表達誘導細胞雕亡。此外,藤黃酸被證實能夠透過抑制ERK訊號降低核糖核苷酸還原酶亞基-M2的表達進而逆轉吉西他濱耐藥性[69]。CD71過表達是賦予神經母細胞瘤異質性的重要推手。研究發現,藤黃酸和伏立司可協同降低CD71的表達水平進而抑制神經母細胞瘤生長[70]。此外,藤黃酸與奧沙利鉑聯合用藥可透過上調ATP酶銅轉運蛋白α(ATPase copper transporting α,ATP7A)和ATP7B水平逆轉結直腸癌細胞對奧沙利鉑的耐藥性[71]。
2.2 藤黃酸與天然產物的聯合策略
近年來,藤黃酸與多種天然活性成分如雷公藤紅素、胡椒堿、姜黃素、人參皂苷Rb1等已被用於腫瘤聯合治療的策略。雌激素受體α(estrogen receptor α,ERα)-Y537S突變體與腫瘤耐藥密切相關。研究發現,藤黃酸和雷公藤紅素可作為ERα-Y537S突變體的新型拮抗劑,且二者在聯用時表現出優異的協同抗乳癌細胞增殖和促雕亡作用[72]。在藤黃酸和胡椒堿聯合用於膽管癌時,二者可透過外源性和內源性或線粒體介導的途徑協同誘導細胞雕亡,具體表現為Caspase-3/9活性的升高和線粒體膜電位的降低[73]。此外,藤黃酸與姜黃素的聯用顯示出對HepG2細胞良好的協同抗增殖作用[74]。在一項關於藤黃酸與人參皂苷Rb1形成自組裝納米粒的研究中,Luo等[75]發現HSPs抑制劑藤黃酸能夠借助人參皂苷Rb1的兩親性和膜滲透性順利進入細胞並與其協同發揮抗腫瘤作用。
3 結語與展望
惡性腫瘤嚴重危害人類健康,如何高效治療腫瘤一直是科學研究的熱點問題。盡管目前可透過手術、放療、化療等多種策略對腫瘤予以治療,但其復發率及藥物引起的不良反應仍受到患者廣泛詬病。因此,亟待尋找新型高效低毒的抗腫瘤藥物[76]。天然產物具有高效低毒的優良特性,在惡性腫瘤治療中的價值持續受到關註。作為一種具有多重功效的天然成分,藤黃酸在多種惡性腫瘤中均表現出極具潛力的抗癌特性。因此,本文從抑制細胞增殖、阻礙腫瘤細胞遷移和侵襲、誘導雕亡和自噬、阻滯細胞周期、抑制血管生成、誘導鐵死亡和焦亡、抑制腫瘤炎癥微環境、免疫調控等多個方面全面總結了藤黃酸的抗腫瘤作用機制,並從聯合用藥的角度綜述了藤黃酸協同其他藥物活性成分抗腫瘤的作用和機制,為藤黃酸在臨床腫瘤治療中的套用研究提供參考。
不同新穎骨架結構的天然產物是新藥設計與開發的重要源泉。隨著多種交叉學科技術的深度融合,擁有新骨架結構的天然產物持續推陳出新,為新藥研發提供了豐富的化學結構資訊,同時也構成了極其龐大的天然先導化合物庫。化學結構鑒定表明,藤黃酸由多個環系結構駢合而成,其中B、C、D環共同構成了其呫噸酮化學結構,D環上嵌合著藤黃屬特征橋環骨架,B環則駢合了吡喃環A環。進一步的研究發現,藤黃酸分子結構中B、C環平面區的α、β-不飽和酮橋環骨架作為藤黃屬天然產物的共有結構,被認為是其發揮抗腫瘤活性的關鍵骨架基團[77]。
此外,近年來基於藤黃酸藥效骨架為樣版開展的相關研究為獲取結構新穎、藥理活性增強及成藥性改善的先導化合物或候選藥物提供了重要策略。目前,藤黃酸的結構修飾研究主要集中於C-30羧基和C-34/39烯丙基位置。其中,將脂肪族胺和親水性鏈烷醇胺引入C-30位的羧基則能夠顯著改善藤黃酸的溶解效能,而在C-34/39的烯丙基位置引入親水性脂肪族胺則有利於提高藤黃酸的抗腫瘤活性。總體來說,以藤黃酸為結構母體進行多維修飾的化合物將極大促進臨床抗腫瘤藥物的開發。
藤黃酸作為一種天然活性成分,能夠透過多途徑靶向腫瘤發生和發展的各個環節。與化學合成藥物相比,其來源廣泛,因而在惡性腫瘤的防治方面呈現出巨大潛力。然而,藤黃酸作用靶點的廣泛性和多條訊號通路的復雜網絡交錯造成其在機制研究方面難以明確核心機制。此外,藤黃酸眾多靶點的交叉和堆疊及體內代謝成分是否也直接或間接地介導了其不良反應的產生,仍然值得深入挖掘。因此,未來應緊巡國際新藥研發趨勢,建立關鍵技術平台充分挖掘藤黃酸體內代謝過程、作用靶點及機制、潛在毒性和產生機制等關鍵問題,促進其防治惡性腫瘤的新藥創制研發。
此外,盡管藤黃酸在癌癥防治方面優勢明顯,但其自身也存在水溶性差、生物利用度低、刺激性強等一系列難以成藥的缺陷。近年來,基於納米技術的遞送平台如脂質體、納米粒、水凝膠、共聚物、金屬有機框架等持續為改善藤黃酸的上述性質賦能,但這些遞送體系仍然面臨著負載效率不佳、免疫排斥、快速清除、脫靶效應等多種缺陷,其原因可能部份歸因於在動物模型水平上進行的藥效學評估和機制研究通常不能真正反映人體內在的病理和生理過程。此外,絕大多數研究僅局限於細胞和動物層面,而未能真正實作藤黃酸產品的臨床轉化。
另一方面,藤黃酸納米制劑和結構修飾產物的安全性也亟需更為深入的藥效評價和機制研究。患者來源的腫瘤異種移植(patient-derived tumor xenograft,PDX)模型是將來源於患者的腫瘤組織、原代細胞植入免疫缺陷鼠體內而形成的移植瘤模型,其在病理學、分子生物學及基因水平上保留了絕大多數原代腫瘤的特性如腫瘤的異質性和關鍵基因的突變等,可更加真實地反映人體內在的病理和生理過程。由於PDX模型具備良好的臨床療效預測性,其在新藥研發的諸多關鍵環節如藥物靶點篩選、藥效學驗證及臨床試驗等方面得到了廣泛的套用。因此,未來可借助PDX模型、類器官技術及組織胚胎培養等技術從真實世界數據的角度客觀評價並驗證藤黃酸的療效和安全性。
藥物聯合套用一直是抗腫瘤領域的核心用藥法則。在傳統中醫藥理論體系中,配伍是臨床遣藥組方的思想精髓,而在現代醫學理論中,不同機制的藥物聯用是化療藥物抗腫瘤的慣用方式,二者在治療方案中具有異曲同工之妙。目前,雖然藤黃酸被報道能夠與多種化療藥物或天然產物聯合用於惡性腫瘤的治療,但聯合用藥的藥效和機制研究及協同作用評判標準的制定仍有待進一步加強。此外,聯合用藥的用藥劑量和理論指導原則等也迫切需要進行大樣本的試驗驗證,為藤黃酸最大程度地發揮抗癌特性提供更為精確的臨床前數據支撐。











