前言
「慢加急性肝衰竭(ACLF)主題月評」是中國慢(加急)性肝衰竭聯盟受【國際肝病】編輯部邀請,制作的ACLF相關學術月評專欄。本專欄每月以ACLF某一特定領域為主題展開,旨在普及ACLF的概念及意義、幫助讀者快速了解有關領域的進展。希望本專欄對無論是需要了解相關領域熱點的肝病專家及研究人員,或是需要實用知識、活躍於臨床一線的醫務工作者,均能有所裨益。
本期月評簡要描述HBV-ACLF患者的臨床病程,並建立一個馬爾科夫多狀態模型來估計隨時間推移的疾病嚴重程度的演變。此外,還對本月(2023.10.21~2023.11.20)PUBMED上更新的ACLF相關重要文獻進行簡評。
關於作者:
中國慢(加急)性肝衰竭聯盟 (Chinese Acute-on-chronic liver failure Consortium,Ch-CLIF-C) 是由上海交通大學附屬仁濟醫院消化內科李海教授牽頭,由全國15家三甲醫院感染科、肝病中心共同參與成立的肝病科研合作團隊,致力於探索慢加急性肝衰竭(ACLF)的發病機制、制定基於高循證等級的乙肝高流行區ACLF診斷標準。目前團隊開展了全球已報道入組數最多的ACLF前瞻性多中心佇列研究「CATCH LIFE」( C hinese A cu T e-on- CH ronic LI ver F ailur E ) , 包含2個大型佇列(入組2600例的探索佇列與入組1370例的驗證佇列)。
本期責任編輯

施毓
浙大一院感染科副主任醫師、副教授,中國研究型醫院學會肝病專委會委員,浙江省臨床免疫學會青委副主任委員、浙江省醫學會肝病分會青委副主任委員。從事終末期肝病研究,主持國家自然科學基金2項、國家重點研發計劃/國家科技重大專項課題/子任務3項,在 BMJ、Hepatology、Journal of Hepatology 等知名醫學期刊上發表學術論文超過100篇。
本期責任副編輯

俞霞
浙江大學傳染病學在讀博士生,師從浙江大學醫學院附屬第一醫院盛吉芳教授和施毓教授,目前主要研究方向為慢加急性肝衰竭的機制和預後研究。以第一作者和共同一作身份已發表SCI論文10篇。
主題述評
慢加急性肝衰竭(ACLF)是由慢性肝病急性加重引起的危重癥,常伴有多器官功能衰竭,短期高死亡率。2015年,CANONIC研究對ACLF的不同臨床過程進行了分層(消退、改善、惡化、穩定或波動),發現一半的ACLF患者病程緩解或改善,有五分之一的患者在住院期間病情惡化。然而,HBV-ACLF與酒精或HCV病因的ACLF具有不同的臨床表型。HBV-ACLF的一個顯著特征是肝功能衰竭的發生率特別高,通常由乙型肝炎急性發作、HEV重疊感染或藥物性肝損傷引起。此外,HBV-ACLF常在既往代償性肝硬化患者中發生,與失代償性肝硬化患者相比,這些患者可能有更高的恢復潛能。
在這項研究中,我們從兩個大規模前瞻性觀察佇列中篩選了445例HBV-ACLF患者,描述了這些患者的臨床過程,特別是器官功能衰竭的演變、新失代償事件的發生和全身炎癥的變化,並分析ACLF惡化和病亡的危險因素。最後,開發並驗證了一個隨時間演變的馬可夫模型,該模型可對疾病進展進行動態更新預測,以預測HBV-ACLF患者的疾病進展。研究論文( The Clinical Courses of HBV-related Acute-on-chronic Liver Failure and A Multi-state Model to Predict Disease Evolution )近期被美國肝病學會(AASLD)旗下 Hepatology Communications 雜誌接收。
浙江大學醫學院附屬第一醫院博士研究生俞霞,劉鑫昕,西南醫院譚文婷教授,北京地壇醫院王憲波教授,武漢協和醫院鄭昕教授和湘雅醫院黃燕教授為本文共同第一作者。浙江大學醫學院附屬第一醫院施毓教授,上海仁濟醫院李海教授和浙江大學醫學院附屬第一醫院盛吉芳教授為本文共同通訊作者。
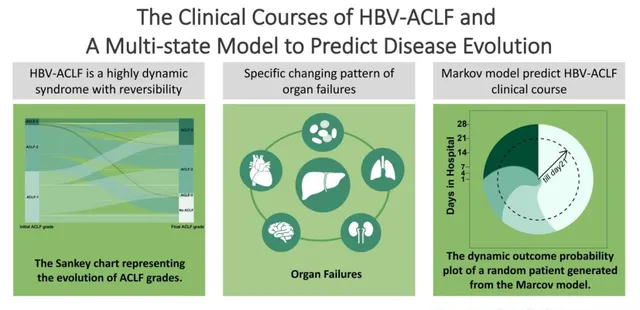
圖1. 圖形摘要
01 HBV-ACLF的不同臨床病程
在所有納入的445例患者中,病情進展76例(17.08%),病情穩定195例(43.82),其余174例消退或改善(39.10%)。有13.64%的ACLF-3患者得到改善,其中3%的患者ACLF消退。初始和最終ACLF評分之間存在相關性。隨著初始ACLF等級的升高,在最終評估時改善或消退的概率也更小。

圖2. 桑基圖:ACLF分級演變
圖3. ACLF患者的臨床病程表
02 HBV-ACLF初始和最終分級與短期預後的關系
ACLF分級改善或消退的患者28天無移植死亡率(14.56%)和90天無移植死亡率(31.17%)較低,其次是病情穩定的患者(28天:41.04%;90天:65.24%),病情惡化患者死亡率最高(28天:66.67%;90天:88.00%)。進一步研究了肝衰竭的緩解對ACLF緩解患者預後的影響,發現在ACLF消退的患者中,肝衰竭的緩解與較低的90天、180天和365天無移植死亡率相關,與ACLF初始分級無關。
03 臨床早期動態評估ACLF分級可預測患者短期預後
71.41%的患者在第4~7天已經決定了最終評估時的ACLF分級。診斷後4~7天的ACLF分級(d4~7 ACLF)比診斷時的ACLF分級更準確地預測28天和90天的預後[AUROC(95%CI):0.76(0.71~0.81)vs. 0.65(0.58~0.71),0.77(0.72~0.81)vs. 0.62(0.55~0.69); P <0.001]。
04 早期臨床過程中的新發失代償事件
1
器官衰竭(OFs)
ACLF診斷時,肝衰竭(386例,86.74%)是最常見的器官衰竭類別,其次是凝血衰竭(311例,69.89%)和腎功能衰竭(77例,17.30%)。凝血功能衰竭(72.73%)是ACLF 1級進展為2級期間主要的新發OFs,其次是腎功能衰竭(36.36%)。肝外OFs的發生率,包括腎臟(59.26%)、迴圈系統(14.81%)、呼吸系統(31.48%)和腦功能衰竭(50.00%)在進展為ACLF-3時顯著增加。
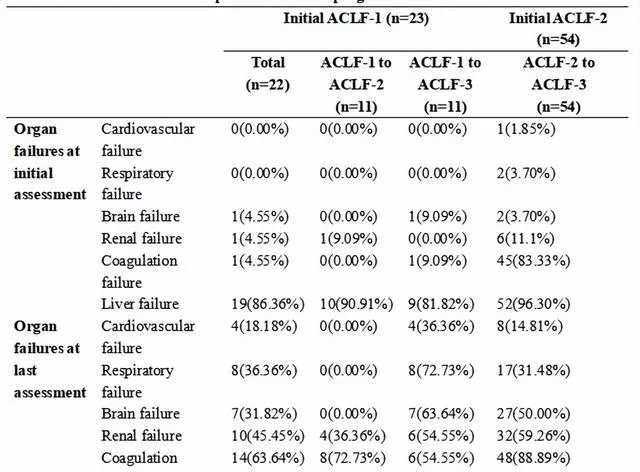
表1. 病情惡化的HBV-ACLF患者器官衰竭演變
2
新發失代償事件
新發失代償事件的發生率,包括腹水[10例(13.16%)vs. 22例(5.96%), P =0.027]和肝性腦病[13例(17.11%)vs. 21例(5.69%), P =0.001]在進展患者中顯著高於無進展患者。
3
全身炎癥的演變
在入組時和入組後4~7天,ACLF進展患者WBC計數和NLR均顯著高於無進展患者。並且全身炎癥標誌物的變化與臨床病程密切相關。無ACLF進展的患者NLR和WBC計數顯著降低,但ACLF進展的患者WBC計數顯著增加。
4
HBV-ACLF進展相關因素
多因素分析顯示,在納入基線變量時,感染、高ALT和TB與ACLF進展獨立相關。加入新發失代償事件變量後,除了基線的感染,高ALT和TB外,新發肝性腦病和新發感染均為進展的危險因素。基線HBV DNA分層顯示,入組時較高的病毒載量與HBV-ACLF進展無關( P <0.05)。此外,未發現 HBV病毒載量與短期死亡率之間的關系。
5
HBV-ACLF短期死亡相關因素
當納入基線變量時,年齡、HE、Na、ALT、TB、INR(僅在90天內)被確定為28天或90天無LT死亡率的獨立預測因素。當加入新的失代償事件變量時,入組時的年齡、感染(僅在90天內)、HE、PLT(僅在90天內)、Na、ALT、TB和INR(僅在90天內)仍然是具有統計學意義的預後因素。新發肝性腦病和新發感染(僅在90天內)被發現是短期死亡的其他重要危險因素。
05 建立和驗證預測HBV-ACLF臨床病程的多狀態馬可夫模型
透過8個獨立協變量(年齡、性別、ALT、NLR、INR、肝衰竭、肝內誘因和肝外誘因),建立了一個多狀態馬可夫模型,來用於預測ACLF病程演變和死亡的概率。為了方便臨床使用,、開發了一個網站應用程式來視覺化個體的風險。 網址:http://101.42.177.184:3838/Markov/
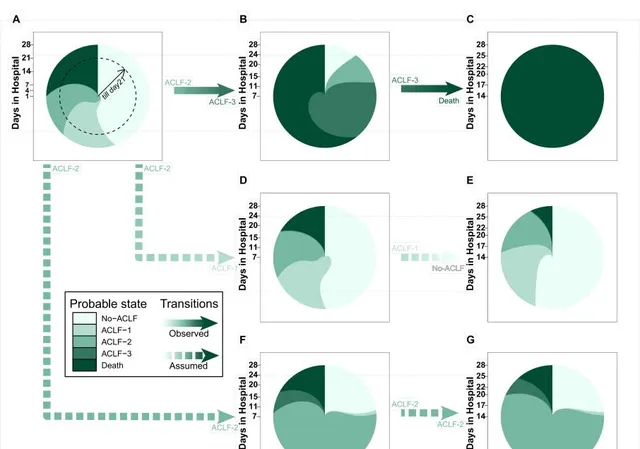
圖4. 馬爾科夫模型預測病程演變
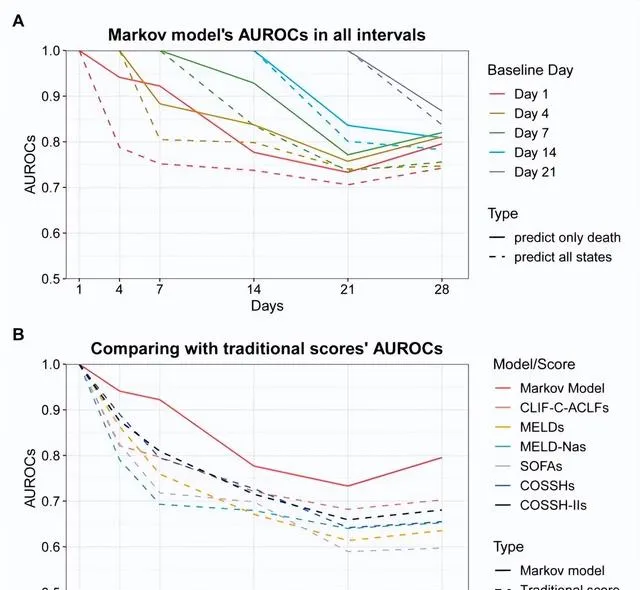
圖5. 馬爾科夫模型預測臨床病程的AUROC值,以及與傳統預測模型的比較
總結
該研究顯示,HBV-ACLF是一個高度動態且可逆性的危重癥。多狀態馬爾科夫模型是一種評估隨時間演變疾病嚴重程度變化的工具。研究結果為理解HBV-ACLF的自然史演變奠定基礎,並為預測和管理HBV-ACLF進展提供有用的工具。
近1月ACLF的研究統計及簡評
2023.10.21~2023.11.20,PubMed上更新ACLF相關綜述、述評及論著共22篇,涉及病因與誘因(1篇)、發病機制(2篇)、治療(11篇),以及預測與預後(8篇)等方面。
01
Kajal K, Premkumar M, Izzy M, et al. Cirrhotic cardiomyopathy influences clinical outcomes and enhances performance of conventional risk prediction models in acute-on-chronic liver failure with severe sepsis. Aliment Pharmacol Ther. 2023;58(9):903-919. doi:10.1111/apt.17695(IF=7.6)
簡述: 床旁即時心臟超聲波(Point-of-care echocardiography,POC-Echo)是一種重要的重癥監護血流動力學監測工具。評估POC-Echo參數[即心臟指數(CI)、全身血管阻力指數(SVRI)和肝硬化心肌病(CCM)標誌物]和血清生物標誌物對慢加急性肝衰竭(ACLF)合並膿毒癥相關性低血壓患者迴圈衰竭(需要血管加壓藥)和死亡率的預測價值。
該項研究作者對入住肝臟重癥監護病房的ACLF合並膿毒癥性低血壓患者在發病6小時內以及隨後的24、48和72小時進行了連續POC-Echo。前瞻性收集患者的臨床資料、POC-Echo數據和血清生物標誌物。該項研究共納入120例患者,其中68例(56.6%)合並迴圈衰竭,總病死率為60%。52.5%的患者存在肝硬化心肌病(CCM)。迴圈衰竭的預測因素為心臟指數(aHR=1.5; P =0.021)、N末端腦鈉肽(aHR=1.1; P =0.007)和CCM標誌物:e′速度(aHR=0.5; P =0.039)和 E/e'比值(aHR=1.2; P =0.045)。
72小時心臟指數降低20%和SVRI降低15%預測死亡率的敏感性分別為84%和72%,特異性分別為76%和65%( P <0.001)。作者根據多因素logistic回歸計算了新的評分:MELD-CCM模型評分和CLIF-CCM模型評分。在預測90天死亡率方面,兩種評分模型分別優於MELDNa (z-score=-2.073, P =0.038)和CLIF-C ACLF評分(z score=-2.683, P =0.007)。
簡評: 在這項研究中,作者展示了床旁即時心臟超聲波和血清生物標誌物在預測ACLF和膿毒癥患者預後方面的新套用,具有創新性。然而,將本研究結果外推套用於其他佇列時,需要考慮ACLF在分級、促發因素和病因方面的異質性。該項研究是一個單中心研究,並且該研究是在COVID-19大流行期間進行的,排除了COVID-19陽性個體,這限制了樣本量。
此外,該項研究存在選擇偏倚,因為發生迴圈衰竭,病情較重的患者優先進入ICU樓層並參加了本研究,並且,並非所有到急診室就診的患者都能及時接受POCUS篩查。有些患者可能在送到醫院後12小時內死於急診室。最後,該研究沒有評估既往NSBB使用、血管加壓藥物類別或右心衰作為ACLF預後的獨立預測因子的作用,這應該在未來的研究中進行。
02
Kulkarni AV, Avadhanam M, Karandikar P, et al. Antibiotics with or without Rifaximin for acute hepatic Encephalopathy in critically ill patients with cirrhosis: A double-blind, randomized controlled (ARiE) trial. Am J Gastroenterol. 2023 Nov 9. doi: 10.14309/ajg.0000000000002575(IF=9.8)
簡述: 重癥監護病房(ICU)收治的危重肝硬化(CIC)患者通常由於疑似感染或作為醫院規程使用廣譜抗生素。對於有急性顯性肝性腦病(OHE)的ICU患者,加用利福昔明與廣譜抗生素是否有協同作用尚不清楚。本項研究為雙盲試驗,將入住ICU的OHE患者隨機分為單用抗生素(ab)組和抗生素聯合利福昔明(ab+r)組。比較兩組患者血尿消退(或降低2級)、血尿消退時間、院內病死率、院內感染及內毒素水平變化。對失代償期肝硬化(DC)和慢加急性肝衰竭(ACLF)患者進行亞組分析。
研究顯示:兩組患者的基線特征和嚴重程度評分相似(每組92分)。碳青黴烯類和頭孢菌素+ β -內醯胺酶抑制劑是最常用的抗菌藥物。Kaplan-Meier分析顯示,僅使用抗生素組和抗生素+利福昔明組分別有44.6%(41/92;95%CI:32~70.5)和46.7%(43/92;95%CI:33.8~63)的患者達到了主要治療目標( P =0.84)。主要目標達成時間分別為(3.65±1.82)d和(4.11±2.01)d( P =0.27),兩組的院內死亡率相似(62% vs. 50%; P =0.13)。ab組和ab+r組分別有7%和13%的患者發生了院內感染( P =0.21)。利福昔明不影響內毒素水平。利福昔明可降低失代償肝硬化患者的院內病死率[HR:0.39(95%CI:0.2~0.76)],但對ACLF患者無影響[HR:0.99(95%CI:0.6~1.63)],可能是由於利福昔明可減少院內感染。
簡評: 本研究的關鍵結果表明,在廣譜抗生素治療的基礎上加用利福昔明不能使HE早期消退,也不能降低感染發生率或內毒素水平。血清白蛋白和SOFA評分是入住ICU的重癥肝硬化患者HE消退的重要預測因素。這些結果促使我們對利福昔明在ICU中的臨床益處進行重新評估,敦促進一步探索替代方法,以推進危重患者顯性HE的管理。
然而,該項研究存在一些局限性。首先該研究缺乏安慰劑對照組,可能會影響本研究結論。其次,HE的評估集中在一個固定的時間,可能導致了對HE緩解的低估。第三,並非所有患者均接受了LOLA(門冬胺酸鳥胺酸)治療(有研究報道LOLA可有效逆轉HE),在未發生腎損傷的患者中,只有<50%的患者接受了選擇性給藥。最後,研究佇列包括嚴重程度評分高的患者,而利福昔明對入住非icu的病情較輕患者的益處可能不同。
03
Vairappan B, Wright G, Sundhar M, et al. Candesartan cilexetil ameliorates NOSTRIN-NO dependent portal hypertension in cirrhosis and ACLF. Eur J Pharmacol. 2023;958:176010. doi:10.1016/j.ejphar.2023.176010(IF=5.0)
簡述: 在失代償性肝硬化中,門脈高壓(PHT)的嚴重程度與肝內皮一氧化氮合酶(eNOS)轉運誘導劑(Nostrin)的增加有關,但其機制尚不清楚。本研究的目的是:①在肝硬化- PHT模型中,模擬ACLF合並炎癥是否會調節肝一氧化氮合酶轉運誘導因子(Nostrin)的表達、一氧化氮(NO)的合成和/或內皮功能障礙(ED);②「血管緊張素II 1型受體阻滯劑」坎地沙坦西列地酯(CC)是否影響這一途徑。
與對照組動物相比,CCL4處理動物的肝臟Nostrin表達顯著升高( P <0.0001),而peNOS表達(eNOS活性指標)顯著降低( P <0.05)。LPS刺激進一步增加了肝硬化動物的Nostrin和peNOS的表達(兩者均 P <0.05)。並且在LPS刺激後,所有肝硬化動物的門靜脈壓力和隨後的肝血管阻力也增加。在CCl4±LPS處理的動物中,坎地沙坦西列地酯(CC)處理顯著降低了Nostrin( P <0.05),升高了肝臟cGMP( P <0.01)。CCL4處理動物NOSIP、caveolin-1、NFκB、iNOS蛋白表達顯著升高( P <0.05)。CC處理未顯著降低CCl4 + LPS處理動物NOSIP和caveolin-1的表達,而iNOS和NFκB的表達顯著降低( P <0.05)。此外,敲低Nostrin可顯著改善人臍靜脈內皮細胞(HUVECs)中peNOS的表達和相關NO的合成,並減輕炎癥。
簡評: 本研究為炎性ACLF狀態的機制提供了新的見解,支持炎癥在肝硬化向ACLF進展中的關鍵作用,並確定了Nostrin-eNOS-NO介導的PHT在這一過程中的潛在調節作用。此外,在肝硬化模型中,坎地沙坦西列地酯可透過血管保護和抗炎作用降低門脈壓力和肝臟炎癥,以改善PHT和ACLF。當然,這些影響的確切機制還需要在未來進一步研究。
各研究中心PI













