本文为转化医学网原创,转载请注明出处
作者:Sophia
导读:
Von Hippel-Lindau (VHL) 蛋白在透明细胞肾细胞癌 (ccRCC) 中经常发生突变,是参与氧化应激的缺氧诱导因子 (HIF) 的主要调节因子。然而,VHL是否具有HIF非依赖性肿瘤抑制活性仍不清楚。
近日,浙江大学许大千、吕志民及哈尔滨医科大学雷博共同通讯在EMBO Journal 在线发表题为「VHL suppresses autophagy and tumor growth through PHD1-dependent Beclin1 hydroxylation」的研究论文,
研究证明 VHL 通过直接结合 PHD1 在 P54 羟基化的 Beclin1 并抑制 ATG14 与 Beclin1/VPS34 的结合来抑制 ccRCC 细胞中营养应激诱导的自噬。Beclin1 P54A 敲入表达消除了 VHL 介导的自噬抑制并促进肿瘤生长。
研究背景
01
Von Hippel-Lindau(VHL)肿瘤抑制基因的体细胞突变在散发性肾细胞癌(RCC)中普遍存在,其中明确细胞肾细胞癌(ccRCC)是最常见的亚型。VHL蛋白(VHL)作为一个伏林支架蛋白(CUL2)-环泛素连接酶复合物的底物识别模块,结合到缺氧诱导因子(HIF)1/2α上。这种结合依赖于HIF1/2α中两个保守脯氨酸残基的水化,由脯氨酸羟化酶酶(PHD1,又称EGLN2)、PHD2(EGLN1)和PHD3(EGLN3)催化,这些酶需要氧气作为辅基质。因此,PHD介导的HIF1/2α水化导致VHL介导的HIF1/2α泛素化和在正常氧化条件下降解,但在低氧条件下,PHD的活性被低氧水平抑制,导致增强的HIF1/2α表达诱导下游基因表达。VHL患者肾脏中出现的VHL缺陷病变显示出HIF和HIF靶基因的增加,小鼠VHL–/– ccRCC异种移植实验显示HIF2α促进肿瘤的作用,而HIF1α限制肿瘤的作用。然而,
一些VHL–/–ccRCC细胞系不受HIF2α活性操纵的影响,一些VHL突变的ccRCC对HIF2α抑制剂治疗具有抵抗性,这表明VHL缺陷通过尚未确定的和与HIF2α无关的机制促进肿瘤发展。
研究进展
02
为了进一步确定VHL介导的自噬抑制的临床相关性,我们对具有WT-VHL表达的人ccRCC标本进行了IHC或免疫印迹分析,并显示Beclin1 P54-OH水平与自噬水平呈负相关,如LC3B增加和p62表达降低所反映(图6A-C)。此外,肿瘤中Beclin1 P54-OH含量低的ccRCC患者(49例)的生存时间短于肿瘤中Beclin1 P54-OH含量高的患者(41例)(图6D)。
这些结果支持了VHL介导的自噬抑制在人ccRCC临床行为中的作用,并揭示了Beclin1 P54-OH水平与ccRCC临床侵袭性之间的关系。
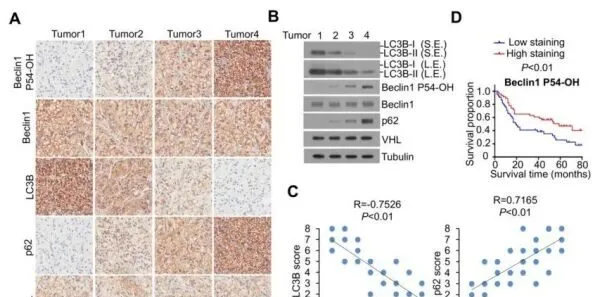
Beclin1 P54-OH 水平与人 ccRCC 中的自噬水平呈负相关,可预测患者的不良预后
研究结果
03
本研究,我们证明 VHL 抑制营养应激诱导的自噬,其在散发性 ccRCC 标本中的缺乏与自噬水平显著升高有关,并与较差的患者预后相关。从机制上讲,
VHL 在 Pro54 上发生 PHD1 介导的羟基化后,直接与自噬调节因子 Beclin1 结合。这种结合抑制了 Beclin1-VPS34 复合物与 ATG14L 的结合,从而抑制了响应营养缺乏的自噬启动。
非羟基化Beclin1 P54A的表达消除了VHL介导的自噬抑制作用,并显著降低了VHL的肿瘤抑制作用。此外,在表达野生型VHL的人ccRCC标本中,Beclin1 P54-OH水平与自噬水平呈负相关,并且与患者预后不良呈负相关。此外,VHL缺陷小鼠肿瘤与自噬抑制剂和HIF2α抑制剂联合治疗可抑制肿瘤生长。这些发现揭示了VHL抑制肿瘤生长的意想不到的机制,并提出了通过联合抑制自噬和HIF2α来治疗ccRCC的潜在方法。
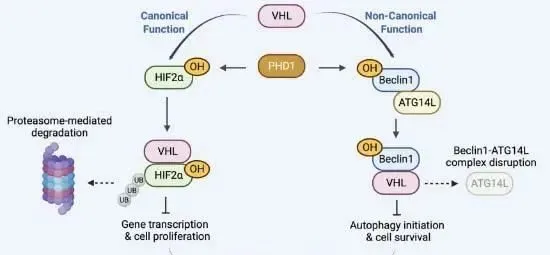
PHD1介导的脯氨酰羟基化靶向HIF-1α进行VHL依赖性泛素化,是细胞氧传感机制的关键步骤。这项工作表明,PHD1 和 VHL 还抑制 Beclin1 和自噬起始,失调导致透明细胞肾细胞癌进展。
参考资料:
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。











