2023年7月23日,东阳光药递交了原研丙型肝炎新药磷酸安泰他韦的上市申请,该申请于2023年8月2日获得国家药品监督管理局药品审评中心(CDE)承办;2023年7月28日,东阳光药递交了原研丙型肝炎新药英强布韦的上市申请,该申请于2023年8月15日获得CDE承办。

图1. CDE官网受理公示
磷酸安泰他韦是NS5A抑制剂,英强布韦是NS5B抑制剂,两药联合,治疗 成人初治或以干扰素为基础经治失败的无肝硬化或代偿期肝硬化基因1型、2型、3型和6型慢性丙型肝炎 。
Ⅱ期临床数据表明,磷酸安泰他韦100 mg或200 mg联合英强布韦600 mg, 总体SVR12率为96.7% ,与目前已上市的抗病毒方案可洛派韦联合索磷布韦在基因1型、2型、3型和6型无肝硬化或合并代偿期肝硬化受试者中98.2%的 总体SVR12率相当 ;在基因2型、6型和代偿期肝硬化亚组受试者中SVR12率均为100.0%,较可洛派韦联合索磷布韦临床研究结果(基因2型受试者SVR12率为96.3%,基因6型受试者SVR12率为85.7%,代偿期肝硬化受试者SVR12率为91.7%) 更高 [1]。
根据Ⅲ期临床数据,综合双盲期试验药物组和安慰剂延迟治疗集分析,磷酸安泰他韦100 mg联合英强布韦600 mg在慢性丙型肝炎受试者中的总体SVR12率为94.5%,其中在基因1型、2型和3a型受试者SVR12率分别为98.9%、98.8%和90.9%,与维帕他韦/索磷布韦和可洛派韦联合索磷布韦相关研究结果 相当 (以我国人群为研究对象,维帕他韦/索磷布韦治疗合并或不合并代偿期肝硬化患者12周,总体SVR12率为96.2%,其中在基因1型、2型和3a型受试者中SVR12率分别为100.0%、100.0%和90.9%;可洛派韦联合索磷布韦的一项Ⅲ期临床试验纳入基因1型、2型、3型或6型、合并或不合并代偿期肝硬化HCV感染者治疗12周,总体SVR12率为96.8%,其中在基因1型、2型和3a型受试者中SVR12率分别为98.9%、95.8%和91.3%);在代偿期肝硬化受试者中总体SVR12率为91.3%,较维帕他韦/索磷布韦临床结果86.5%更高,与可洛派韦联合索磷布韦临床结果94.9% 相当 [2,3]。
磷酸安泰他韦联合英强布韦方案整体疗效 不受基线病毒载量、肝硬化状态(无肝硬化或代偿期肝硬化)、基线相关氨基酸突变等的影响 ,不良反应少,耐受性良好,疗程短(3个月),每天仅需口服一次。
随着磷酸安泰他韦(东卫卓®)联合英强布韦(东英贺®)方案的推出,东阳光药将有能治疗我国大部分丙型肝炎类型患者的全系列丙型肝炎新药,丙型肝炎管线药物基本上齐。
此前,针对我国主要流行的丙型肝炎病毒(HCV)基因1型,东阳光药已于2020年12月上市了一款NS5A抑制剂 磷酸依米他韦(东卫恩®) 。该药与索磷布韦片联合用于治疗成人基因1型非肝硬化慢性丙型肝炎, 整体SVR12率高达99.8% ,疗效不受年龄、性别、基线HCV RNA水平和基线体质指数影响,对于轻度、中度、重度肾功能不全以及非血液透析的终末期肾病患者及轻度、中度肝功能不全患者(Child-Pugh分级分别为A级和B级)无需调整剂量,不良反应少,耐受性良好,使用简便,每天只需要口服一次,无需加利巴韦林或干扰素[4,5]。
磷酸依米他韦上市后以显著的疗效获得了众多丙型肝炎专家的认可。2022年12月, 我国【丙型肝炎防治指南(2022年版)】 发布并提到:HCV基因1b型患者可选择依米他韦+索磷布韦,100 mg+400 mg,1次/d,初治及PRS经治,无肝硬化或代偿期肝硬化疗程12周(A1)[6]。这不仅表明磷酸依米他韦在丙型肝炎临床治疗中发挥着重要作用,也为磷酸依米他韦应用于临床代偿期肝硬化患者提供了依据。

图2. 【丙型肝炎防治指南(2022年版)】推荐意见
为了惠及更多丙型肝炎患者,点亮他们重获健康的希望,2021年11月, 磷酸依米他韦进入国家医保目录 ,一方面降低价格,另一方面医保可报销。对于没有医保的患者,一个疗程的药费低至5208元;对于有医保的患者,医保报销后个人支付部分最低仅需几百元,切实把益民、惠民和暖民传递到了广大群众的心坎上。
磷酸依米他韦的成功研发与上市不仅标志着中国的制药创新企业具备了新药研发能力,也给中国丙型肝炎患者带来了更多治愈的希望!上市后累计已治疗近一万名患者。
2023年6月30日,东阳光药仿制药索磷布韦获批上市,进一步丰富了公司的产品线。索磷布韦是全球首个NS5B聚合酶抑制剂,常与其他直接抗病毒药物联用治疗丙型肝炎。东阳光药索磷布韦的获批,将有助于进一步减轻国内丙型肝炎患者治疗负担,为中国尽早实现消除丙型肝炎做出贡献!
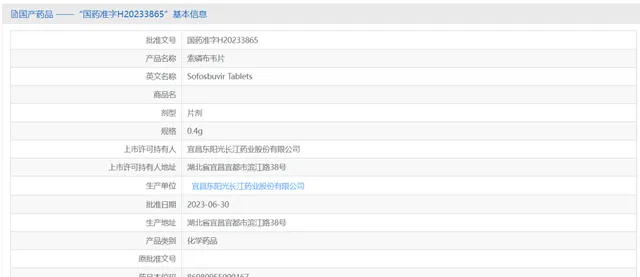
图3. 国家药品监督管理局公示的药品基本信息
未来,东阳光药将充分利用自身在生产规模、渠道覆盖、学术推广等方面深耕多年的积累, 致力于向更多丙型肝炎患者输送适合国人的诊疗方案 ,治愈更多丙型肝炎患者,助力国家2030年消除丙型肝炎危害!
关于东阳光药
东阳光药多年来践行以「解决人类尚未满足的健康需求」为使命,致力于为全球患者提供创新及可负担的药物及服务,我们的愿景是通过「创新」和「国际化」推动东阳光药成为一家全球领先、世界一流的综合性制药企业。目前,公司已上市产品111个,包括1个创新药磷酸依米他韦,5个胰岛素系列产品,中美欧方向105个仿制药。另有115个自主产品正在开发,2个创新药申请上市,1个即将申请上市。
东阳光药是本土及全球最大的流感主要用药奥司他韦的生产供应企业,其知名品牌——「可威®」是奥司他韦的代表性品牌。自2006年国内上市以来,可威®抗击流感17载,成为中国家庭信赖的常备用药。东阳光药全球首创的奥司他韦颗粒剂「可威®颗粒」更适合儿童使用,至今已惠及过亿人次儿童;可威®胶囊品质卓越,是成人流感用药的领军品牌。每一次流感来袭,东阳光药都站在奥司他韦保供第一线,承担主要的供应任务。
未来,东阳光药将继续坚守服务患者的初心,秉持「科技创新 健康生活」的理念,潜心耕耘,力争研制出更多更好的新药,惠及国内外患者。
参考文献:
1. Rao H, Song G, Li G, et al. Safety and efficacy of coblopasvir and sofosbuvir in patients with genotypes 1, 2, 3 and 6 HCV infections without or with compensated cirrhosis[J]. J Viral Hepat, 2020,27(1):45-51.
2. Wei L, Lim SG, Xie Q, et al. Sofosbuvir-velpatasvir for treatment of chronic hepatitis C virus infection in Asia: a single-arm, open-label, phase 3 trial[J]. Lancet Gastroenterol Hepatol, 2019,4(2):127-134.
3. Gao Y, Kong F, Li G, et al. Coblopasvir and sofosbuvir for treatment of chronic hepatitis C virus infection in China: A single-arm, open-label, phase 3 trial[J]. Liver Int, 2020,40(11):2685-2693.
4. 罗碧芬, 金晶兰, 饶慧瑛, 等. 磷酸依米他韦联合索磷布韦治疗慢性丙型肝炎病毒感染的有效性和安全性[J]. 中华传染病杂志. 2019,37(07):420-429.
5. Rao H, Yang X, Tan Y, et al. Efficacy and safety of all-oral emitasvir and sofosbuvir in patients with genotype 1b HCV infections without cirrhosis[J]. Journal of Clinical and Translational Hepatology, 2020, 8(3): 255.
6. 中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(12): 1332-1348.











