代謝異常是腫瘤細胞的重要特征之一,與腫瘤發生發展密切相關,是腫瘤治療的潛在靶點。其中, 絲胺酸 從頭合成途徑 是糖解作用代謝的關鍵代謝旁路,透過磷酸甘油去氫酶(PHGDH)等數個代謝酶的催化作用將糖解作用中間產物3-磷酸甘油酸轉化為絲胺酸和甘胺酸,進而介導一碳代謝,為腫瘤細胞快速增殖提供物質和能量基礎,同時產生還原力維持腫瘤細胞內氧化還原穩態。
2023年2月, 四川大學華西基礎醫學與法醫學院黃燦華教授 (第一作者為同單位王魁研究員)和 四川大學生物治療國家重點實驗室魏霞蔚研究員團隊 證實了PHGDH在肝癌中顯著下調,但其酶活卻由於蛋白精胺酸甲基轉移酶1 (PRMT1)介導的精胺酸甲基化而代償性增強,透過加速絲胺酸代謝緩解氧化應激壓力,促進肝癌生長。 景傑生物為該研究提供了IP-MS技術支持 。該成果發表於 Nature Communications (IF=14.7)上。然而,PRMT1的上調機制以及PRMT1- PHGDH軸的調控機制尚不清楚[1]。
在上述研究基礎上,2024年6月5日, 四川大學華西基礎醫學與法醫學院王魁研究員 和 華西公共衛生學院/華西第四醫院蔣靜文副研究員 團隊在 Nature Communications (IF=14.7)發表了題為「 FBXO7 ubiquitinates PRMT1 to suppress serine synthesis and tumor growth in hepatocellular carcinoma 」的研究論文。該研究運用 蛋白質組學技術 、 泛素化修飾位點鑒定技術 發現E3泛素連線酶FBXO7透過泛素化促進PRMT1降解,從而削弱PHGDH精胺酸甲基化和啟用,導致絲胺酸合成受損,活性氧(ROS)積累,最終抑制HCC細胞生長。本研究為FBXO7-PRMT1-PHGDH軸對癌癥絲胺酸合成的調控提供了新的機制見解,並促進了絲胺酸靶向癌癥治療策略的發展。 景傑生物為該研究提供了蛋白質組學技術、泛素化修飾位點鑒定以及泛素化抗體支持 。

1. FBXO7透過泛素化修飾下調了肝癌細胞中PRMT1的蛋白水平
已有研究表明,PRMT1的蛋白水平在肝細胞癌中顯著上調。然而,肝細胞癌組織PRMT1的mRNA水平並沒有顯著變化,因此作者推測PRMT1的上調可能是由其泛素化修飾水平變化來介導的。接著,作者透過公共資料庫篩選出了與PRMT1蛋白互作並且與HCC患者預後良好相關的E3泛素連線酶FBXO7。此外,作者也利用 蛋白質組學 進一步確定PRMT1的互作蛋白, 發現FBXO7是前10個與PRMT1交互作用的候選蛋白中唯一的E3泛素連線酶 。接下來作者透過免疫共沈澱、GST-pulldown等實驗證實了FBXO7與PRMT1的直接交互作用,且 FBXO7在肝癌細胞中是透過泛素依賴的降解途徑來調控PRMT1的蛋白水平 。
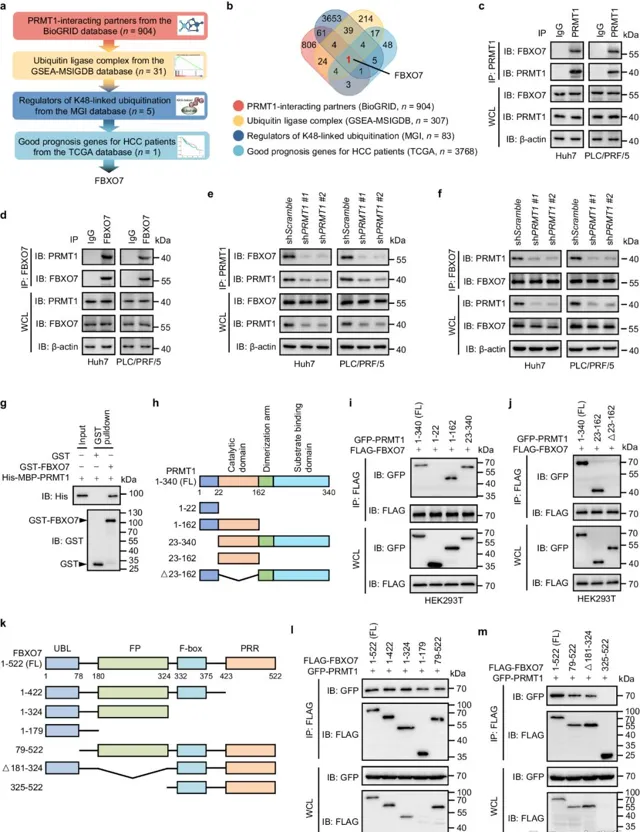
圖1 PRMT1與E3泛素連線酶Fbxo7交互作用
2. Fbxo7介導肝癌細胞中PRMT1賴胺酸37位發生泛素化修飾
接下來作者利用 基於質譜的泛素化位點鑒定技術 手段確定了PRMT1的四個潛在泛素化位點(K37、K82、K202、K325),然後利用點突變 (將這些賴胺酸殘基突變為精胺酸)和蛋白質穩定性檢測,確定了 FBXO7主要是透過催化PRMT1的K37位點泛素化修飾來調節PRMT1蛋白的穩定性 。
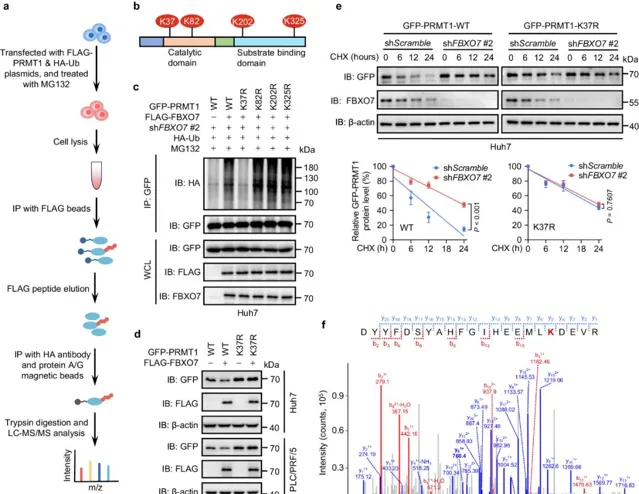
圖2 FBXO7 介導 HCC 細胞中PRMT1的K37發生泛素化修飾
3. FBXO7透過參與PRMT1- PHGDH軸來影響肝癌細胞絲胺酸合成以及氧化應激
該團隊前期研究表明,肝癌中PRMT1上調導致PHGDH的R236甲基化水平上調並導致PRMT1被過度啟用,以促進絲胺酸的合成並維持肝癌生長的氧化還原動態平衡。為了確定FBXO7是否在其中發揮關鍵作用,作者進行了細胞敲除/過表達等一系列分子實驗,發現 肝癌細胞中FBXO7能夠透過下調PRMT1表達來抑制PHGDH R236 的甲基化修飾以及其催化活性 。此外,作者還發現 FBXO7下調PRMT1後能進一步抑制肝癌細胞絲胺酸合成並誘導氧化應激 。

圖3 FBXO7透過下調PRMT1蛋白水平來抑制PHGDH甲基化和活性
4. FBXO7的表型驗證及其臨床相關性
接下來,作者利用細胞實驗和異種移植小鼠模型驗證了FBXO7能夠透過下調PRMT1來抑制PHGDH甲基化和HCC細胞的生長。此外,為了研究FBXO7的臨床相關性,作者透過免疫組化實驗分析了45對人類HCC樣本,發現與正常相鄰組織相比,HCC組織中FBXO7蛋白水平下調,而PRMT1蛋白水平胡PHGDH R236單甲基化水平上調,且FBXO7蛋白水平與PRMT1蛋白水平胡PHGDH R236甲基化水平呈負相關;免疫共沈澱分析顯示,FBXO7與PRMT1在六個人類HCC組織中交互作用,且這種交互作用水平與PRMT1的泛素化水平呈正相關;此外,使用KM plotter資料庫分析HCC患者的生存率,發現FBXO7水平較高的患者其總體生存期和進展無病生存期更長。這些發現表明, FBXO7在人肝癌中的下調是PRMT1介導的PHGDH R236單甲基化和活性上調的主要機制 。
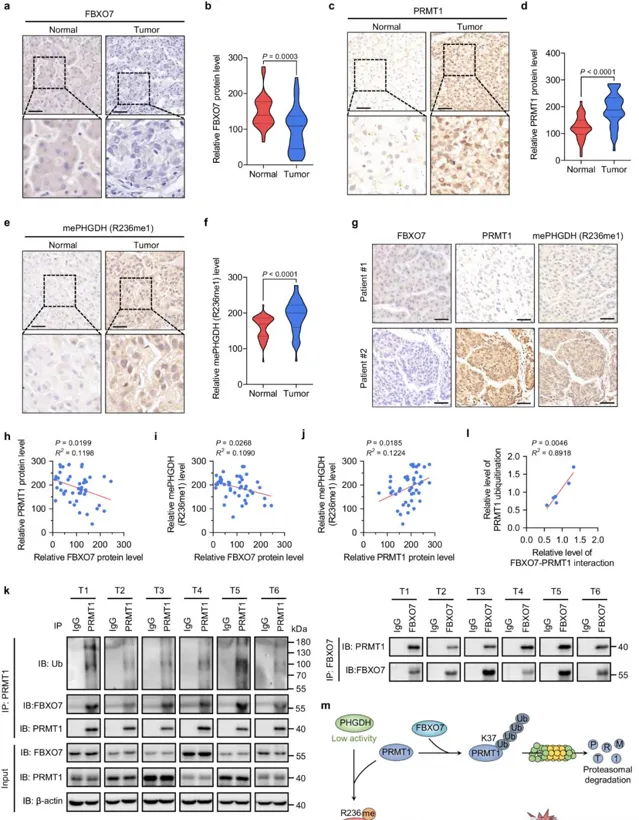
圖4 FBXO7蛋白水平與HCC組織中的PRMT1蛋白水平及PHGDH精胺酸甲基化呈負相關
綜上所述,該研究運用 蛋白組學 和 泛素化修飾位點鑒定技術 , 揭示了FBXO7-PRMT1-PHGDH軸在肝細胞癌絲胺酸代謝調節中的關鍵機制 。作為一種E3泛素連線酶,FBXO7直接與PRMT1交互作用,導致PRMT1 的K37位發生泛素化,進而導致其發生泛素-蛋白酶體途徑的降解。FBXO7介導的PRMT1降解阻止了PHGDH甲基化和啟用,從而抑制絲胺酸合成,加劇氧化應激,並抑制肝癌在體外和體內的生長。
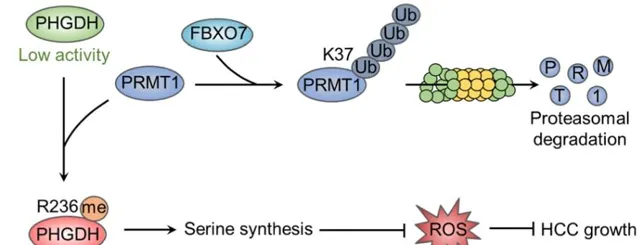
圖5 FBXO7-PRMT1-PHGDH軸調控絲胺酸合成、氧化應激和肝細胞癌生長機制示意圖
景傑評述
由此可見, 本研究是對2023年王魁研究員(一作)[1] 揭示PRMT1介導的PHGDH精胺酸甲基化促進了絲胺酸合成的又一延續性工作 ,運用 蛋白組 鑒定並驗證了PRMT1上遊調控因子FBXO7與其的互作,並運用 泛素化修 飾位點鑒定技術 及分子驗證等實驗,證實了FBXO7介導PRMT1 的K37位發生泛素化,進而導致其泛素化降解,最終串聯了FBXO7-PRMT1-PHGDH軸在肝細胞癌絲胺酸代謝調節中的機制。這提示我們,蛋白質組學和轉譯後修飾組學在解碼復雜生物學和實作精準醫學方面提供了更強大的能力。同時二者的結合,為深入探索生物學的復雜性提供了強有力的工具。不僅能夠揭示蛋白質的表達模式,還能細致地分析蛋白質功能的變化,有助於辨識疾病標誌物、理解病理機制,並為個人化治療方案的設計提供依據。總之,這種串聯的研究思路和策略值得我們借鑒。











