2023年,美國FDA共批準55款新藥上市,僅次於2018年的59款。其中新分子實體達37種,小分子居多,占比約達55%(30款)。從疾病領域來看,小分子新藥多集中在腫瘤和罕見病領域,其次為免疫炎癥、感染、神經系統、心血管及代謝類疾病。
綜合來看,2023年FDA批準的小分子新藥一大亮點在於,具有創新機制的療法占比延續了近年來不斷攀升的大趨勢。本文總結了2023年具有代表性和突破性的小分子新藥,以期希望透過這些小分子新藥的結構、作用機制和臨床數據,對未來國內的小分子藥物研發有所啟發。
2023年FDA批準的小分子藥物一覽
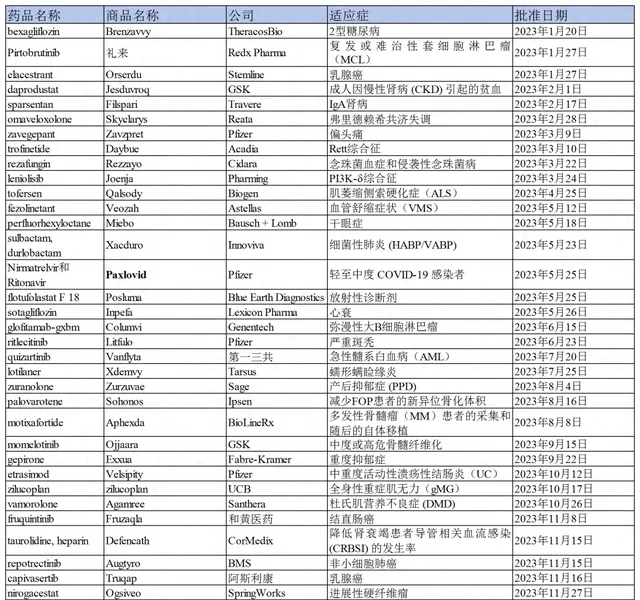
來源:藥渡數據
FDA批準的首款非共價BTK抑制劑
藥品名稱:Jayprica(Pirtobrutinib)
獲批時間:2023年1月27日
適應癥:復發或難治性套細胞淋巴瘤(MCL)
Pirtobrutinib目前為禮來所有,是一款非共價BTK激酶抑制劑,用於治療至少二線全身治療後復發或難治性套細胞淋巴瘤(MCL)的成年患者。在B細胞中,BTK訊號導致B細胞增殖、運輸、趨化性和粘附所必需的通路啟用。Pirtobrutinib與BTK野生型和C481突變體結合,從而抑制BTK激酶活性。
臨床表現:FDA的批準基於單臂的BRUIN試驗中部份患者的數據:在120名MCL患者中,93%的患者接受過2次或以上治療,所有患者均接受過一種或多種共價BTK抑制劑的既往治療,接受Pirtobrutinib治療的MCL患者的總體緩解率(ORR)為50%,緩解持續時間(DOR)中位數為8.3個月。
Pirtobrutinib結構式
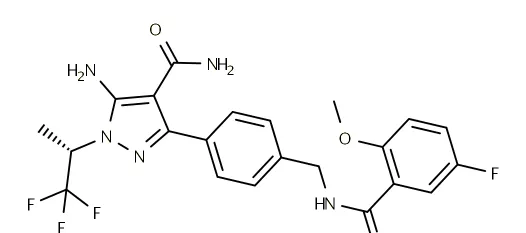
來源:藥渡數據
FDA批準的首款口服SERD
藥品名稱:Orserdu(Elacestrant)
獲批時間:2023年1月27日
適應癥:乳癌
Elacestrant是由Stemline Therapeutics開發的口服雌激素受體拮抗劑(SERD),用於治療在至少一種內分泌治療後疾病進展的,ER+/HER2-、ESR1突變的晚期或轉移性乳癌的絕經後女性或成年男性。在ER+/HER2-乳癌細胞中,Elacestrant在誘導透過蛋白酶體途徑介導的ERα蛋白降解的濃度下抑制17β-雌二醇介導的細胞增殖。Elacestrant在體外和體內均表現出抗腫瘤活性,包括對氟維司群、CDK4/6抑制劑耐藥的ER+/HER2-乳癌模型以及具有雌激素受體1基因(ESR1)突變的模型。此前,SERD只有氟維司群於2002年上市,且需要肌肉註射給藥。
臨床表現:FDA的批準基於在EMERALD III期臨床試驗的療效:478名ER+/HER2-晚期或轉移性乳癌的絕經後女性和男性。在228名(48%)有ESR1突變的患者中,Elacestrant組的PFS中位數為3.8個月,氟維司群或芳香酶抑制劑組為1.9個月。
Elacestrant結構式
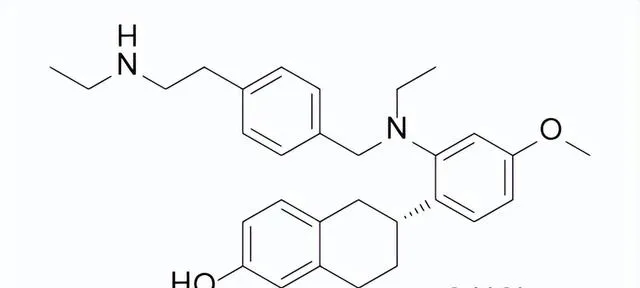
來源:藥渡數據
FDA批準的首款口服治療慢性腎病引起的貧血藥物
藥品名稱:Jesduvroq(Daprodustat)
獲批時間:2023年2月1日
適應癥:成人因慢性腎病(CKD)引起的貧血
Daprodustat是由GSK開發的口服HIF-PHI(缺氧誘導因子-脯氨酰羥化酶)抑制劑,用於每日一次治療接受透析至少四個月的成人因慢性腎病(CKD)引起的貧血。CKD是一個日益增加的全球健康負擔,影響著全世界7億患者,據估計,1/7的CKD患者還患有貧血。抑制HIF-PHI可以穩定缺氧誘導因子,從而導致促紅血球生成素和其他參與糾正貧血的基因轉錄,類似於人體在高海拔地區發生的生理效應。
臨床表現:FDA的批準基於ASCEND-D試驗的結果:8000多名接受長達4.26年治療的患者中,與標準護理促紅血球生成素刺激劑(ESA)相比,Daprodustat可改善和/或維持血紅蛋白(Hb)在目標水平(10-11.5g/dL)內,而不會增加意向治療(ITT)人群的主要不良心血管事件。
Daprodustat結構式
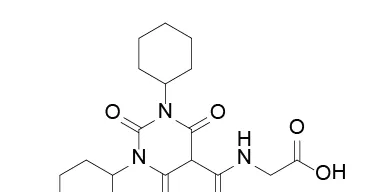
來源:藥渡數據
FDA批準的首款治療FA的藥物
藥品名稱:Skyclarys(Omaveloxolone)
獲批時間:2023年2月28日
適應癥:弗瑞德賴希共濟失調
Omaveloxolone是由Reata Pharmaceuticals開發的first-in- class口服藥物,用於每天一次治療16歲及以上的弗瑞德賴希共濟失調(Friedreich’s ataxia)。Friedreich’s ataxia是由編碼粒線體蛋白frataxin的基因突變引起的,功能性frataxin的喪失會破壞鐵硫簇的生物合成,誘導粒線體功能障礙並增加對氧化應激的敏感性。該疾病會對脊髓、周圍神經和大腦造成進行性損傷,導致肌肉運動不協調、平衡不良、行走困難、言語和吞咽能力改變以及壽命縮短。Omaveloxolone的治療機制尚不清楚,一般認為Omaveloxolone屬於NRF2活化劑(五環三萜類),透過啟用抗氧化轉錄因子NRF2起作用。
臨床表現:FDA的批準基於II期MOXIe試驗的結果:在第48周時,與安慰劑相比,Omaveloxolone治療組具有統計學意義的較低mFARS評分(損傷較小),治療差異為-2.4分。
Omaveloxolone結構式
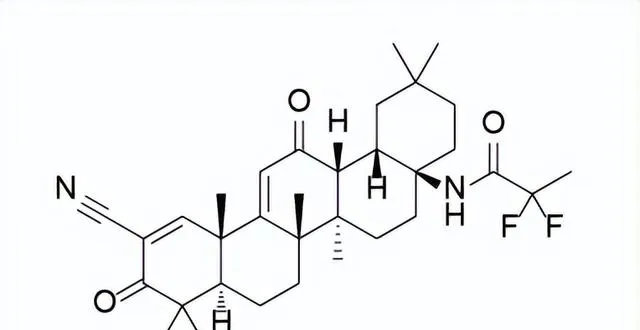
來源:藥渡數據
全球首款用於治療Rett症候群藥物
藥品名稱:Daybue(Trofinetide)
獲批時間:2023年3月10日
適應癥:Rett症候群
Trofinetide是由Acadia Pharmaceuticals公司開發的第一個用於治療2歲及以上的Rett症候群患者的藥物。Rett症候群是一種復雜、罕見的神經發育障礙,通常由MECP2基因的基因突變引起,該基因的缺陷已被證明會導致突觸通訊受損,特點是在6-18個月之前有一段正常發育期,隨後出現顯著的發育倒退。具體表現為失去獲得的溝通技巧,其它癥狀還可能包括出現手部刻板行為(如擰手和拍手)以及步態異常。Trofinetide是IGF-1(胰島素樣生長因子1)的胺基末端三肽(甘胺酸-脯胺酸-谷胺酸,GPE)的合成類似物,對Rett症候群患者發揮治療作用的機制尚不清楚。
臨床表現:FDA的批準基於Trofinetide在兩個主要療效終點:Rett症候群行為問卷(RSBQ)總分和臨床總體印象-第12周時的改善(CGI-I)量表得分,與安慰劑相比具有統計學意義的顯著改善。
Trofinetide結構式
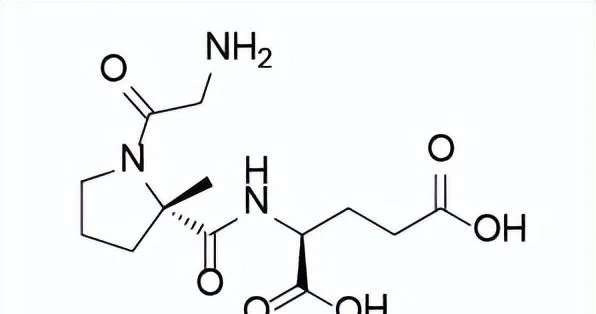
來源:藥渡數據
FDA批準的首款針對APDS的療法
藥品名稱:Joenja(Leniolisib)
獲批時間:2023年3月24日
適應癥:PI3Kδ過度活化症候群(APDS)
Leniolisib是由Pharming開發的口服PI3K-δ(活化磷酸肌醇3-激酶-δ)激酶抑制劑,用於治療12歲及以上患者的PI3K-δ症候群(APDS)。APDS是一種罕見的原發性免疫缺陷病,由PIK3CD或PIK3R1基因(編碼PI3K-δ蛋白)中的遺傳變異引起,每百萬人中有1-2人患病。APDS患者會出現反復感染,尤其是鼻竇、耳朵和呼吸道,還會出現淋巴結、扁桃體和其他器官腫大,這些器官會導致氣道和胃腸道阻塞。此外,APDS患者更容易患上淋巴瘤等血細胞癌。
臨床表現:FDA的批準基於一項為期12周的雙盲、隨機、安慰劑對照研究:納入的31名12歲及以上APDS患者中,21名患者接受了70mg的Leniolisib,10名患者接受了安慰劑,每天兩次,持續12周。到研究的第85天,與安慰劑相比,服用Leniolisib的患者淋巴結大小減少,幼稚B細胞計數增加37%,這表明潛在的免疫缺陷得到了糾正。
Leniolisib結構式
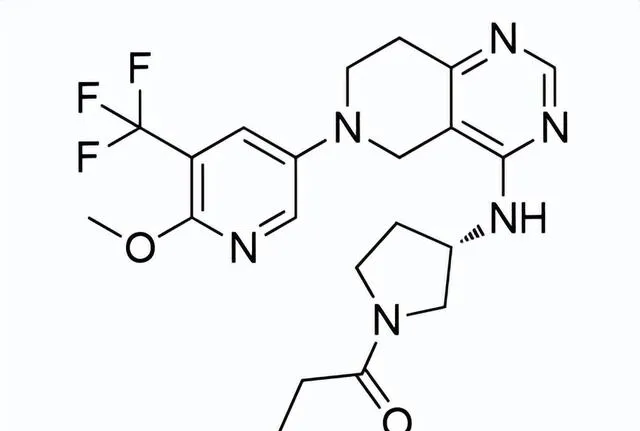
來源:藥渡數據
FDA批準的第一個直接針對淚液蒸發的幹眼癥治療藥物
藥品名稱:Miebo(Perfluorohexyloctane)
獲批時間:2023年5月18日
適應癥:幹眼癥
Miebo是由Bausch+Lomb(博士倫)和Novaliq共同研發的一種半氟化烷烴,用於治療幹眼癥(DED)的體征和癥狀,是FDA批準的第一款用於治療幹眼癥的處方滴眼液。幹眼癥影響數百萬美國人,是最常見的眼表疾病之一。Miebo旨在減少眼表淚液蒸發。全氟己基辛烷是一種半氟化烷烴,含有6個全氟化碳原子和8個氫化碳原子,可在淚膜的氣液界面形成單層,減少蒸發。
臨床表現:在GOBI和MOJAVE的III期關鍵研究中,Miebo達到了主要體征和癥狀療效終點:早在第15天和第57天,患者就經歷了癥狀緩解,在這兩項研究中觀察到Miebo治療組相對於對照組(鹽水)的tCFS和VAS評分都顯著降低。
Perfluorohexyloctane結構式
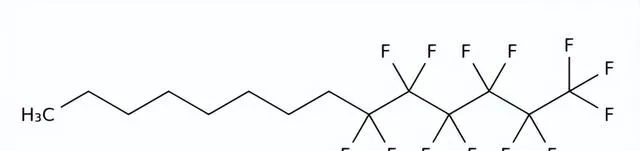
來源:藥渡數據
FDA批準的首款專門用於治療FLT3-ITD陽性AML的FLT3抑制劑
藥品名稱:Vanflyta(Quizartinib)
獲批時間:2023年7月20日
適應癥:急性髓系白血病(AML)
Quizartinib是由第一三共開發的第二代FLT3激酶小分子抑制劑,可與標準阿糖胞苷和蒽環類藥物等化療藥物聯合使用,或作為化療後的維持單藥治療,用於治療FLT3-ITD突變的急性髓系白血病(AML)成人患者。Quizartinib及其主要活性代謝物AC886以相當的親和力與FLT3的ATP口袋結合,兩者對FLT3-ITD突變的結合親和力比FLT3低10倍。
臨床表現:QuANTUM-First是一項隨機、雙盲、安慰劑對照的全球III期研究,結果顯示:與單獨使用標準化療相比,經Quizartinib治療後死亡風險降低了22%,接受Quizartinib治療的患者的CR中位持續時間延長了三倍多,為38.6個月。
Quizartinib結構式
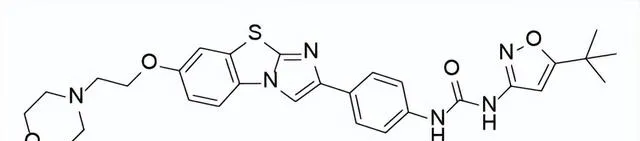
來源:藥渡數據
FDA批準的首款專門針對蠕形蟎的根治療法
藥品名稱:Xdemvy(Lotilaner)
獲批時間:2023年7月25日
適應癥:蠕形蟎瞼緣炎
Xdemvy是由Tarsus Pharma開發的一種外寄生蟲殺劑(抗寄生蟲藥)滴眼液,用於治療蠕形蟎瞼緣炎。Xdemvy是一種對蟎蟲具有高度選擇性的γ-胺基丁酸(GABA)門控氯離子通道抑制劑,抑制這些GABA氯離子通道會導致目標生物體產生麻痹作用,導致其死亡。在美國,蠕形蟎性瞼緣炎影響著大約2500萬眼科患者,這是一種常見但經常被誤診或診斷不足的眼瞼疾病,由蠕形蟎感染引起,蠕形蟎是人體皮膚上最常見的體外寄生蟲。蠕形蟎性瞼緣炎的特征是發紅、炎癥、睫毛缺失或錯位、沿眼瞼基部水平瘙癢。
臨床表現:FDA的批準基於兩項隨機、多中心、雙盲、空白對照研究(Saturn-1和Saturn-2)的結果,旨在評估Xdemvy在833名患者中的安全性和有效性。患有蠕形蟎性瞼緣炎的患者以1:1的比例隨機分配到Xdemvy治療組或對照組,並在6周內每天每只眼睛給藥兩次,試驗結果表明Xdemvy治療組達到了顯著改善。
Lotilaner結構式
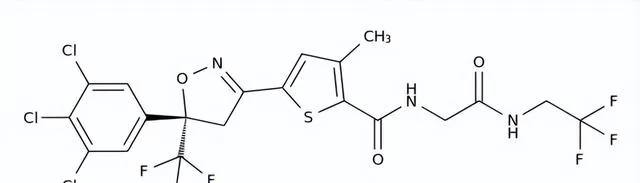
來源:藥渡數據
FDA批準的第一個治療FOP藥物
藥品名稱:Sohonos(Palovarotene)
獲批時間:2023年8月16日
適應癥:減少FOP患者的新異位骨化體積
Sohonos是由Ipsen開發的一種口服生物可利用的視黃酸受體激動劑(類維生素A),用於減少FOP(進行性骨化性纖維發育不良,俗稱「石頭人癥」)患者的新異位骨化體積Sohonos對RAR的γ亞型具有特殊選擇性,透過與RARγ結合,Sohonos抑制SMAD1/5/8的磷酸化來減少BMP/ALK2下遊訊號通路,從而減少ALK2/SMAD依賴性軟骨形成和骨細胞分化。進行性骨化性纖維發育不良是一種罕見的體染色體顯性遺傳疾病,全球只有約900名患者。
臨床表現:FDA的批準基於III期MOVE試驗的關鍵療效和安全性數據,研究結果表明,與不進行超出標準護理的治療相比,Sohonos可有效減少年度異位骨化體積。
Palovarotene結構式
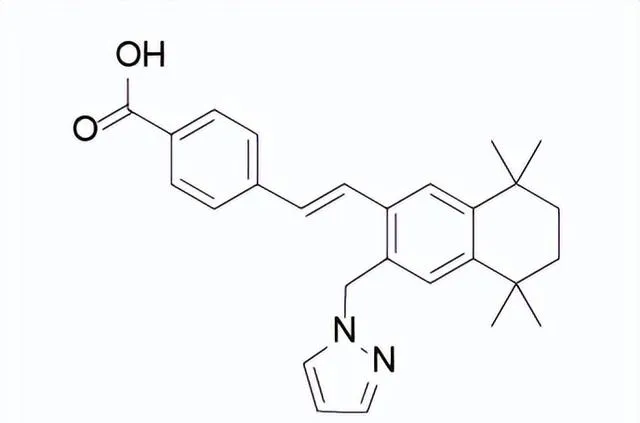
來源:藥渡數據
FDA批準的第一個用於治療MDD的口服選擇性5-HT1A受體激動劑
藥品名稱:Exxua(Gepirone)
獲批時間:2023年9月22日
適應癥:重度抑郁癥(MDD)
Gepirone是由Fabre-Kramer公司開發的first-in- class每日一次的口服5HT1A受體的選擇性激動劑,用於治療成人重度抑郁癥(MDD)。Gepirone的抗抑郁機制被認為與其5HT1A受體選擇性激動劑活性有關。
臨床表現:Gepirone的批準基於兩項為期8周的成人(18-69歲)隨機、雙盲、安慰劑對照臨床試驗,主要療效指標是第8周時漢米爾頓抑郁量表(HAMD-17)總分相對於基線的變化。在這兩項研究中,Gepirone治療組的患者在主要療效相比安慰劑組有統計上顯著的改善。
Gepirone結構式
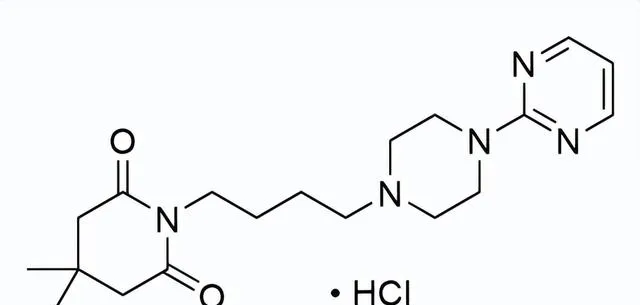
來源:藥渡數據
首創AKT抑制劑、口服選擇性三磷酸腺苷(ATP)競爭性抑制劑
藥品名稱:Truqap(Capivasertib)
獲批時間:2023年11月16日
適應癥:乳癌
Capivasertib是由阿斯利康開發的絲胺酸/蘇胺酸激酶AKT所有3種亞型(AKT1-3)的抑制劑,與氟維司群聯合用於治療患有激素受體(HR)陽性、HER2陰性、患有一種或多種PIK3CA/AKT1/PTEN改變的局部晚期或轉移性乳癌成年患者。腫瘤中AKT啟用是上遊訊號通路啟用、AKT1突變、磷酸酶和張力蛋白同源物(PTEN)功能喪失以及磷脂酰肌醇3-激酶(PIK3CA)催化亞基α突變的結果。
臨床表現:FDA的批準基於一項III期、雙盲、隨機試驗CAPtello-291,該試驗評估Capivasertib聯合氟維司群與安慰劑加氟維司群治療局部晚期HR陽性、HER2低或陰性乳癌。全球試驗招募了708名HR陽性、HER2低或陰性乳癌患者,這些患者在芳香酶抑制劑治療以及最多一線化療期間或之後復發或進展。Capivasertib聯合氟維司群與單用氟維司群相比,可將疾病進展或死亡風險降低50%,中位無進展生存期(PFS)分別為7.3個月與3.1個月。
Capivasertib結構式
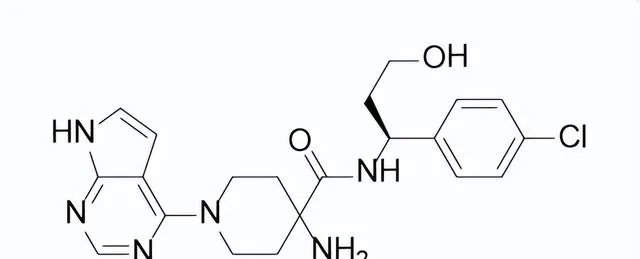
來源:藥渡數據
中國藥企「出海」典範
藥品名稱:Fruzaqla(Fruquintinib)
獲批時間:2023年11月8日
適應癥:結直腸癌
Fruquintinib(呋喹替尼)是由和黃醫藥開發的一款口服的高選擇性、強效的VEGFR-1/2/3抑制劑,用於治療既往接受過氟嘧啶、奧沙利鉑和伊立替康治療的轉移性結直腸癌患者,包括既往接受過抗VEGF治療和/或抗EGFR治療(RAS野生型)的患者。在美國,2023年將診斷出約153000例新發結直腸癌病例,占所有新發癌癥病例的7.8%。大約70%的結直腸癌患者無論是在診斷時還是治療後都會出現轉移性疾病。
臨床表現:FDA的批準基於兩項大型III期試驗的數據FRESCO和FRESCO-2的結果,兩項研究均達到了主要和關鍵次要療效終點:呋喹替尼治療組(461名)的中位OS為7.4個月,而安慰劑組(230名)為4.8個月;呋喹替尼治療組的中位PFS為3.7個月,而安慰劑組為1.8個月;呋喹替尼組的疾病控制率(DCR)為55.5%,而安慰劑組為16.1%。
Fruquintinib結構式
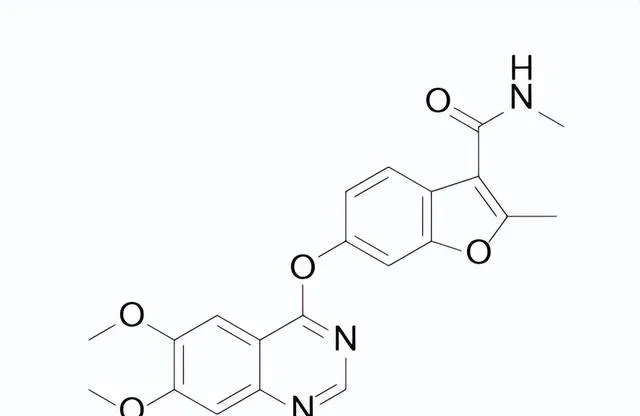
來源:藥渡數據
FDA批準的第一個硬纖維瘤療法
藥品名稱:Ogsiveo(Nirogacestat)
獲批時間:2023年11月27日
適應癥:進展性硬纖維瘤
Nirogacestat是由SpringWorks Therapeutics開發的口服γ分泌酶抑制劑,用於治療需要全身治療的進展性硬纖維瘤成年患者。硬纖維瘤是局部侵襲性和侵襲性軟組織腫瘤,可導致嚴重的發病率。此外,當重要結構受到影響時,硬纖維瘤可能會危及生命。雖然硬纖維瘤不會轉移,但現有的超適應癥全身治療通常難以治愈,並且手術切除後復發率高達77%。
臨床表現:Nirogacestat的有效性在一項國際、多中心、隨機、雙盲、安慰劑對照試驗中進行了評估:與安慰劑相比,Nnirogacestat治療組的PFS具有統計顯著性改善,疾病進展風險降低了71%;Nirogacestat治療組的緩解率為41%,而安慰劑組只有8%。
Nirogacestat結構式
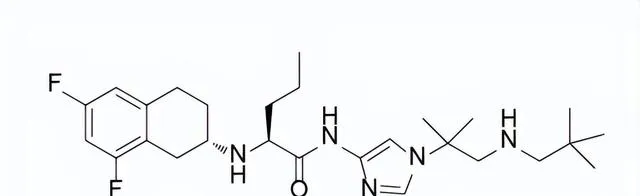
來源:藥渡數據
首款口服單藥PNH療法
藥品名稱:Fabhalta(Iptacopan)
獲批時間:2023年12月5日
適應癥:陣發性睡眠性血紅蛋白尿癥(PNH)
Iptacopan是由諾華研發的補體因子B抑制劑,用於治療成人陣發性睡眠性血紅蛋白尿癥(PNH)。Iptacopan與補體旁路途徑的因子B結合,調節C3的裂解、下遊效應子的產生以及末端途徑的擴增,在補體級聯的替代途徑中發揮近端作用,控制C3b介導的EVH和末端補體介導的IVH。PNH患者具有獲得性突變,使紅血球容易被補體系統過早破壞,特點是溶血、骨髓衰竭和血栓形成,其組合和嚴重程度各不相同。現有的C5抑制劑治療(以輸註形式給藥)可能會使PNH癥狀不受控制。高達88%接受抗C5治療的患者可能患有持續性貧血,其中超過三分之一的患者每年至少需要輸血一次。
臨床表現:FDA的批準基於III期APPLY-PNH試驗,該試驗針對的是盡管先前接受過抗C5治療但仍存在殘余貧血(血紅蛋白<10g/dL)的患者,這些患者轉而使用Iptacopan,該試驗證明在不輸註RBC的情況下,該藥物在改善血紅蛋白方面具有顯著獲益,與繼續接受抗C5治療的患者相比,顯著減少了輸血率。
Iptacopan結構式
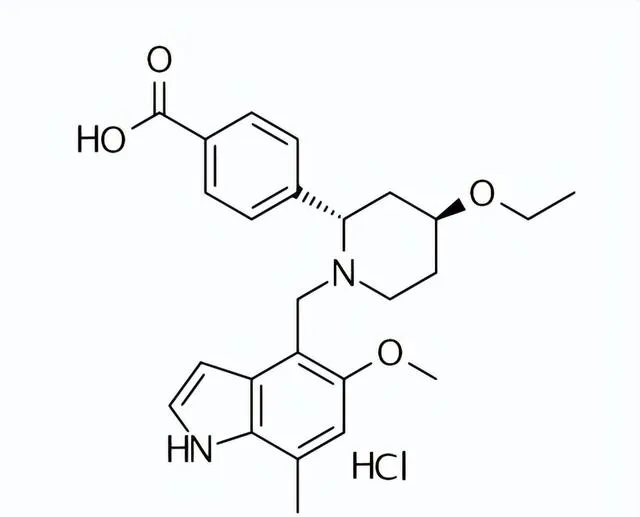
來源:藥渡數據
結語
透過一覽2023年FDA批準的小分子新藥概況,我們發現,這些小分子新藥中有相當大的比例為「first-in- class」,或是針對特定疾病的首款療法,或是針對特定疾病的首款具有全新機制的療法。這對中國醫藥研發領域具有較大啟發意義,醫藥研發真正的意義並非一味地追求「ME-too」或者「Me-better」等能夠快速變現的同質化產品,而是在不斷追求解決人類實際疾病的過程中收獲成功。在原始驅動力上,國內藥企還有很多需要學習的地方。後續發展如何,藥渡還將持續關註。
參考資料
- FDA官方藥物說明書
- 各大藥企官網、公告、年報等
- 維基百科
文章來源:藥渡Daily
原創作者:黃仲平











