歐盟委員會公布第六次MDR和IVDR申請和獲證情況調查結果(截至2023年10月),其對於了解醫療器械過渡狀態,以預見和防止醫療器械的市場混亂而言至關重要。

MDR和IVDR申請和認證情況
與2023年6月獲得的數據以及我們往期文章中數據相比,MDR和IVDR套用數量有顯著增加。
2021年2月至2023年10月,MDR公告機構收到近1.8萬份申請並頒發約5.6萬份產品證書和1萬多份QMS證書。
與此同時,IVDR公告機構收到的申請數量從249份增加到1.5萬份,而簽發的證書數量從7份增加到702份。
2023年10月數據顯示,非歐盟群體中的公告機構客戶數量略高,其中53%的MDR制造商和57%的IVDR制造商位於歐盟以外。
大多數情況下,制造商送出申請後、與公告機構簽訂書面MDR認證協定,兩者相隔時間不到2個月。
上述資訊對制造商期望 享受MDR過渡期延長 較為關鍵 :根據延期法規要求,制造商應在2024年5月前送出申請,並在2024年5月前與公告機構達成書面協定。

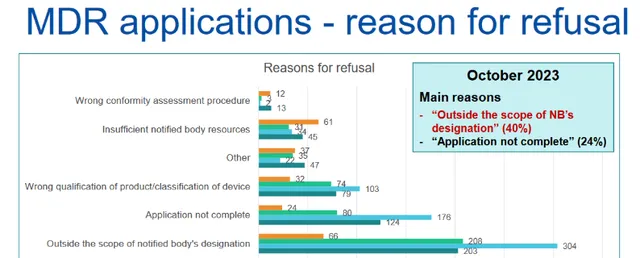
在申請被拒的最常見原因中,公告機構表示 「超出公告機構的指定範圍」、「申請不完整」和「產品資格/裝置分類錯誤」 。然而, 在已接受的申請中,檔不完整的比率仍然很高。
MDR公告機構特別指出以下原因 :
提醒註意的是: 醫療器械制造商應當考慮獲得新認證所需的時間。
當前MDR認證和IVDR認證周期需要13到18個月,該比例占比高達67%。
鑒於延長IVDR過渡期的提案和已確定的MDR過渡期延長,對遺留器械廠商而言,為過渡做好準備並及時聯系公告機構顯得舉足輕重。











