T1加權像高訊號的產生機制
一般認為,T1加權像上的高訊號多由於出血或脂肪組織引起。但近年來的研究表明,T1加權高訊號尚可見於多種顱內病變中,包括腫瘤、腦血管病、代謝性疾病以及某些正常的生理狀態下。
在射頻脈沖的激發下,人體組織內氫質子吸收能量處於激發狀態。射頻脈沖終止後,處於激發狀態的氫質子恢復其原始狀態,這個過程稱為弛豫。在弛豫過程中,氫質子將其吸收的能量釋放到周圍環境中,若質子及所處晶格中的質子也以與Larmor頻率相似的頻率進動,那麽氫質子的能量釋放就較快,組織的T1弛豫時間越短,T1加權像其訊號強度就越高。T1弛豫時間縮短者有3種情況:其一為 結合水效應; 其二為 順磁性物質 ;其三為 脂類分子 。
- 結合水效應
小分子的自由水(如腦脊液)具有非常高的運動頻率,它的運動頻率要遠高於MRI的Larmor頻率,其T1弛豫時間也遠長於身體內其他組織,所以在T1加權像上呈低訊號。如在水中加入大分子的蛋白質,那麽具有極性的水分子會被帶有電荷的蛋白質分子吸引而結合在蛋白質分子上,從而形成一個蛋白質水化層。在此蛋白分子水化層內的水分子受蛋白分子的吸引,致使水分子的運動頻率下降,接近於Larmor頻率。使其T1馳豫時間縮短,故T1加權成像時呈現出高訊號改變。
- 順磁性物質
順磁性物質的特點是含有不成對的電子,常見的有鐵、鉻、釓、錳等金屬、稀土元素及自由基。在磁場中順磁性物質的磁進動與組織內質子進動交互作用,產生一個隨機變化的局部微小磁場,這個微小磁場的變化頻率與Larmor頻率接近,從而使T1弛豫時間縮短。
- 脂類分子
純水分子非常小,運動頻率非常高,遠高於Larmor頻率。大分子如蛋白質和DNA分子運動頻率較慢,低於Larmor頻率。所以大、小分子在T1加權上均呈低訊號。脂類分子為中等大小,其運動頻率高於蛋白質,低於純水,與Larmor頻率相似,所以T1弛豫時間短,T1加權像呈高訊號。
正常腦組織的MR訊號特點
水
水分子較小,它們處於平移、擺動和旋轉運動之中,具有較高的自然運動頻率,這部份水在MRI稱為自由水 。如果水分子依附在運動緩慢的較大分子蛋白質周圍而構成水化層,這些水分子的自然運動頻率就有較大振幅的減少,這部份水又被稱為結合水 。自由水運動頻率明顯高於Larmor共振頻率,因此,T1弛豫緩慢,T1時間較長;較大的分子蛋白質其運動頻率明顯低於Larmor共振頻率,故T1弛豫同樣緩慢,T1時間也很長。結合水運動頻率介於自由水與較大分子之間,可望接近Larmor共振頻率,因此T1弛豫頗有成效,T1時間也較上述二者明顯縮短。局部組織含水量稍有增加,不管是自由水還是結合水,MR訊號均可發生顯而易見的變化,相比之下,後者更為明顯。
認識自由水與結合水的概念有助於認識病變的內部結構,有利於對病變作定性診斷。CT檢查由於囊性星形細胞瘤的密度與腦脊液密度近似而難以鑒別,而MRI檢查由於囊性星形細胞瘤 中的液體富含蛋白質,其T1時間短於腦脊液,在T1加權像中呈較腦脊液訊號為高的訊號。又如,MRI較CT更能顯示腦軟化 。腦軟化在顯微鏡下往往有較多由腦實質分隔的小囊組成,這些小囊靠近蛋白質表面的膜狀結構,具有較多的結合水,T1較短,其影像比CT顯示得更清楚。所以MRI所見較CT更接近於病理所見。再比如,在阻塞性腦積水 時,腦脊液(相當於自由水)由腦室內被強行滲漏到腦室周圍腦白質後,變為結合水,結合水在T1加權像中訊號明顯高於腦脊液,而在T2加權像中又低於腦脊液訊號。綜上所述,局部組織水份增加可分為自由水和結合水,前者引起T1明顯延長而遠離Larmor共振頻率,後者造成T1稍有延長而接近Larmor頻率而致使T1加權像上訊號增強。
脂肪與骨髓組織
脂肪與骨髓組織有較高的質子密度,且這些質子具有非常短的T1值,根據訊號強度公式,質子密度大和T1值小,其訊號強度大,故脂肪和骨髓組織在T1加權像上表現為高強度訊號,與周圍長T1組織形成良好對比,訊號高呈白色。若為質子密度加權像,此時脂肪組織和骨髓組織仍呈高訊號,但周圍組織的訊號強度增加,使其對比度下降;若為T2加權像,脂肪組織和骨髓組織的訊號都將受到一定程度的限制。
肌肉組織
肌肉組織所含的質子密度明顯少於上述脂肪和骨髓組織,且具有較長的T1和較短的T2馳豫特點。所以在T1加權像上,訊號強度較低,影像呈灰黑色。隨著短T2的弛豫特點,訊號強度增加不多,影像呈中等灰黑色。韌帶和肌腱組織的質子密度低於肌肉組織,該組織也具有長T1和短T2弛豫特點,其MR訊號無論在T1或T2加權像上,均表現為中低訊號。
骨骼組織
骨皮質內所含的質子密度很小,MR訊號非常弱,無論在T1加權或T2加權掃描,均表現為黑色低訊號。鈣化軟骨的質子密度特點與骨皮質相同,所以也表現為黑色低訊號。組織內出現其他鈣化,無論其形態或大小,一般均呈現為與鈣化軟骨相同的組織影像特點。
纖維軟骨組織則與鈣化軟骨不同,其組織內的質子密度明顯高於骨皮質和鈣化軟骨。且組織具有較長的T1和較短的T2弛豫特征,但因其具有一定的質子密度,故在T1或T2加權像上,訊號強度不高,呈中低訊號。透明軟骨內含有75%~80%的水份,具有較大的質子密度,並具有較長的T1和長T2弛豫特征。在T1加權像上,因T1值長,所以訊號強度較低。而在T2加權像上,因T2值長,訊號強度明顯增加。
病理組織的MR訊號特點
不同的病理過程,病理組織有不同的質子密度、T1及T2弛豫時間。采用不同的脈沖序列,將表現出不同的的訊號強度。掌握這些訊號變化特點,有助於判別大體的病理性質,部份作出定性診斷。
水腫
腦水腫分為3種型別,即血管源性水腫、細胞毒素水腫及間質性水腫。
血管源性水腫是最為常見的腦水腫,由血腦屏障破壞所致,常見於腫瘤及炎癥。由於血腦屏障破壞,血漿由血管內漏進入細胞外間隙,這是血管源性水腫的病理生理基礎。血管源性水腫主要發生在腦白質內,結構致密的腦灰質通常不易受影響,典型的血管源性水腫呈手指狀分布於腦白質之中,在腫瘤、出血、炎癥以及腦外傷等腦部疾患中頗為常見。由於上述腦病變本身也可使T1或T2時間更長,其MRI表現與水腫有類似之處,尤其在T1加權像上難以分辨。鑒別的方法是采用重T2加權掃描序列,隨著回波時間的延長,水腫訊號強度逐漸增高,而腫瘤訊號增加振幅不大。必要時可行Gd-DTPA增強掃描,水腫區無異常對比增強。
細胞毒素水腫是由於缺氧使ATP減少,鈉-鉀泵功能失常,鈉與自由水進入細胞內,造成細胞腫脹,細胞外間隙減少所致。細胞毒素水腫常見於急性腦梗塞的區域,使腦白質與腦灰質同時受累。急性腦梗塞有時在T2加權影像上,其邊緣部份訊號較高,即為細胞毒素水腫的MRI所見,它反映了梗塞區域存在腫脹的腦細胞。由於細胞毒素水腫出現和存在的時間不長,有時與血管源性水腫同時存在,MRI要絕對區分它們尚有一定的困難。
間質性腦水腫時,由於腦室內壓力增高,出現腦脊液經室管膜遷移到腦室周圍腦白質的病理生理表現。當腦室壓力高,如急性腦積水或交通性腦積水時,T2加權影像上於腦室周圍可出現邊緣光整的高訊號帶;在腦室內壓力恢復到近乎正常時(如代償期),上述異常訊號又消失。間質性水腫由於含有較多的結合水,在T2加權像上已能與腦室內腦脊液(自由水)的訊號區別,在質子密度加權影像上,兩者訊號對比更明顯。
出血
出血在中樞神經系統疾病中常見。按出血部位可分為硬膜下、蛛網膜下、腦內及腦室內出血,它們均有一個基礎疾病,如外傷、變性血管病、血管畸形、腫瘤或炎癥。MRI在顯示出血、判斷出血原因以及估計出血時間方面有獨特作用,其中以腦內血腫MRI訊號演變最具有特征性。較多血液由血管內溢位後,在局部腦組織內形成血腫。隨著血腫內血紅蛋白的演變以及血腫的液化、吸收,MRI訊號也發生一系列變化。因此,探討血紅蛋白及其衍生物的結構對於認識與解釋血腫MRI訊號甚為重要。
人體血液富含氧合血紅蛋白,氧合血紅蛋白釋放出氧氣後即轉化為去氧血紅蛋白。氧合血紅蛋白與去氧血紅蛋白中含有的鐵均為二價還原鐵(Fe2+),還原鐵是血紅蛋白攜帶氧氣、釋放氧氣、行使其功能的物質保證。人體內維持血紅蛋白鐵於二價狀態的關鍵在紅血球內多種代謝途徑,其結果阻止了有功能的亞鐵血紅蛋白變為無功能的正鐵血紅蛋白。但當血液從血管中溢位後,血管外紅血球失去了能量來源,細胞內多種代謝途徑喪失。同時由於紅血球缺氧,血腫內含氧血紅蛋白不可逆地轉化為去氧血紅蛋白,最終變為正鐵血紅蛋白,還原鐵轉化為氧化鐵,使血腫的MRI訊號發生根本的變化。腦出血的MRI表現取決於出血時間,主要由血紅蛋白的不同代謝狀態及血腫的周圍環境決定的。
超急性期:出血時間不超過24h 。紅血球內為氧合血紅蛋白,氧合血紅蛋白內無不成對電子,不具順磁性。T1加權像為等或稍低訊號 ,反映了出血內較高的水含量。T2加權像為稍高訊號 ,說明新鮮出血為抗磁性,不引起T2弛豫時間縮短。
急性期:出血時間為1~3d。 紅血球內為去氧血紅蛋白,它有四個不成對電子,具有順磁性,但它的蛋白構形使水分子與順磁性中心的距離超過3埃,因此,並不顯示出順磁效應,T1加權像仍成稍低訊號 。但由於它具有順磁性,使紅血球內的磁化高於紅血球外,當水分子在紅血球膜內外彌散時,經歷局部微小梯度磁場,使T2弛豫時間縮短,T2加權像呈低訊號 。
亞急性期:出血的3~14d 。出血後3~7d為亞急性早期,7~14d為亞急性晚期 。在亞急性早期 ,去氧血紅蛋白被氧化為正鐵血紅蛋白首先出現在血腫的周圍,並逐漸向血腫內發展,它具有五個不成對電子,有很強的順磁性。由於正鐵血紅蛋白形成,T1加權像呈高訊號 ,T2加權像 因順磁性物質的磁敏感效應而呈低訊號 。亞急性晚期 紅血球開始溶解,在T1或T2加權像上均呈高訊號 。紅血球溶解使紅血球對正鐵血紅蛋白的分隔作用消失,水含量增加是T2加權像訊號增高的主要原因。
慢性期:出血時間超過14d ,含鐵血黃素和鐵蛋白形成。在此期間,正鐵血紅蛋白進一步氧化為氧化鐵,同時由於巨噬細胞的吞噬作用使含鐵血黃素沈著於血腫周邊部,其使T2弛豫時間縮短,因此在血腫的周邊部出現低訊號的影像環帶,其余仍為高強度訊號表現。所以血腫中心T1加權像為等訊號 ,T2加權像為高訊號 ,血腫周邊T1加權像為稍低訊號,T2加權像為低訊號 。
鐵沈積過多
在中高場強MRI系統作T2加權掃描時,可於蒼白球、紅核、黑質、殼核、尾狀核和丘腦部位見到明顯的低訊號,這是由於高鐵物質在上述部位沈積所致。
腦部鐵沈著(非亞鐵血紅蛋白)始於兒童,約在15~20歲達到成人水平。在6個月齡的嬰兒蒼白球中已有鐵存在,黑質鐵沈著見於9~12個月時,紅核在1歲半~2歲,小腦齒狀核要到3~7歲才顯示鐵的存在。上述部位的鐵沈著量與年齡增長有一定相關性,僅沈積速度不一樣,如蒼白球的含鐵量在開始時就高,以後緩慢增加;而紋狀體(如殼核)的含鐵量開始時不高,以後才較蒼白球有明顯的增加,直到70歲之後接近蒼白球內所含的鐵量。大腦與小腦半球的腦灰、白質含鐵量最低,其中相對較高的是顳葉皮層下弓狀纖維,其次為額葉腦白質、枕葉腦白質。在內囊後肢後端以及視放射中幾乎不存在鐵。鐵在腦部選擇性的沈積其機理至今未明。
鐵由小腸吸收之後,以亞鐵血紅蛋白形式(血紅蛋白、肌球蛋白)與蛋白質結合,主要以鐵蛋白形式沈著在腦細胞內,其中以少突神經膠質細胞與星形細胞含量最高。鐵作為一個重要的輔因子,在氧化磷酸化、多巴胺合成和更新以及羥基自由根基形成之中起積極作用。血液中含有的轉鐵球蛋白不容易透過血腦屏障。在鐵沈積較多的上述解剖部位中,毛細血管內皮細胞中的轉鐵球蛋白受體並不比鐵沈積較少或沒有鐵沈積的其他腦部多。但是一些腦變性病、脫髓鞘病以及血管病變也確實在某些部位鐵沈積過多,而且在MRI上有表現,這些疾病包括帕金森氏病(鐵沈積於殼核、蒼白球)、阿耳茨海默氏病(鐵沈積於大腦皮層)、多發性硬化(鐵沈積於斑塊周圍)、放療後腦部(鐵沈積於血管內皮細胞)、慢性出血性梗塞(鐵沈積於出血部位)、腦內血腫(鐵沈積於血腫四周),因此,MRI較其他影像學方法易於檢出與診斷上述疾病。
MRI顯示腦部鐵沈著是高濃度鐵蛋白縮短了T2時間而不影響T1時間所致。細胞內的鐵具有高磁化率,因此腦部鐵沈積過多造成細胞內高磁化率、細胞外低磁化率,局部磁場不均勻,使T2時間明顯縮短,在T2加權影像上呈低訊號。盡管有一些正常腦細胞中也存在鐵,但由於其濃度不夠,不足以在MRI特別是低場強的MR儀上引起明顯的低訊號。
梗塞
梗塞組織因血液供應中斷,組織出現缺血、水腫、變性、壞死等病理變化。梗塞急性期、梗塞部位的水腫致T1和T2均延長,所以梗塞處在T1加權像上訊號強度變低,在T2加權像上,訊號強度增加。亞急性期腦梗塞有時可在T1加權像上表現為高訊號,多為不規則腦回狀。可能是由於缺血使小動脈壁破壞,梗塞後如血管再通或側支迴圈建立,產生出血性變化,導致T2加權像出現高訊號。
變性
不同組織的變性機制不同,所以MRI表現不一。如腦組織變性中一種稱為多發性硬化者,系腦組織脫髓鞘改變,其變性部份水分增加,故致T1、T2延長。在T1加權像見病變區訊號強度低於周圍健康組織,而在T2加權像上,病變區訊號強度增高。椎間盤變性時,富含蛋白質和水分的彈性髓核組織水分減少,且纖維結締組織增多,組織內的質子密度減少。故在T1和T2加權像上,變性的椎間盤訊號明顯低於其他正常的椎間盤組織訊號強度。
壞死
壞死組織的MRI訊號強度隨組織型別不同、壞死的內容物不同而異。一般壞死組織的水分增多,組織的T1和T2弛豫時間變長,在T1加權像上訊號較低,而在T2加權像上訊號強度增加,呈白色高訊號。機體對壞死物的清除和修復,多數形成肉芽組織,肉芽組織內包含大量的新生血管和纖維結締組織。其質子密度較正常組織高,且有長T1和T2的弛豫特點,故表現在T1加權像上為低訊號,T2加權像上為高訊號。部份肉芽組織修復成慢性纖維結締組織,其質子密度較新鮮肉芽組織明顯減少,T2縮短。MR訊號因質子密度過少,在T1和T2加權像上,均呈低訊號表現。
鈣化
部份組織修復的結果為鈣化,如腫瘤鈣化等。鈣化組織內的質子密度非常少,所以一般MRI的訊號無論在T1還是在T2加權像上,均表現為黑色低訊號區。發現鈣化MRI檢查不如CT敏感,小的鈣化不易發現,大的鈣化還需與鐵的沈積等現象相鑒別。
顱內鈣化在T1加權像偶爾可表現為高訊號。CT掃描可見典型的鈣化密度,MRI T1加權像為高訊號,T2加權像為等或低訊號,梯度回波序列掃描為低訊號。實驗證明,鈣化在T1加權像上的訊號強度與鈣化顆粒的大小及鈣與蛋白結合與否有關。當微小的鈣化顆粒結晶具有較大的表面積,並且鈣的重量百分比濃度不超過30%時,鈣化即可表現出高訊號。鈣化顆粒表面積對水分子T1弛豫時間的影響類似於大分子蛋白,距鈣結晶表面近的水分子進動頻率接近於Larmor共振頻率時,其T1加權表現為高訊號。
囊變
囊變是一種較特殊的病理改變。囊內容物大體上可分為二種:一種為含有純水分,另一種為含有蛋白質水分。前者因其內容物為純水,故具有長T1和長T2弛豫特點,在T1加權像上表現為低訊號,在T2加權像上表現為高訊號與腦脊液訊號相似。另一種為含有蛋白質水分的囊,其內水分子受大分子蛋白的吸引作用進入水化層時,質子的進動頻率明顯減低,當此結合水分子的進動頻率達到或接近Larmor頻率時,在T1加權像上其訊號強度有所增加,呈中等訊號乃至高訊號強度表現。在T2加權像上,訊號強度也較高,呈白色高訊號改變。
T1加權成像、T2加權成像
所謂的加權就是「突出」的意思
T1加權成像(T1WI)----突出組織T1弛豫(縱向弛豫)差別
T2加權成像(T2WI)----突出組織T2弛豫(橫向弛豫)差別。
在任何序列影像上,訊號采集時刻橫向的磁化向量越大,MR訊號越強。
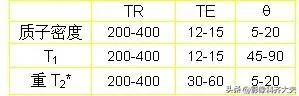
T1加權像 短TR、短TE——T1加權像,T1像特點:組織的T1越短,恢復越快,訊號就越強;組織的T1越長,恢復越慢,訊號就越弱。
T2加權像 長TR、長TE——T2加權像, T2像特點:組織的T2越長,恢復越慢,訊號就越強;組織的T2越短,恢復越快,訊號就越弱。
質子密度加權像 長TR、短TE——質子密度加權像,影像特點:組織的 H 越大,訊號就越強; H 越小,訊號就越弱。腦白質:65 % 腦灰質:75 % CSF: 97 %
常規SE序列的特點
最基本、最常用的脈沖序列。
得到標準T1 WI 、 T2 WI影像。
T1 WI觀察解剖好。
T2 WI有利於觀察病變,對出血較敏感。偽影相對少(但由於成像時間長,病人易產生運動)。成像速度慢。
FSE脈沖序列
原理:FSE脈沖序列,在一次900脈沖後施加多次1800復相位脈沖,取得多次回波並進行多次相位編碼,即在一個TR間期內完成多條K空間線的數據采集,使掃描時間大大縮短。
在一次成像中得到同一層面的不同加權性質的影像。
T1WI——短TE,20ms 短TR,300~600ms ETL—2~6
T2WI——長TE,100 長TR,4000 ETL—8~12
優點:時間短,顯示病變。 缺點:對出血不敏感,偽影多等。
IR序列特點
IR序列具有強T1對位元性;
可設定TI,飽和特定組織產生具有特征性對比影像(STIR、FLAIR);
短 TI 對比常用於新生兒腦部成像;
采集時間長,層面相對較少。
STIR序列 Short TI Inversion Recovery
在IR恢復過程中,組織的MZ都要過0點,但時間不同。利用這一特點,對某一組織進行抑制。如脂肪,由於其T1時間比其他組織短,取TI=0.69T1(T1為脂肪弛豫時間),脂肪的訊號好過0點,接收不到它的訊號。突出其他組織。
FLAIR序列 當T1非常長時,幾乎所有組織的MZ都已恢復,只有T1非常長的組織的 MZ接近於0,如水,液體訊號被抑制,從而特出其他組織。FLAIR (Fluid Attenuation IR) 常用於對CSF抑制。
IR序列的運用
腦部IR的T1加權可使灰白質的對比度更大。眼眶部STIR能抑制脂肪訊號,增加T2對比,使眼球後球及視神經能更好顯示。脊髓采用FLAIR技術能抑制腦脊液搏動產生的偽影,以利於顯示頸、胸段脊髓病變。肝部微小病變,使用IR能處到較好顯示。關節使用IR能同時提高水及軟骨的敏感性。
FLASH
采用「破壞(擾相)」殘余橫向磁化向量。在數據采集結合後,在沿層面選擇梯度方向施加「破壞」梯度,使用殘存的橫向磁化向量加速去相位,從而消除上一周期殘存的橫向磁化。