
仿制藥在醫藥行業中扮演著重要的角色,而仿制藥的一致性評價也是確保其品質和療效的重要手段,這有利於維護公眾的用藥安全和有效性,進一步推動醫藥產業國際化。
根據【藥融雲醫藥行業觀察周報】數據統計,在2023.09.11-2023.09.17期間,共有91項仿制藥註冊申請獲CDE承辦,其中新註冊分類上市申請受理號67項(包括化藥3類,4類),新註冊分類臨床申請受理號5項(包括化藥3類,4類,5.2類),一致性評價申請受理號19項;共16個品種透過一致性評價仿制藥(按受理號計24項),29個品種視同透過一致性評價(按受理號計39項)。
1. 透過一致性評價分析
本周過評品種主要為 系統用抗感染藥 ,過評產品劑型主要為註射劑,還包括片劑、膠囊劑、顆粒劑和散劑;本周過評受理號數量最多的品種為 註射用氨芐西林鈉舒巴坦鈉 ,各個品種過評企業數相同,均為1家企業過評。
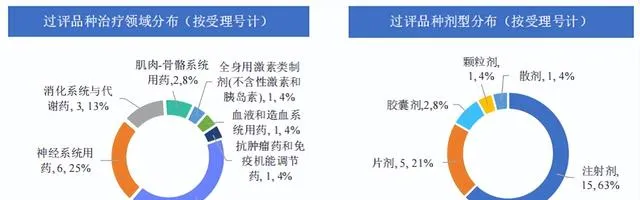
圖片來源:【藥融雲醫藥行業觀察周報】
在本周過評企業中,僅河南潤弘制藥股份有限公司過評2個品種,分別為 地塞米松磷酸鈉註射液和甲硫酸新斯的明註射液 ,除此之外,其余過評企業還包括福安藥業集團慶余堂制藥、山東魯抗醫藥集團和 北京四環制藥、西南藥業、 北大醫藥、石藥集團歐意藥業、等15家企業。
註射用氨芐西林鈉舒巴坦鈉是一種廣譜抗生素,可用於治療多種由敏感細菌引起的感染。藥融雲中國藥品批文資料庫顯示,截至目前,註射用氨芐西林鈉舒巴坦鈉已擁有131條批文,包括國產124條,進口7條,涉及福安藥業、科倫藥業、哈藥集團、白雲山等50家企業。其中,已透過一致性評價的有福安藥業集團、杭州沐源生物醫藥、海南通用三洋藥業、山東道齊生物醫藥。
註射用氨芐西林鈉舒巴坦鈉生產批文查詢(部份)
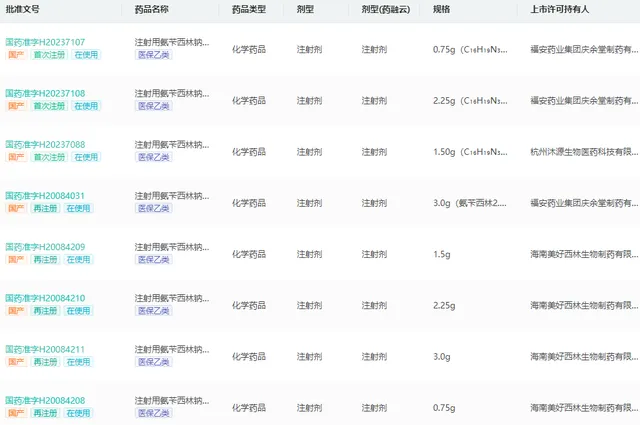
圖片來源:藥融雲中國藥品批文資料庫
藥融雲資料庫顯示,註射用氨芐西林鈉舒巴坦鈉在全國醫院市場的銷售規模在2021年後處於大幅增長的態勢,2022年醫院市場的銷售額為5.37億元,同比增長148.1%;其中成都倍特藥業占據36.49%的市場份額,位居榜首;其次是四川制藥制劑,占比17.01%;海南美好西林生物制藥與海南通用三洋藥業,分別占比9.92%、9.29%;輝瑞位居第五,占比8.22%。
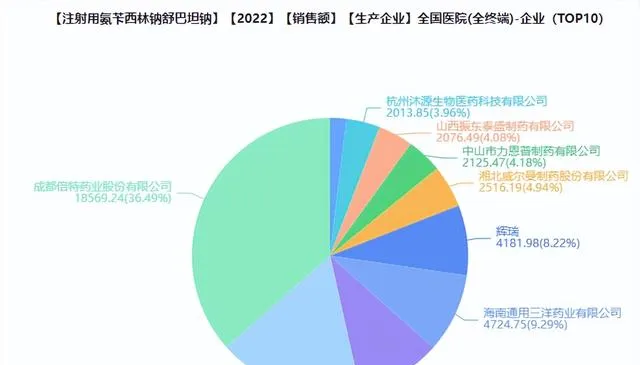
圖片來源:藥融雲全國醫院銷售(全終端)資料庫
2. 視同透過一致性評價分析
本周視同透過的品種主要為 抗腫瘤藥和免疫機能調節藥 ,占比約為13.33%,還包括消化系統與代謝藥、神經系統用藥和心血管系統用藥等10大治療領域;本周視同透過的劑型主要為片劑和註射劑,還包括膠囊劑、口服液體制劑、眼用制劑和顆粒劑。
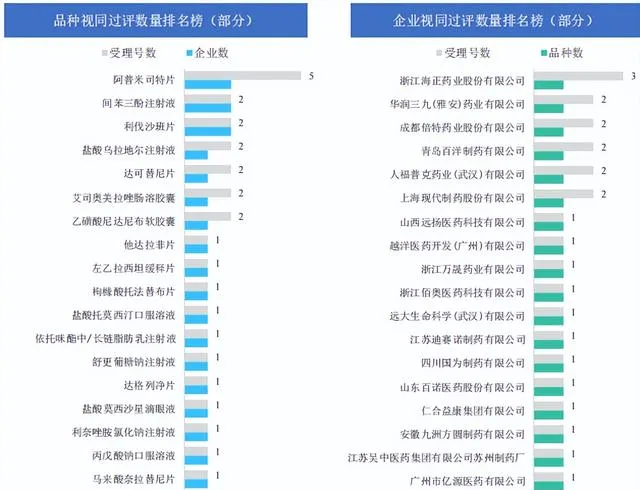
圖片來源:【藥融雲醫藥行業觀察周報】
從品種層面來看,本周共過評29個品種,其中 阿普米司特片 為受理號數量最多的品種,鹽酸烏拉地爾註射液、間苯三酚註射液和利伐沙班片等28個品種緊隨其後。
其中, 阿普米司特片、間苯三酚註射液和利伐沙班片 是過評企業數最多的品種,都有2家企業過評;從企業層面來看視同透過的企業還包括 海正藥業、華潤三九和成都倍特藥業等32家企業。
阿普米司特片——銀屑病患者的首選治療藥物
阿普米司特是一種口服小分子磷酸二酯酶4(PDE4)抑制劑,對環磷酸腺苷(cAMP)有特異性,PDE4的抑制作用導致細胞內cAMP水平增加。
阿普米司特是安進原研的一種口服小分子磷酸二酯酶4(PDE4)抑制劑,對環磷酸腺苷(cAMP)有特異性,PDE4的抑制作用導致細胞內cAMP水平增加。於2014年3月在美國首次獲批,適用於治療患有活動性銀屑病關節炎的成年患者。
目前,阿普米司特在美國已獲批了3個適應癥,還包括用於治療適合光療或全身治療的中度至重度斑塊狀銀屑病成年患者以及用於治療患有與白塞病相關的口腔潰瘍的成年患者。
阿普米司特全球研發現狀
圖片來源:藥融雲全球藥物研發資料庫
阿普米司特片於2021年8月在國內獲批上市,是被中國引進的第一批臨床急需新藥。銀屑病被稱為「不死的癌癥」,常年難愈,更易產生代謝症候群等相關共病,給患者造成身心及經濟上的重大負擔。阿普米司特片作為「首創新藥」,在治療中度至重度銀屑病患者的臨床研究中,體現了出色的有效性和安全性, 是銀屑病患者的首選治療藥物 。
藥融雲資料庫顯示,目前國內已有10家企業擁有阿普米司特片的生產批文,包括浙江海正藥業、上海現代制藥、華潤雙鶴藥業、江西青峰藥業、齊魯制藥、石藥集團等,其中有9家視同透過一致性評價。
利伐沙班片——新型口服抗凝藥物
利伐沙班片是一種選擇性凝血因子Xa抑制劑,由拜耳公司(Bayer Pharma AG)和強生子公司西安楊森(Janssen)聯合開發,於2008年9月率先在歐洲上市,後於2011年7月獲得FDA批準在美國上市,主要用於治療擇期髖關節或膝關節置換手術成年患者,以預防靜脈血栓形成(VTE)。
2009年3月,利伐沙班片被批準進口中國,規格有2.5mg、10mg、15mg和20mg。同年進入國家醫保目錄,2018年進入國家基本藥物目錄,是目前安全用藥經驗人群最廣的新型口服抗凝藥。
利伐沙班自上市以來,市場走勢強勁,是拜耳全球最暢銷的藥物之一,全球範圍內利伐沙班的銷售處於增長狀態,2021年的銷售額增長到537.6億元,年復合增長率6.3%。2017-2021年間,利伐沙班的銷售額在同比5%-9%的範圍內持續增長。
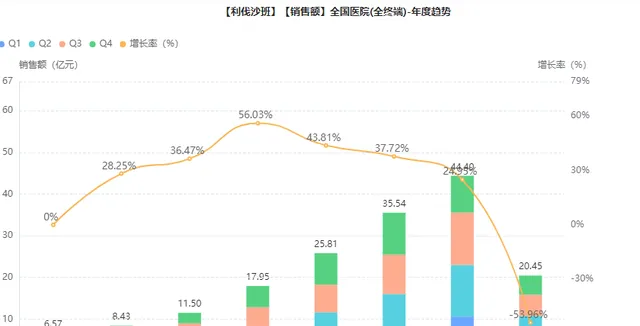
圖片來源:藥融雲全國醫院銷售(全終端)資料庫
藥融雲數據顯示,利伐沙班片在中國醫院終端市場也處於大幅增長狀態,從2016年至2021年,利伐沙班片的年度銷售額均保持了兩位數的增速,2021的銷售規模達到44.4億元,同比增長24.95%。2021年6月利伐沙班片被納入第五批集采。
除此之外,在2023.09.11-2023.09.17期間,還有5個首次過評/視同過評品種,包括鹽酸布比卡因註射液(申報企業為上海禾豐制藥),達可替尼片(成都倍特藥業)、馬來酸奈拉替尼片(上海創諾制藥)、鹽酸伊立替康脂質體註射液(石藥集團歐意藥業)、氟[18F]比他班註射液(北京先通國際醫藥)。
<END>












