編者按: 以德曲妥珠單抗(T-DXd)為代表的新型抗體偶聯藥物(ADC)深刻改變了晚期乳癌的臨床治療格局,尤其是DESTINY-Breast-04(DB-04)研究為HER2低表達(HER2-Low)轉移性乳癌(mBC)患者會奠定了新的標準治療采用抗體偶聯藥物(ADC)T-DXd,此後的新型ADC也探討了HER2-Low患者的套用。如何對不同的ADC藥物進行排兵布陣,才能為患者帶來更大的治療獲益?2023年SABCS大會報道了多項旨在探索ADC用藥順序的真實世界研究,【腫瘤瞭望】特邀 復旦大學附屬腫瘤醫院福建醫院(福建省腫瘤醫院)宋傳貴教授 總結如下。
HER2低表達(HER2-low)乳癌約占總體乳癌的一半[1],以往被籠統歸入HR+/HER2-和三陰性乳癌(TNBC)的治療序列。3期DB-04研究打破了傳統治療分類的邊界,為HER2-Low患者提供了第一個有效的ADC治療方案,此後的ASCENT、TROPiCS-02、TROPION-Breast01(TB-01)等3期研究均關註了HER2-Low患者,NCCN、ESMO等國際權威指南均將HER2-Low作為新的治療分型。然而,有關ADC的用藥順序問題是臨床關註的熱點。在缺乏頭對頭比較研究證據的情況下,真實世界研究(RWS)或可提供一定的參考資訊。本次SABCS大會報道的多項RWS探討了這一問題。
首先,我們需要明確的是,ADC治療失敗後是否可以繼續使用ADC?
來自美國的真實世界A3研究[2],分析了68例接受ADC治療的乳癌患者,初始ADC(ADC1)治療患者的PFS(即PFS1)為161天,而第二次ADC治療(ADC2)的PFS(即PFS2)僅為77天( P <0.01)(下圖左)。Huppert LA等人報道的另一項回顧性研究[3],則分析了56例HR+/HER2-Low和28例HR-/HER2-Low mBC患者,同樣顯示總體上把SG或者T-DXd作為ADC2治療的ORR要低於作為ADC1治療(下圖右)。
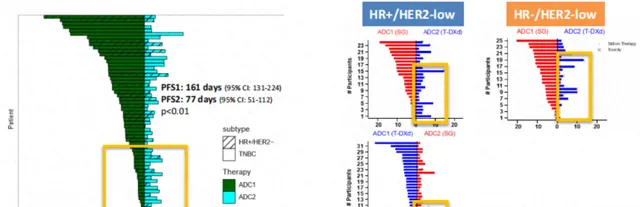
上述真實世界數據表明,提前使用ADC的療效和生存獲益更好。在ADC失敗後再次使用ADC的療效和生存獲益「大打折扣」,當然也有部份患者在ADC2的療效和生存獲益不亞於ADC1(上圖黃框部份),這是未來需要篩選出來的人群。另一方面則是要進一步探討可能導致ADC2療效和生存獲益差的原因。丹娜-法伯癌癥研究所的Garrido-Castro AC教授將ADC治療比喻為「獨奏還是協奏(Solo and in Symphony)」[4],並指出在探討ADC失敗後要不要序貫ADC,以及哪一種ADC應當前置的問題時,需要考慮的一個重要問題是——ADC的交叉耐藥。
那麽,目前ADC主要有哪些交叉耐藥機制?
ADC的耐藥性機制很復雜,但通常與抗體或載藥的耐藥性相關。靶點/抗體耐藥性機制包括 ADC清除、抗原遺失等;載藥耐藥性機制包括載藥清除、載藥相關突變、抗雕亡蛋白上調、內吞受損等[5]。例如,SG作為Trop-2 ADC,靶點Trop-2 T256R突變、載藥TOP1 E418K突變均可導致耐藥;而T-DXd的載藥也是拓撲異構酶I抑制劑,除了HER2通路變異以外,載藥也可發生TOP1突變[4]。在A3研究20例有組織全外顯子分析(WES)的患者中,有7例發生TOP1突變;而且該研究還發現,ADC序貫治療時更換靶點/抗體或更換載藥的患者,交叉耐藥發生率相較於相同靶點/抗體或載藥的患者,在數值上更低[2]。這些結果提示在ADC用藥順序決策時,需要基於不同的ADC藥物機制、不同的潛在耐藥機制進行排兵布陣,以減少交叉耐藥發生,使ADC序貫治療的獲益最大化。

從載藥交叉耐藥的角度出發,應該如何進行ADC排序?
如前所述,T-DXd和SG的載藥均為拓撲異構酶I抑制劑,但靶點分別為HER2和Trop-2。因此,二者序貫用藥時主要考慮如何避免或減少載藥交叉耐藥。除了有條件的情況下,對TOP1常見突變進行檢測以外,真實世界中的療效和生存獲益是否可以反映T-DXd和SG的最佳順序?
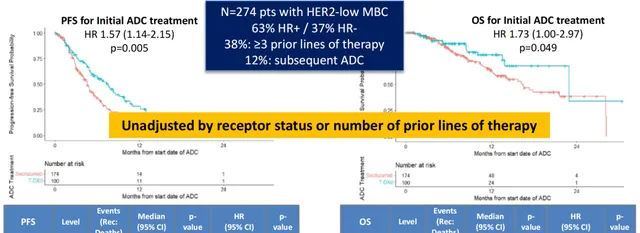
MD安德森癌癥中心報道的真實世界研究[6]中,納入的樣本量相對較大,分析了274例HER2-Low mBC患者(T-DXd組100例,SG組174例;38%接受過≥3線治療)。研究結果顯示:以T-DXd作為ADC初始治療的患者,其PFS(7.6 vs 4.6個月, P =0.005)和OS(22.9 vs 16.4個月, P =0.049)均相較於以SG作為初始ADC治療的患者顯著更長;但在33例ADC序貫治療的患者中,無論是SG序貫T-DXd還是T-DXd序貫SG,二者的PFS(HR 1.02, P =0.97)和OS(HR 0.78, P =0.84)均無顯著差異。
盡管SG和T-DXd的最佳序貫方式尚無明確結論,但是從現有的3期臨床試驗來看,DB-04研究入組患者相對更靠前,總體人群的中位PFS接近10個月,且延長隨訪依然保持獲益;而MD安德森這項較大樣本的RWS也驗證了這一點,T-DXd作為ADC起始治療的PFS和OS均相較於SG更長。
總體上,這次SABCS大會報道相關RWS並不能對T-DXd和SG的最優排序給出明確答案,不同RWS所獲結果參差不齊;而且這些研究的樣本量較小,尤其是Huppert LA等人的研究中SG序貫T-DXd的樣本量僅有24例(ORR 77.3%),因此所獲結果與既往3期臨床試驗結果的差異也比較大(TROPiCS-02研究SG組的ORR為21%[7])。未來需要更大樣本的真實世界研究提供更多資訊。此外,3期DB-06研究入組患者包括低表達和超低表達患者,而且治療線序更靠前[8]。在臨床研究越來越豐富的情況下,針對HER2-Low患者ADC治療的薈萃分析或許也可提供一些資訊。但仍需要透過頭對頭比較的前瞻性臨床隨機對照試驗(RCT)才能回答ADC最佳排序的問題。
從靶點/抗體交叉耐藥的角度出發,又應該如何考慮ADC的排序問題?
靶點突變最直接的生物學表現是影響分子表達的穩定性。眾所周知,HER2是乳癌的驅動基因,且HER2表達具有時空異質性。本次SABCS大會報道的RELIEVE研究[9]分析了196例患者(包括126例HER2+ ,44例HER2-Low,21例HER2零表達),總體上T-DXd穩定的患者治療獲益更好,至下一線治療時間(TTNT)更長,但無論是原發病竈(21/44)還是轉移病竈(25/44),僅有大約一半的患者為HER2-Low穩定,而且HER2-0轉變為HER2-Low的患者TTNT短於HER2-Low穩定的患者;另外在原發竈HER2-0患者中,也有一半(10/21)的患者是由HER2-Low轉變為HER2-0。

Trop-2是廣泛表達與腫瘤細胞表面的糖蛋白,在HR+/HER2-乳癌和TNBC的中高表達率較高。今年ESMO大會報道的一項研究分析了TNBC中的Trop-2表達動力學變化[10]。總體上,從原發病竈(DX)到轉移性病竈(MR),從新輔助治療前的診斷性活檢(DX)到新輔助治療後的殘存疾病(RD),Trop-2免疫組化都保持較為穩定的表達,而且仍然保持中高表達水平。
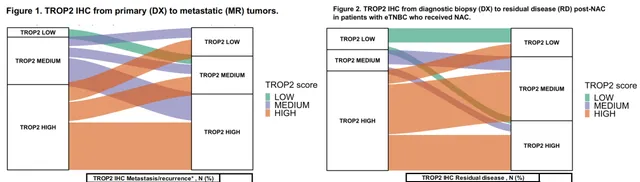
如果從靶點表達穩定性考慮,Trop-2表達的穩定性更好,即便在經過多線治療的患者中可能仍然保持較高的表達水平,所以在後線治療中選擇Trop-2 ADC應當仍有不錯的療效;對於HER2 ADC治療,考慮到腫瘤異質性較強,一旦在原發竈或新診斷時發現HER2-Low或HER2+,應當及時啟動HER2 ADC治療,或者經治患者需要再評估HER2表達情況。因此,T-DXd序貫SG受到靶點/抗體的影響更小,這種用藥順序似乎更合理,但仍需要透過臨床研究加以驗證。
總結
T-DXd和SG已經改變臨床實踐,成為HER2-Low mBC患者的ADC治療選擇。但二者的排序尚缺乏頭對頭臨床試驗,基於T-DXd和SG兩者三期研究設計和療效安全性比較,國內外的指南都一致推薦在HER2低表達mBC中,應優選T-DXd,對於IHC 0或不適用T-DXd的患者,SG亦可作為推薦方案。在此基礎上,本次SABCS大會的RWS結果給予我們以下幾方面的啟示:首先,ADC治療失敗後再次使用ADC仍有部份患者可獲益,影響ADC序貫用藥患者生存獲益和療效的重要因素是不同ADC之間的交叉耐藥,包括靶點/抗體和載藥的耐藥;為了避免交叉耐藥,ADC序貫治療時應盡量選擇不同機制的靶點/抗體或載藥;T-DXd和SG主要區別在於靶點,序貫用藥時需註意載藥TOP1突變的影響,目前的RWS結果未能明確回答什麽樣的T-DXd和SG排序能夠減少交叉耐藥、增加治療獲益;但Trop-2表達穩定性更好,經過多重治療的患者仍可保持中高表達水平,在T-DXd後序貫SG的患者中,靶點/抗體耐藥的影響可能較弱。上述RWS的樣本量仍較小,有關T-DXd和SG序貫治療的結果有所差異,未來需要更大樣本的RWS以及RCT來回答ADC最佳順序的問題。
參考文獻
1. Tarantimo P, Hamilton E, Tolaney SM, et al, HER2-low breast cancer: pathological and clinical landscaple[J]. J Clin Oncol,2020,38(17):1951-1962.
2. Sequencing Antibody-Drug Conjugate after Antibody-Drug Conjugate in Metastatic Breast Cancer (A3 study): Multi-Institution Experience and Biomarker Analysis.PS-08-03;SABCS 2023
3. Multicenter retrospective cohort study of the sequential use of the antibody-drug conjugates (ADCs) trastuzumab deruxtecan (T-DXd) and sacituzumab govitecan (SG) in patients with HER2-low metastatic breast cancer (MBC).PS-08-04;SABCS 2023
4. Ana C. Garrido-Castro.Antibody Drug Conjugates: Solo and in Symphony – Real-World Performance Insights. SABCS 2023
5. Chang HL, Schwettmann B, McArthur HL, Chan IS. Antibody-drug conjugates in breast cancer: overcoming resistance and boosting immune response. J Clin Invest. 2023;133(18):e172156. Published 2023 Sep 15. doi:10.1172/JCI172156
6. Antibody-Drug Conjugates (ADCs) in Breast Cancer: Real World Analysis of Outcomes.PS-08-01;SABCS 2023
7. Rugo HS, Bardia A, Marmé F, et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial. Lancet. 2023;402(10411):1423-1433. doi:10.1016/S0140-6736(23)01245-X
8. https:// classic.clinicaltrials.gov/ct2/show/NCT04494425
9. Impact of HER2 expression dynamics on the real-world activity of trastuzumab deruxtecan for metastatic breast cancer (RELIEVE).PS08-09;SABCS 2023
10. Dynamics of TROP2 expression in triple-negative breast cancer. 4775P;ESMO 2023

宋傳貴 教授
主任醫師、教授、博士生導師
復旦大學附屬腫瘤醫院福建醫院(福建省腫瘤醫院)
乳腺腫瘤學科帶頭人/乳腺腫瘤診治中心執行主任
中國抗癌協會乳癌專業委員會常委
中國抗癌協會腫瘤靶向治療專委會常委
復旦大學腫瘤學博士畢業
中華醫學會腫瘤分會乳腺腫瘤學組成員
CSCO乳癌專家委員會委員
JCO 中文版編委
CN-20231229-00005











