作者 | 李金玲1,朱林燕2
单位 | 重庆邮电大学附属重钢总医院:1.检验科;2.呼吸与危重症与医学科
【前言】
侵袭性肺曲霉菌病(invasivepulmonary aspergillosis,IPA)是一种严重的、危及生命的疾病,常发生于免疫功能缺陷患者。然而,IPA也会影响免疫功能正常的患者,高危人群包括慢性阻塞性肺疾病的患者、急危重症患者等。流感相关肺曲霉菌病(influenza-associatedpulmonaryaspergillosis,IAPA)的临床表现及影像学常常缺乏特异性,易漏诊、误诊,延误治疗,导致不良预后。本文介绍了一例流感相关肺曲霉菌病,通过检验科和呼吸科的沟通与合作,达到了较好的治疗效果。
【案例经过】
患者,男性,59岁,曾多次我科住院诊断为「慢性阻塞性肺疾病」,有较长的肺病基础史。因「反复咳、痰、喘3+年,加重7+天」于2023年4月15日入住我院。
入院查体:体温36.5摄氏度,P78次/分,R22次/分,BP106/76mmHg,神志清楚,热病容,喘累貌,口唇发绀,桶状胸,双肺听诊呼吸音降低,双肺可闻及散在干湿罗音,双下肢无水肿,其余未见明显异常。
实验室检查:
入院查呼吸道病原体五联检测、丙肝抗体、HIV抗体、梅毒非特异性试验均为阴性。
血气分析:PH值:7.518,氧分压67mmHg,碱剩余4.8mmol/L,乳酸2.1mmol/L,葡萄糖7.8mmol/L,缓冲碱52.1mmol/L,实际碳酸氢盐28.4mmol/L,钾2.71mmol/L,钙1.07mmol/L;
血常规:RBC:4.40×1012/L,WBC:19.12×109/L,HBG:132g/L,PLT:222×108/L,NEUT:17.78×109/L,LYMPH:0.34×109/L,CRP:78.96mg/L。
凝血功能:FBG:4.36g/L,D-Dimer:2050μg/L,FIB:5.20g/L。
生化:肝功能示TP:57.2g/L,ALB:34.6g/L,PAB:193mg/L,5,-NT:11.6U/L;肾功能示Urea:10.70mnol/L;电解质示钾:2.05mnol/L,钙:2.05mnol/L;心肌损伤标志物示IMA:88.00U/L。降钙素原、N-末端脑钠肽前体未见异常。
结合影像学检查初步诊断:1、慢性阻塞性肺病伴急性加重;2、高血压病3级极高危。
诊疗经过:
患者入院后结合初步诊断给予哌拉西林舒巴坦抗感染,倍他米松抗炎,以及相应对症治疗后患者仍感喘息。4月20日晚患者出现发热,肺部CT提示双肺大片感染灶;送检微生物学病原体检测,其中痰培养结果提示:「铜绿假单胞菌感染」,改抗生素为亚胺培南西司他汀+左氧氟沙星抗感染。但患者仍反复发热。4月24日改抗生素为美罗培南+万古霉素抗感染,于4月25日完善支气管镜检查,气管镜结果提示感染,灌洗液送细菌、真菌、结核菌涂片,细菌培养,mNGS,GM试验检查,其中mNGS检出甲流、烟曲霉、耶氏肺孢子菌。停用美罗培南+万古霉素抗感染,予以伏立康唑+SMZ+奥司他韦抗真菌及病毒感染。患者病程中肝功能转氮酶异常,加用谷胱甘肽+双环醇保肝;D-2聚体进行性升高,予以低分子肝素2500u预防深静脉血栓。双下肢静脉超声声像图未见明显异常,肺动脉主干及其主要分支未见明显肺栓塞征象。抗感染治疗12天后患者病情得到有效控制,出院后继续口服伏立康唑,一个多月后复查胸部CT,病灶较前吸收减少。
表1 检查指标变化
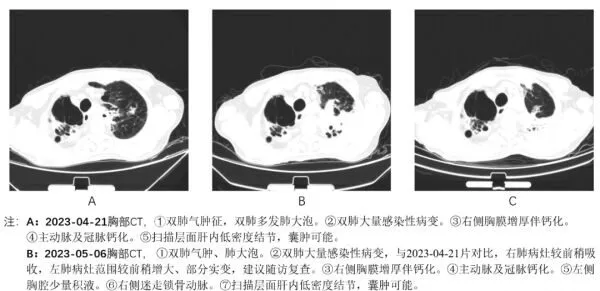
图1 肺部CT变化
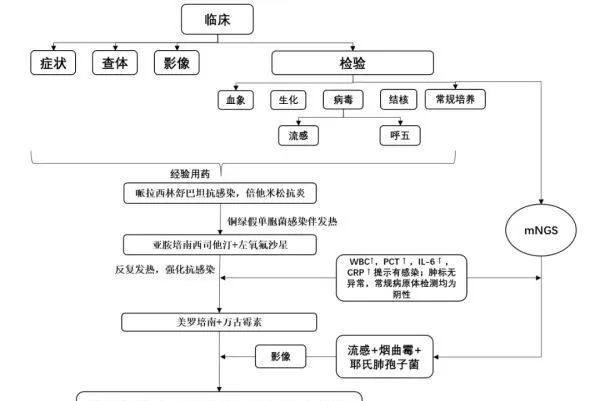
图2 治疗流程图
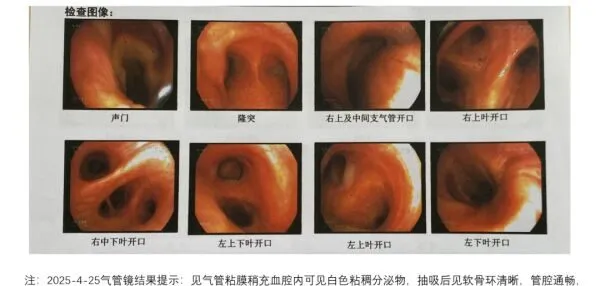
图3 气管镜检结果
图4 NGS检测结果概览
【案例分析】
检验案例分析
根据微生物常规痰培养提示「铜绿假单胞菌」,该患者初始诊断COPD伴铜绿假单胞菌感染,但后续治疗后效果不佳,几天后出现畏寒、发热,给予换药抗感染治疗后症状无改善,仍反复发热,中期患者白细胞、降钙素原和白介素6的升高提示机体存在其它病原体感染。本实验室建议临床取肺部灌洗液做特殊病原体检测或者继续做常规微生物培养。最终肺泡灌洗液mNGS结果提示「甲流、烟曲霉、耶氏肺孢子菌」,明确了患者肺部感染为流感合并真菌感染,经积极治疗,病情得到较好控制。值得注意的是,流感患者病情加重以及长期接受大量糖皮质激素治疗会使流感相关肺曲霉菌病发生率增高。
本例患者在初期治疗过程中使用了糖皮质激素,但是用量不大以及用药时间不长,因此糖皮质激素应该不是该患者IAPA的主要诱因。然而本例患者有COPD病史,这类本身有肺部基础疾病的患者仍需特别留意流感继发的真菌感染。
临床案例分析
本病例特点:中年男性,既往有结核病史、COPD和高血压病史,长期使用含有ICS吸入剂控制症状,偶尔因急性发作住院应用静脉激素。发病时间处于流感高发期。此次发病表现为发热、喘累、咳嗽加重,经抗感染和激素等治疗症状一度好转出院,但随后再次恶化持续发热入院。体征:发热、喘累貌,口唇发绀,桶状胸,双肺未闻及湿啰音。实验室检查如上述。胸部CT多次提示双肺气肿征,双肺多发肺大泡,双肺大量感染性病变。
这是1例COPD患者咳嗽喘累加重伴有发热的病例,患者突出的症状均为AECOPD的常见临床表现,血白细胞、C反应蛋白升高提示合并感染,但患者经过积极的抗生素和支气管扩张剂的治疗后病情一度好转但再次恶化,此时应该重新评估是否容易与AECOPD混淆的其他疾病,如耐药菌、病毒、结核菌、非典型病原菌、真菌等非常规病原菌的感染性疾病,以及合并肺栓塞、心力衰竭、胸腔积液等非感染性疾病。
近年来发现非粒细胞缺乏宿主如COPD、危重症患者亦是IPA的易感人群。因患者肺功能差,粘液纤毛清除功能受损,长期使用糖皮质激素及合并高血压的基础疾病,需警惕真菌感染,特别是气道内容易发生曲霉菌的定植。COPD患者并发IPA的临床表现多缺乏特异性,反复发作难以纠正的呼吸困难可能是COPD患者感染曲霉菌的特点,特别是抗生素治疗无效的肺部感染伴随进行性呼吸困难的要警惕COPD合并IPA的可能,此类患者多有明显的支气管痉挛,部分患者出现痰量明显增多,少数患者伴发热。此类患者的肺部影像学改变呈现多样性,特异性较差,以肺气肿或慢性支气管炎等基础疾病表现,可迅速进展为非特异性肺部实变和渗出,出现典型IPA特征性改变如晕轮征、新月征、曲霉菌球等。
患者发病时间点为4月份,系流感病毒感染的高峰期,同时近期几年爆发了新冠病毒感染,发热为病毒感染的常见症状,此患者有COPD病史,系感染高危人群。另外患者血气分析提示低氧血症,肺泡-动脉血氧分压差增大,需警惕COPD合并肺栓塞的可能,需予以鉴别诊断。入院后我们在积极抗感染的同时送检微生物学标本进行病原体检测,并完善血浆D-二聚体、下肢静脉彩超等进一步除外栓塞性疾病。2023年4月25气管镜检查提示感染,灌洗液mNGS检测提示烟曲霉、甲型流感、耶氏肺孢子菌,进一步证实了临床诊断,予以伏立康唑、磺胺、奥司他韦胶囊抗感染,随访复查胸部CT提示病情稳定,出院后继续口服伏立康唑继续治疗,半月后复查胸部CT。
【知识拓展】
流感与曲霉菌感染关系密切,流感继发的真菌感染中排第一的是烟曲霉感染(17.8%)[1]。流感病毒侵入呼吸系统,会导致人体对真菌的清除及防御能力减弱,从蛋白基质层面导致真菌的定植和侵袭率升高,同时,病毒可通过破坏支气管黏膜、干扰黏液纤毛清除系统和影响白介素分泌,促进IPA发生。IAPA于1952年首次被报道,2009年H1N1大流行后,IAPA才得到了广泛关注。研究发现,H1N1导致的肺部微生物学改变与过敏反应可能影响曲霉菌代谢,从而使曲霉菌生长速率增快、细胞壁厚度增加[2]。因此,2018年发布的【欧洲曲霉菌病的诊断和管理指南】明确将流感患者列为曲霉菌感染的高危人群[3]。治疗流感的两大类抗病毒药物包括神经氨酸酶抑制剂和金刚烷类。目前FDA批准了3种神经氨酸酶抑制剂用于治疗流感:口服奥司他韦、吸入扎那米韦和静脉注射帕拉米韦[4]。对于IAPA患者最常用的抗真菌药物为伏立康唑(三唑类)、两性霉素B或两性霉素B脂质体(多烯类)、棘白菌素类等,欧美国家的指南中均推荐伏立康唑为首选药物,重症患者推荐静脉给药[5]。多烯类或三唑类药物与棘白菌素类早期联合应用可发挥协同作用[6]。
【案例总结】
IPA在病毒性肺炎患者中的报道日益增多,应引起检验与临床的重视。本例患者治疗过程中起初抗感染效果不佳,中期感染加重,病原体不明,最终通过二代测序确定为流感病毒合并烟曲霉感染,为后续治疗提供指导支撑作用。鉴于流感合并侵袭性真菌感染的高发病率、高死亡率,针对重型/危重型流感患者,特别是免疫力低下或者接受了大量糖皮质激素治疗的,应该早期开展真菌筛查,建议早检测、早诊断、早治疗,提高患者的治愈率与生存率。
【专家点评】
点评专家:陈莎娜 重庆邮电大学附属重钢总医院副主任技师
流感相关肺曲霉菌病缺乏特异性的影像学特征,多种微生物学方法包括下呼吸道标本培养、血清GM试验均是有效的诊断方法。传统病原学检测手段在感染性疾病诊断过程中显示出良好的应用价值,二代测序技术在疑难少见病原体诊断中也发挥出巨大优势。侵袭性肺曲霉菌病往往进展较快,如治疗不及时患者预后较差。IPA的易感人群除了免疫系统缺陷患者,也包括本身肺部存在基础疾病的患者,该例COPD患者诊断为流感合并侵袭性肺曲霉菌病后,将抗细菌感染治疗改为抗病毒和真菌治疗后,治疗效果显著。这提示我们将免疫学、传统病原学以及分子检测手段合理应用,相辅相成,能更好的为临床在感染性疾病的诊断中提供参考依据,及早用药,提高患者的治愈率和生存率。
[1]BEUMER MC, KOCH R M, VAN BEUNINGEN D, et al. Influenza virus andfactors that are associated with ICU admission, pulmonaryco-infections and ICU mortality[J].J Crit Care, 2019, 50: 59-65.
[2]BRIARD B, MISLIN G L A, LATGÉ J P, et al. Interactions betweenAspergillus fumigatus and pulmonary bacteria: current state of thefield, new data, and future perspective[J].Fungi (Basel), 2019, 5(2): 48.
[3]MARTIN-LOECHES I, MARCUS J S, VINCENT J L, et al. Increased incidenceof co-infection in critically ill patients with influenza[J].Intensive Care Med, 2017, 43(1): 48-58.
[4]Dandachi D. Viral pneumonia: etiologies and treatment[J].Journalof Investigative Medicine: the official publication of the AmericanFederation for Clinical Research,2018,66( 6 ) : 957-965.
[5]Ullmann AJ, Aguado JM, Arikan‐Akdagli S, et al. Diagnosis andmanagement of Aspergillus diseases: executive summary of the 2017ESCMID‐ECMMERS guideline[J]. Clin Microbiol Infect, 2018, 24(Suppl1): e1‐e38. DOI: 10.1016 / j. cmi. 2018.01. 002.
[6]PATTERSON T F, THOMPSON G R, DENNING D W, et al. Practice guidelinesfor the diagnosis and management of aspergillosis 2016 update by theInfectious Diseases Society of America[J].Clin Infect Dis, 2016, 63(4): e1-e60.
编辑:笪文武 审校:陈雪礼











