VV-ECMO期间机械通气的设置与监测
中山市小榄人民医院 周卉芬
重症行者翻译组
引言
机械通气可通过容积伤、气压伤、肺不张、肌损伤和生物损伤等多种机制,引起急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)患者的呼吸机相关性肺损伤(ventilator-induced lung injury ,VILI)[1]。在最严重的ARDS中,虽然机械通气的容量和压力有限,但婴儿肺越小,通气风险的可能性越大。为了进一步限制机械通气传递到肺部的能量,学者提出了更低的潮气量(≤4 ml/kg)、呼吸频率(<20次/min)和气道压(平台压<25 cmpO和驱动压≤15cmpO)的「超肺保护性」通气策略[2]。但是,如不使用体外生命支持(ECLS)装置进行体外气体交换,这种策略可能导致严重的呼吸性酸中毒。静脉-静脉体外膜氧合(VV-ECMO)作为ECLS的一种形式,可替代自身肺功能、提供充分的体外血液氧合和二氧化碳去除。在随机对照试验(RCTs)和Meta分析中,VV-ECMO可显著降低潮气量、呼吸频率、平台压和驱动压[3,4],且与生存获益相关[3-6]。然而,ECMO时最佳机械通气设置仍存在争议。在这篇叙述性综述中,我们总结了因严重ARDS接受VV-ECMO患者中进行机械通气管理和监测的最新进展、原理和证据。我们还将讨论这一领域的研究议程。
历史背景
1 ECMO里程碑试验中的通气策略
目前仍缺乏ECLS期间的最佳机械通气设置的研究数据 (表1)。因此,目前的建议是基于专家意见[7]和极少数具有里程碑意义的试验结果的[3,4]。ECLS期间肺休息的概念首先由Gattinoni等人在一项非对照性系列中提出[8],即ARDS患者通气时的吸气峰压限制在35-45 cmpO,低呼吸频率(<5次/min),呼气末正压(PEEP)设置为15-25 cmpO。在CESAR试验[4]中,患者被随机分为两组,一组在其原中心接受常规治疗(90例患者),另一组则转诊到ECMO中心考虑接受ECMO治疗(90例患者),后者在ECMO下采用「肺休息」策略(压力控制模式,吸气峰压限制在20 -25 cmpO,PEEP 10 -15 cmpO,呼吸频率10次/min,吸入氧浓度[FiO2] 0.3)。尽管ECMO组在6个月的死亡率或重度残疾率更低,但该研究因多项方法学局限性而受到评论。具体来说,只有75%的转诊患者接受了ECMO治疗,对照组中只有70%患者接受了保护性机械通气。在EOLIA试验[3]中,重度ARDS患者被随机分配接受即刻VV-ECMO或常规保护性机械通气。ECMO组采用辅助控制模式(降低潮气量,使平台压≤24cmpO, PEEP≥10 cmpO,呼吸频率10 -30次/min,FiO2 0.3)或气道压力释放通气模式(APRV,高压≤24 cmpO, PEEP≥10 cmpO,吸呼时间比1:2,FiO2 0.3)。在随机分组后的数小时内,ECMO组患者潮气量(6.0±1.3 vs. 3.5±1.0 ml/kg)、平台压(30±6 vs. 24±3 cmpO)、驱动压(18±7 vs. 13±2 cmpO)、呼吸频率(30±5 vs. 23±2次/min)均显著下降,而PEEP(12±4 vs. 11±3 cmpO)无变化。ECMO组死亡率较低(35% vs. 46%),但这一差异未达到统计学意义(p = 0.07)。
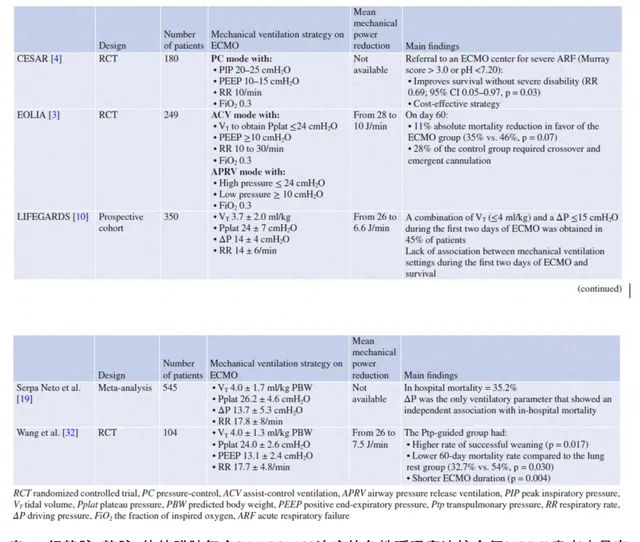
2有经验的ECMO中心的当前实践
2013年,283个体外生命支持组织(ELSO)注册中心的141名医学主任和ECMO项目协调员进行了一项国际横断面调查[9],结果显示,只有27%的中心对接受VV-ECMO的患者有明确的机械通气方案。报告称,这些中心中大多数(77%)将「肺休息」作为机械通气的主要目标,而9%中心将「肺复张」作为通气策略。76%的受访者将潮气量设定为≤6ml/kg,但只有34%的受访者将潮气量设定为< 4 ml/kg。77%的患者PEEP≤10 cmpO。急性呼吸窘迫综合征体外膜肺氧合患者的通气管理(ventiLatIon management oF patients with Extracorporeal membrane oxyGenation for Acute Respiratory Distress Syndrome, LIFEGARDS)是最近第一项专门设计来描述接受ECMO治疗的ARDS患者的通气管理的前瞻性研究[10]。LIFEGARDS包括一个国际性、多中心队列,其中包括10个国家的23个中至高容量ECMO重症监护病房(icu)的350例接受ECMO支持的患者。它证实ECMO启动后超肺保护通气的广泛应用,可显著降低患者潮气量(6.4±2.0 vs. 3.7±2.0ml/kg),平台压(32±7 vs. 24±7 cmpO),驱动压(20±7 vs. 14±4 cmpO),呼吸频率(26±8 vs. 14±6次/min)和机械动能(26.1±12.7 vs. 6.6±4.8 J /min),而大多数病人PEEP(12±4 vs. 11±3 cmpO)均大于10 cmpO。然而,在ECMO前2天的呼吸机设置和生存率之间的多变量分析中未发现关联。
3 ECMO期间目标性超肺保护性机械通气
3.1潮气量
降低潮气量是限制机械通气对肺部施加的应力和应变并因此导致VILI的基石。使用大鼠酸诱导肺损伤模型中,相同PEEP水平(10 cmpO)下,潮气量从12 ml/kg降低至6 ml/kg、3 ml/kg,可减轻肺水肿和肺损伤、增加肺泡上皮细胞的保护作用[11]。实际上,由于体外二氧化碳清除(ECCO2R)装置无法充分清除二氧化碳以控制呼吸性酸中毒,导致潮气量下降程度受限(6.3-4.5 ml/kg),这可能解释REST试验未能改善ARDS患者结局的原因。相比之下,在被随机分配至EOLIA试验ECMO组的患者和LIFEGARDS队列的患者中,ECMO可使其潮气量下降幅度更大(<4 ml/kg)。体外生命支持组织(Extracorporeal Life Support Organization, ELSO)指南建议将目标潮气量控制在4 ml/kg以下[7]。
3.2平台压
平台压易于在床旁测量,并在ARMA试验[13]发表后受到了高度的关注。REVA Network关于pN1流感相关ARDS的研究报告称[14],开始VV-ECMO治疗后,存活者的平均平台压显著低于死亡者(25±3对29±5 cmpO;P < 0.01)。在该项研究中,VV-ECMO第一天较高的平台压(>25 cmpO)与死亡率显著相关(优势比[OR] = 1.33, 95%可信区间[CI] 1.14 ~ 1.59, p < 0.01)。在最近的VV-ECMO系列[15,16]及ELSO[7]均推荐,将平台压<25cmpO作为目标。
3.3驱动压
驱动压为平台压减去PEEP。它也可以表示为潮气量与呼吸系统顺应性的比值(ΔP=VT/CRS),表明在ARDS患者中观察到的肺功能尺寸的减小(即婴儿肺)。在之前的随机对照试验和后续研究的事后分析中[10,17,18],驱动压是ARDS患者死亡率的一个强有力的预测因子,驱动压>14 cmpO与较高的死亡风险相关[17]。在一项对接受ECMO治疗的成人ARDS患者的观察性研究中,个体患者数据荟萃分析报告显示,驱动压是唯一与院内死亡率独立相关的通气参数[19]。在这种情况下,将VV-ECMO的驱动压设定为<14 cmpO似乎是可取的,目前该目标应用于ECMO装机容量较高的医疗中心[10]。
3.4呼吸频率
肺萎陷和扩张的频率,即呼吸频率会导致VILI。在猪ARDS模型中,Grasso等评估了呼吸频率降低联合ECCO2R的获益[20]。在固定潮气量(6 ml/kg)时,较低的呼吸频率与减少生物创伤相关且保留肺通气 [20]。对LUNG SAFE研究[21]进行的二次分析也证实,较高的呼吸频率与院内死亡率增加独立相关。最近,Costa等[22]在包含4,549例ARDS患者的回顾性汇总数据库中证明,只有驱动压和呼吸频率与死亡率显著相关。在这项研究中,驱动压对死亡率的影响是呼吸频率的4倍。ELSO推荐的呼吸频率为4 ~ 15次/min[7],而EOLIA和LIFEGARDS研究报告的ECMO治疗时的呼吸频率更高,分别为(23±2)[3]和(14±6)[10]。然而,在超肺保护性通气期间,可能需要保持最低呼吸频率(4次/min)来维持肺容量和避免通气不足[8]。
3.5机械能
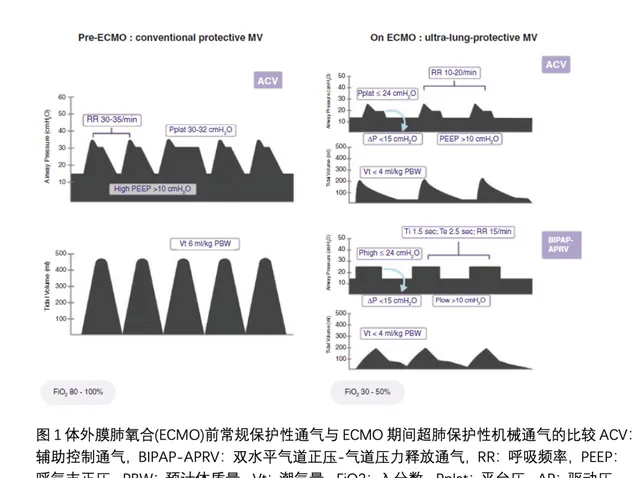
机械能代表由呼吸机传递给呼吸系统的能量[23]。它是跨肺压、潮气量和呼吸频率的函数,并被证明与ARDS患者在>为17 J/min时的死亡率独立相关[24]。在ECMO过程中应用超肺保护性通气可显著降低机械能。事实上,与EOLIA试验中的对照组相比,ECMO组的机械能显著下降(10 J/min vs. 28 J/min),这一效应是由潮气量和呼吸频率分别降低43%和23%介导的[25]。同样,在LIFEGARDS队列研究[10]中,ECMO启动后的平均机械能从26 J/min降低至6.6 J/min。虽然机械能的概念有一定的局限性,但它可以量化所有可调节的机械通气参数(潮气量、呼吸频率、驱动压、PEEP、吸呼比、吸气流量)对VILI的影响。虽然其计算方法可能有助于指导目前的临床实践(图1),但仍不确定应在多大程度降低ECMO患者的机械能。
3.6应用呼吸暂停通气?
最近一项在10例接受VV-ECMO治疗的ARDS患者中进行的随机交叉生理学研究提出[18],将潮气量降至4 ml/kg以下可能不足以防止机械通气对炎症和不均一肺带来的过度应变(定义为潮气量/呼气末肺容积)。在这项研究中,尽管呼吸系统顺应性低的患者的平均潮气量为2.4 ml/kg,但其生物创伤和VILI的显著风险仍然存在。在机械通气过程中,吸气压力的变化与血浆可溶性晚期糖基化终末产物受体(S-RAGE)、白细胞介素(IL) -6、肿瘤坏死因子(TNF) - α浓度之间存在线性关系。在持续气道正压通气(CPAP)模式(10 cmpO)中,不进行潮气量通气时生物创伤最低。同样,Graf等在一项前瞻性、单中心生理学研究[26]中比较了24例接受VV-ECMO的重度ARDS患者的肺保护性通气和呼吸暂停通气。尽管驱动压较低(11.9±5.8 cmpO),但超肺保护性通气与应力、应变和机械能增加相关。在VV-ECMO支持的ARDS大动物模型中[27],与常规通气策略相比,近呼吸暂停通气(驱动压10cmpO, PEEP 10cmpO,呼吸频率5次/min)也与肺损伤和纤维增殖减少相关。虽然(近)呼吸暂停通气可能是降低ECMO期间VILI的最终策略,但目前广泛应用还需要更多的数据和更大规模的以患者为中心的研究。还应评估近呼吸暂停通气的局限性。无肺循环可能产生短期和长期的生理后果,可能需要更深的镇静,有时需要连续的神经肌肉阻滞来控制呼吸驱动,以及随后的患者自身造成的肺损伤(P-SILI)。该操作还需要更高的VV-ECMO回路血流量以达到充分的氧合,可能引起溶血等并发症。
3.7保留自主通气和膈肌功能以减少P-SILI?
通过允许自主呼吸运动来保留膈肌功能可能有助于机械通气的撤机,因为机械通气时,膈肌短时间(18-69小时)不运动与跨膈压降低55%以及慢肌和快肌膈纤维显著萎缩相关[28]。另一方面,在高呼吸驱动和低肺顺应性的患者中,自主呼吸可能与强烈的呼吸努力和跨肺压升高相关,导致P-SILI[29,30]。虽然从控制通气转换为辅助自主通气有多项益处(保留肌肉功能、降低镇静深度、改善血流动力学),但对于接受ECMO的最严重类型ARDS患者,在维持(部分)膈肌活动的同时尽量减少P-SILI具有挑战性。在这种情况下,结合控制平台压和驱动压,同时允许非同步自主呼吸的APRV模式可能是有益的。
4ECMO时如何设置最佳PEEP
与任何干预措施一样,超肺保护性通气策略并非毫无风险。事实上,由此导致的平均气道压下降可能导致肺复张不足、肺不张和生物创伤。严重损伤的肺也可同时发生肺萎陷和过度扩张。有趣的是,在对ECMO专科医师进行的一项国际调查中,77%患者的PEEP≤10 cmpO,而ELSO指南建议在ECMO支持期间采用中等水平的PEEP (10 cmpO) [7]。然而,ARDS患者的最佳PEEP因患者而异,并取决于几个因素(肺泡可复张性、胸膜压力、体重和血流动力学),并且也可能在病程中迅速演变。因此,为特定患者和特定时间点选择合适的PEEP具有挑战性,「一刀切」的策略可能没有任何临床益处。最近,有几种方法来指导临床医师在ECMO超保护性通气期间实现PEEP的个体化水平(图2)。

4.1电阻抗断层成像指导策略
电阻抗断层成像(Electrical impedance tomography, EIT)可在床旁对肺部进行个体化、无创、无辐射成像,并进行全局和局部的动态肺分析。该技术用图形表示肺通气的区域分布,并提供通气的实时信息,包括通气分布的异质性、区域潮气量和呼吸系统顺应性的重力分布。它能识别肺内阻抗的变化,并能区分通气和非通气的肺泡单位。因此,EIT可以指导PEEP滴定和最佳设置,最大限度地减少肺萎陷和过度扩张。Franchineau等表明,在由15例ECMO患者组成的研究中,由EIT衍生的「最佳折中」PEEP存在广泛差异,有7例、6例和2例患者的值分别为15 cmpO、10 cmpO和5 cmpO,但从未选择PEEP 20 cmpO和PEEP 0 cmpO [31]。通过EIT评估各侧肺内关闭的气道和开放的气道分布情况,以及两肺之间的通气情况(生物创伤AiCLOSE研究,Biotrauma AiCLOSE Study,ClinicalTrials.gov Identifier: NCT05196074)。
EIT有其局限性。首先,该技术仅提供特定肺区域的横断面评估(可能与全肺不同),且仅捕获腹侧-背侧区域通气分布。第二,它需要特定的设备,目前还没有得到广泛应用,且数据的获取费时。最后,关于确定最佳PEEP水平的EIT目标参数仍缺乏共识。这种以EIT为指导的通气策略对进一步降低ECMO期间VILI的获益值得进一步研究。
4.2跨肺压指导策略
平台压是对肺施加压力的压力梯度的替代指标,即跨肺压。由于胸膜压与食管压相关,因此食管测压仪可用于计算呼气末跨肺压。这种以压力为导向的最优化PEEP策略可以限制肺不张,并将肺过度扩张的风险降至最低。它已被用于确定适合ECMO的患者(即尽管有最佳PEEP,但仍存在难治性低氧血症)[20]或优化ECMO的PEEP[32]。在后项研究中,接受VV-ECMO治疗的患者被随机分配接受跨肺压指导通气(n = 52)或肺休息策略(n = 52)[32]。与肺休息组相比,跨肺压指导组的撤机成功率较高,60天死亡率显著较低(33% vs. 54%, p = 0.03), ECMO上机时间较短(p = 0.004)。然而,在ARDS患者中,跨肺压指导策略仍存在争议,且在EPVent-2试验结果中不支持[33]。
4.3其他方法
肺脏超声可用于指导ARDS患者机械通气的设置,床旁评估肺复张情况[34]。在一系列接受常规机械通气的ARDS患者中,肺部超声评分的变化与PEEP诱导的呼气末肺容积增加相关,并且在接受ECMO治疗的18例患者中,也与计算机断层扫描(CT)数据显著相关。
肺复张与肺膨胀(R/I)比值是最近开发的一种评估肺复张潜力的工具。它的计算方法是应用高PEEP后复张肺的顺应性与在较低PEEP下测量的呼吸系统的顺应性的比值。该参数可以在ICU床旁使用任何呼吸机轻易测量,并可能有助于优化呼吸机设置,特别是PEEP[37]。到目前为止,还没有这一参数在极低潮气量的ECMO中的研究。
5 ECMO期间的俯卧位
俯卧位是中重度ARDS患者的有效的一线干预措施[38],且应在考虑使用ECMO之前强制实施。然而,尽管ECMO期间俯卧位通气的应用越来越多,尤其是在2019冠状病毒病(COVID-19)大流行期间,这一操作仍存在争议。几项观察性研究和最近的一项荟萃分析表明,在ECMO期间俯卧位是可行的、安全的,且可加快ECMO撤机并改善结局[39,40]。迄今为止,缺乏随机对照试验、担心意外脱管以及护理人员培训困难仍然是该操作在ECMO患者中推广使用的障碍,尤其是在ECMO容量较低的中心。正在进行中的PRONECMO随机对照试验(ClinicalTrials.gov Identifier: NCT04607551)的结果可能有助于阐明ECMO患者俯卧位的适应证。
6 ECMO气体交换目标
关于接受ECMO支持的ARDS患者的氧合、二氧化碳或pH的管理,目前尚无循证指南。尽管低氧血症和高氧血症均与死亡率增加相关[41],低氧血症和高碳酸血症的安全范围尚未确定。在获得更多数据前,EOLIA试验中实施的气体交换目标(PaO2 65-90 mmHg;PaCO2 < 45 mmHg)[3]最常被推荐。由于目前的ECMO膜可显著降低机械通气强度,并在残余肺功能极低的情况下确保充分的气体交换,因此呼吸机FiO2应降低至最低值。此外,在低通气-灌注比的肺区域,高浓度的FiO2可能导致脱氮性肺不张,尤其是当低PEEP时[42]。最后,ECMO启动后应避免高碳酸血症的快速纠正,因其与神经系统并发症的发生相关[43]。
7 ECMO撤机过程中的机械通气
目前,ECMO撤机过程中机械通气的关注较少。在EOLIA试验中,当「临床、放射学、气体测量和肺顺应性改善」时,患者转为容量辅助控制通气,潮气量设置为6 ml/kg[3]。最近,在一项含83例ECMO撤机患者的系列中,在扫气试验期间潮气量、心率、通气比和食管压力波动较大的患者安全脱离VV-ECMO的可能性较低[44]。如前所述,ECMO期间的俯卧位也可能有助于脱机。
8结论
ARDS患者ECMO治疗期间的机械通气应以降低VILI程度为目标。然而,在ECMO治疗过程和撤机阶段应如何调整特定的呼吸机变量仍需要进一步的研究来确定。在此之前,EOLIA呼吸机设置[3]不失为一个合理的选择。
参考文献:略











